文章来源:中华结核和呼吸杂志, 2018,41(10) : 763-771
作者:中华医学会呼吸病学分会肺癌学组 中国肺癌防治联盟专家组
2015年首部"肺部结节诊治中国专家共识"[1]发表以后,各个国家与地区相继对肺结节诊治指南进行了更新,这些指南与共识的更新完善了肺结节的诊治与管理策略。在此背景下,为了与时俱进,博采众长,在总结我国首部肺结节诊治共识[1]的经验和推广过程中遇到的问题,并广泛听取了多学科专家的意见,参考了"肺结节评估:亚洲临床实践指南"[2]及其他学科共识或指南[3,4,5,6,7]后,对原有共识进行了修订。更新内容主要有以下几个方面:细化了肺结节的分类,对肺结节、微小结节进行了精确的定义;定义了我国肺癌高危人群,推荐进行低剂量CT筛查;强调了肺结节的影像学诊断和鉴别诊断;注重准时随访并观察肺结节的外部结构和内部特征等,旨在提高我国各级医院医生对肺结节的诊治水平。
一、肺结节的定义和分类
(一)肺结节的定义[1,2,3,4,5]
影像学表现为直径≤3 cm的局灶性、类圆形、密度增高的实性或亚实性肺部阴影,可为孤立性或多发性,不伴肺不张、肺门淋巴结肿大和胸腔积液。孤立性肺结节多无明显症状,为边界清楚、密度增高、直径≤3 cm且周围被含气肺组织包绕的软组织影。多发性肺结节常表现为单一肺结节伴有一个或多个小结节,一般认为>10个的弥漫性肺结节多为恶性肿瘤转移或良性病变(感染或非感染因素导致的炎症性疾病)所致;局部病灶直径>3 cm者称为肺肿块,肺癌的可能性相对较大,不在本共识讨论的范围内。
(二)分类[1,2,3,4,5]
1.数量分类:
单个病灶定义为孤立性,2个及以上的病灶定义为多发性。
2.病灶大小分类:
为便于更好地指导分级诊疗工作,对肺结节患者进行精准管理,特别将肺结节中直径<5 mm者定义为微小结节,直径为5~10 mm者定义为小结节。微小结节可在基层医院管理;小结节可在有诊治经验的医院,如中国肺癌防治联盟肺结节诊治分中心管理;10~30 mm的肺结节则应尽早请有经验的专家诊治。随访时间仍根据流程分别管理实性和亚实性肺结节。
3.密度分类[1,2,3,4,5]:
可分为实性肺结节和亚实性肺结节,后者又包含纯磨玻璃结节和部分实性结节:(1)实性肺结节(solid nodule):肺内圆形或类圆形密度增高影,病变密度足以掩盖其中走行的血管和支气管影;(2)亚实性肺结节(subsolid nodule):所有含磨玻璃密度的肺结节均称为亚实性肺结节,其中磨玻璃病变指CT显示边界清楚或不清楚的肺内密度增高影,但病变密度不足以掩盖其中走行的血管和支气管影。亚实性肺结节中包括纯磨玻璃结节(pure ground-class nodule,pGGN)、磨玻璃密度和实性密度均有的混杂性结节(mixed ground-glass nodule,mGGN),后者也称部分实性结节(part solid nodule)。如果磨玻璃病灶内不含有实性成分,称为pGGN;如含有实性成分,则称为mGGN。
二、筛查人群和评估手段[1,2,3,4,5,6,7,8,9]
(一)筛查人群
2011年美国国家肺癌筛查试验(National Lung Screening Trial,NLST)的随机对照研究结果显示,与X线胸片相比,采用胸部低剂量CT对高危人群进行筛查可使肺癌的病死率下降20%[8],鉴于上述研究结果,我国推荐肺癌高危人群应每年进行低剂量CT筛查,以早期诊断肺癌[9]。因我国吸烟及被动吸烟人群比例较高、大气污染及肺癌发病年轻化的现状,参考美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)肺癌筛查指南、美国胸科医师学会(American College of Chest Physicians,ACCP)发布的临床指南[3,6]及中华医学会放射学分会心胸学组发布的"低剂量螺旋CT肺癌筛查专家共识"[9],建议将我国肺癌高危人群定义为年龄≥40岁且具有以下任一危险因素者:(1)吸烟≥20包年(或400年支),或曾经吸烟≥20包年(或400年支),戒烟时间<15年;(2)有环境或高危职业暴露史(如石棉、铍、铀、氡等接触者);(3)合并慢阻肺、弥漫性肺纤维化或既往有肺结核病史者;(4)既往罹患恶性肿瘤或有肺癌家族史者。
(二)评估手段:包括临床信息、影像学、肿瘤标志物、功能显像、非手术和手术活检
1.临床信息:
采集与诊断和鉴别诊断相关的信息,如年龄、职业、吸烟史、慢性肺部疾病史、个人和家族肿瘤史、治疗经过及转归,可为鉴别诊断提供重要参考意见。
2.影像学检查[1,2,3,4,5,6,9]:
虽然X线能够提高肺癌的检出率,但大多数<1 cm的结节在X线胸片上不显示,故不推荐X线胸片用于肺结节的常规评估。与胸部X线相比,胸部CT扫描可提供更多关于肺结节位置、大小、形态、密度、边缘及内部特征等信息。推荐肺结节患者行胸部CT检查(结节处行病灶薄层扫描),以便更好地显示肺结节的特征(1C级)。薄层(≤1 mm层厚)的胸部CT可更好地评价肺结节的形态特征。分析肿瘤体积可科学地监测肿瘤生长。建议设定低剂量CT检查参数和扫描的范围为:(1)扫描参数:总辐射暴露剂量为1.0 mSv;kVp为120,mAs≤40;机架旋转速度为0.5;探测器准直径≤1.5 mm;扫描层厚5 mm,图像重建层厚1 mm;扫描间距≤层厚(3D成像应用时需有50%重叠)。(2)扫描范围:从肺尖到肋膈角(包括全部肺),扫描采样时间≤10 s,呼吸时相为深吸气末,CT扫描探测器≥16排,不需要注射对比剂。
3.肿瘤标志物[1,10]:
目前尚无特异性生物学标志物应用于肺癌的临床诊断,但有条件者可酌情进行如下检查,为肺结节诊断和鉴别诊断提供参考依据[10]:(1)胃泌素释放肽前体(pro gastrin releasing peptide,Pro-GRP):可作为小细胞肺癌的诊断和鉴别诊断的首选标志物;(2)神经特异性烯醇化酶(neurone specific enolase,NSE):用于小细胞肺癌的诊断和治疗反应监测;(3)癌胚抗原(carcino-embryonic antigen, CEA):目前血清中CEA的检查主要用于判断肺腺癌复发、预后以及肺癌治疗过程中的疗效观察;(4)细胞角蛋白片段19(cytokeratin fragment,CYFRA21-1):对肺鳞癌的诊断有一定参考意义;(5)鳞状细胞癌抗原(squarmous cell carcinoma antigen,SCC):对肺鳞癌疗效监测和预后判断有一定价值。如果在随访阶段发现上述肿瘤标志物有进行性增高,需要警惕早期肺癌。
4.功能显像[1,2,3,4]:
对于不能定性的直径>8 mm的实性肺结节采用正电子发射计算机断层显像-计算机断层扫描(PET-CT)区分良性或恶性[11]。PET-CT对pGGN及实性成分≤8 mm肺结节的鉴别诊断无明显优势[12]。对于实性成分>8 mm的肺结节,PET-CT有助于鉴别良性或恶性,其原理是基于肿瘤细胞具有较高的葡萄糖摄取与代谢率,在患者体内注射18氟标记的脱氧葡萄糖(18F-FDG)后,再测量被结节摄取的18F-FDG,恶性结节18F-FDG摄取较多。标准化摄取值(standardized uptake value,SUV)是PET-CT常用的重要参数,反映病灶对放射示踪剂摄取的程度;当SUV值>2.5时,恶性肿瘤的可能性很大。近年来多项研究结果显示,PET-CT诊断恶性肺结节的敏感度为72%~94%[3]。此外PET-CT还可为选择穿刺活检部位提供重要依据。
动态增强CT扫描对良恶性肺结节的鉴别诊断有一定价值[3]。在一项评估5~40 mm非钙化肺部病变良恶性的研究中,动态增强CT扫描显示增强>15 HU时,区分肺部良恶性病变的敏感度和特异度分别为98%和58%[13]。
5.非手术活检[3]:
(1)气管镜检查:常规气管镜检查是诊断肺癌最常用的方法,包括气管镜直视下刷检、活检或透视下经支气管镜肺活检(transbronchial lung biopsy, TBLB)及支气管肺泡灌洗获取细胞学和组织学诊断。自荧光气管镜(autofluorescence bronchoscopy,AFB)是近年来发展起来的对中央型肺癌早期诊断的新方法,利用良恶性细胞自发荧光特性的不同,可显著提高气管支气管黏膜恶变前病灶(不典型增生)或早期恶变(原位癌)的检出率。支气管内超声引导下肺活检术(EBUS-TBLB)采用外周型超声探头观察外周肺病变,并在支气管超声引导下行EBUS-TBLB,较传统TBLB技术的定位更精确,可进一步提高外周肺结节活检的阳性率。一项随机对照研究结果显示,EBUS-TBLB对≤20 mm的恶性肺外周病变的诊断敏感度为71%,而常规气管镜TBLB仅为23%[14]。虚拟导航气管镜(virtual bronchoscopic navigation, VBN)[15]利用薄层高分辨率CT图像重建三维图像并规划路径,由医生确定最佳路径,VBN系统通过气管路径的动画,为到达活检区域提供完全视觉化的引导。为保证达到目标肺组织,目前常采用可活检的超细气管镜,在其引导下超细气管镜可进入到第5~8级支气管进行活检。电磁导航气管镜(electromagnetic navigation bronchoscopy,ENB)[16,17]由电磁定位板、定位传感接头、工作通道、计算机软件系统与监视器等部件组成,将物理学、信息学、放射学技术和气管镜技术相融合,使传统气管镜无法检测到的周围肺组织病变的检测成为现实。EBUS和VBN或ENB联合应用可提高对周围型肺部病变的诊断率,且安全性高,在肺结节鉴别诊断和早期肺癌诊断方面有一定的应用前景。一项系统回顾分析结果显示[15],使用EBUS、ENB、VBN等气管镜检查技术对于周围型肺部病变的总体诊断率为70%,其中≤20 mm病灶的诊断率为61%,>20 mm病灶的诊断率82%。最近我国一项单中心研究结果显示,EBUS联合ENB对肺结节的诊断率达到82.5%[18]。(2)经胸壁肺穿刺活检术(transthoracic needle biopsy,TTNB)[3]:可在CT或超声引导下进行,对周围型肺癌诊断的敏感度和特异度均较高[19,20]。病变靠近胸壁者可在超声引导下进行活检,对于不紧贴胸壁的病变,可在透视或CT引导下穿刺活检。
6.手术活检:
(1)胸腔镜检查:适用于无法经气管镜和经胸壁肺穿刺活检术(TTNB)等检查方法取得病理标本的肺结节,尤其是肺部微小结节病变行胸腔镜下病灶切除,即可明确诊断。(2)纵隔镜检查:作为确诊肺癌和评估淋巴结分期的有效方法,是目前临床评价肺癌患者纵隔淋巴结状态的金标准,可弥补EBUS的不足。
三、肺结节的影像学诊断要点和临床恶性概率评估[1,2,3,4,5]
(一)肺结节的影像学诊断和鉴别诊断要点[3,5]
可以从外观评估和探查内涵两个角度初步判断肺结节的良恶性,包括结节大小、形态、边缘及瘤-肺界面、内部结构特征及随访的动态变化。功能显像可进一步协助区分肺结节的良恶性。
1.外观评估:
(1)结节大小:随着肺结节体积增大,其恶性概率也随之增加。但肺结节大小的变化对GGN的定性诊断价值有限,还需密切结合形态及密度的改变;(2)结节形态:大多数恶性肺结节的形态为圆形或类圆形,与恶性实性结节相比,恶性亚实性结节出现不规则形态的比例较高;(3)结节边缘:恶性肺结节多呈分叶状,或有毛刺征(或称棘状突起),胸膜凹陷征及血管集束征常提示恶性的可能;良性肺结节多数无分叶,边缘可有尖角或纤维条索等,周围出现纤维条索、胸膜增厚等征象则常提示结节为良性;(4)结节-肺界面:恶性肺结节边缘多清楚但不光整,结节-肺界面毛糙甚至有毛刺;炎性肺结节边缘多模糊,而良性非炎性肺结节边缘多清楚整齐甚至光整。需要注意的是,GGN病变的浸润性与实性结节相比相对较低,病灶周围毛刺征的出现概率也相对较低。
根据外观判断良恶性是"以貌取人",尽管"分叶、毛刺、胸膜凹陷征"是恶性病变的特点,但由于小结节中的早期肺癌很少见到这些特点,所以同时需要内部特征协助鉴别诊断。
2.内部特征:
(1)密度[10,11]:密度均匀的pGGN,尤其是<5 mm的pGGN常提示不典型腺瘤样增生(atypical adenomatous hyperplasia, AAH)[21];密度不均匀的mGGN,实性成分超过50%常提示恶性可能性大[22],但也有报道微浸润腺癌(minimally invasive adenocarcinoma,MIA)或浸润性腺癌(invasive adenocarcinoma,IA)也可表现为pGGN;持续存在的GGN大多数为恶性,或有向恶性发展的倾向;GGN的平均CT值对鉴别诊断具有重要参考价值,密度高则恶性概率大,密度低则恶性概率低,当然也需要结合结节大小及其形态变化综合判断。(2)结构:支气管被包埋且伴局部管壁增厚,或包埋的支气管管腔不规则,则恶性可能性大。为了更加准确评估结节病灶内及周边与血管的关系,可通过CT增强扫描,将≤1 mm层厚的CT扫描图像经图像后处理技术进行分析、重建,结节血管征的出现有助于结节的定性。
3.功能显像:
对于pGGN和≤8 mm的肺结节一般不推荐功能显像[12];对于不能定性的直径>8 mm的实性肺结节建议进行功能显像,推荐PET-CT扫描区分良恶性。增强CT扫描显示增强>15 HU,提示恶性结节的可能性大[13]。
4.定期随访[23,24,25,26]:
定期随访比较肺结节的外部结构和内部特征,对肺结节的良恶性鉴别诊断具有重要意义,随访时要注意和保证每次检查的扫描方案、扫描参数、图像显示、重建方法和测量方法一致。建议在软件协助阅读的条件下观察。
随访中肺结节有如下变化者,多考虑为良性:(1)短期内病灶外部特征变化明显,无分叶或出现极深度分叶,边缘变光整或变模糊;(2)密度均匀或变淡;(3)在密度没有增加的情况下病灶缩小或消失;(4)病灶迅速变大,倍增时间<15 d;(5)实性结节病灶2年以上仍然稳定,但这一特征并不适用于GGN,因原位腺癌(adenocarcinoma in situ, AIS)和MIA阶段的GGN可以长期稳定。所以这里定义的长期指需要超过2年或更长时间,但究竟稳定时间多长提示良性,还需要更加深入的研究。
肺结节在随访中有以下变化时,多考虑为恶性:(1)直径增大,倍增时间符合肿瘤生长规律;(2)病灶稳定或增大,并出现实性成分;(3)病灶缩小,但出现实性成分或其中实性成分增加;(4)血管生成符合恶性肺结节规律;(5)出现分叶、毛刺和或胸膜凹陷征。
(二)临床恶性概率的评估[3,26]
尽管不能可靠地区分多数肺结节的良恶性,但在活检之前根据临床信息和影像学特征评估临床恶性肿瘤的概率(表1)仍具有重要意义,有助于选择合适的后续检查方法和随访模式。
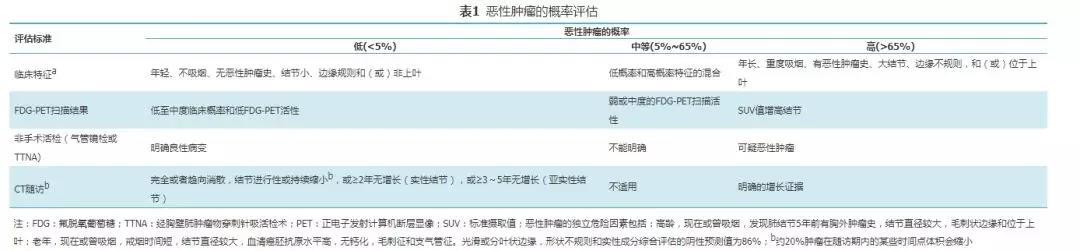
ACCP指南采用的是由梅奥临床研究人员开发的最广泛应用的预测模型。原研究使用多因素logistic回归方法分析了419例非钙化、胸部影像学检查结节直径为4~30 mm的患者,确定了6种独立的预测恶性肿瘤的因子,其中包括年龄(OR值为1.04/年)、目前或过去吸烟史(OR值为2.2)、结节发现前的胸腔外恶性肿瘤史>5年(OR值为3.8)、结节直径(OR值为1.14/mm)、毛刺征(OR值为2.8)和位于上叶(OR值为2.2)。预测模型:恶性概率=ex/(1+ex);X=-6.827 2+(0.039 1×年龄)+(0.791 7×吸烟史)+(1.338 8×恶性肿瘤)+(0.127 4×直径)+(1.040 7×毛刺征)+(0.783 8×位置),其中e是自然对数,年龄为患者的年龄(岁),如果患者目前或以前吸烟,则吸烟史=1(否则=0);如果患者有胸腔外恶性肿瘤史>5年,则恶性肿瘤=1(否则=0);直径为结节的直径(mm),如果结节边缘有毛刺征,则毛刺征=1(否则=0);如果结节位于上叶,则位置=1(否则=0)。值得注意的是,对于判断恶性肿瘤的准确性,尽管模型预测结果和临床医生判断结果相近,但两者之间的相关性较差,故建议依据目标人群的特点、易用性以及验证的程度来选择模型。此外,ACCP指南中"位于上叶的肺结节肿瘤概率大"并不完全适合我国和大部分亚太地区的国家和地区,因为上叶尖后段也是肺结核的好发部位。
四、孤立性实性肺结节的评估与处理原则
(一)8~30 mm的肺结节[1,2,3,4,5]
可根据图1的流程评估直径为8~30 mm的实性结节,同时考虑表2中列出的影响直径8~30 mm实性结节评估和处理的因素。


注:流程中手术活检步骤如下:手术并发症风险高的人群中,推荐CT扫描随访(当临床恶性肿瘤的概率是低到中等)或非手术活检(当临床恶性肿瘤的概率是中到高度)
图1 直径8~30 mm实性肺结节的临床管理流程
1.单个不明原因结节直径>8 mm者:
建议临床医生通过定性地使用临床判断和(或)定量地使用验证模型评估恶性肿瘤的预测概率(2C级)。
2.单个不明原因结节直径>8 mm,且恶性肿瘤的预测概率为低、中度(5%~65%)者:
建议行功能成像,有条件者可考虑PET-CT,以便更好地描述结节的特征(2C级)。
3.单个不明原因结节直径>8 mm,且恶性肿瘤的预测概率为高度(>65%)者:
视情况决定是否使用功能成像(2C级)[27],对于高度怀疑肿瘤者可考虑直接行PET-CT[12],因其可同时进行手术前的预分期[28]。
4.单个不明原因结节直径>8 mm者:
建议讨论无法取得病理诊断的替代性管理策略的风险和益处,并根据患者对管理的意愿而决定(1C级)。
5.单个不明原因结节直径>8 mm者,建议在下列情况下采用定期CT扫描随访(2C级):
(1)当临床恶性概率很低时(<5%);(2)当临床恶性概率低(
6.单个不明原因结节直径>8 mm者:
建议在3~6个月、9~12个月及18~24个月进行薄层、低剂量CT扫描(2C级)。需注意的是:(1)定期CT扫描结果应与以前所有的扫描结果对比,尤其是最初的CT扫描;(2)如果有条件,可行手动和(或)计算机辅助测量面积、体积和(或)密度,以便早期发现病灶的生长。
7.单个不明原因结节直径>8 mm者:
在定期的影像学随访中有明确倾向的恶性肿瘤增长证据时,若无特别禁忌,建议考虑非手术活检[14,15,16,17,18,19,20]和(或)手术切除[29,30](1C级)。
8.单个不明原因结节直径>8 mm者:
建议在伴有下列情况时采取非手术活检(2C级)[14,15,16,17,18,19,20]:(1)临床预测概率与影像学检查结果不一致;(2)恶性肿瘤的概率为低、中度;(3)疑诊为可行特定治疗的良性疾病;(4)患者在被充分告知后,仍希望在手术前证明是恶性肿瘤,尤其是当手术并发症风险高时。需注意的是,选择非手术活检应基于:①结节大小、位置和相关气道的关系;②患者发生并发症的风险;③可行的技术及术者的熟练程度。
9.单个不明原因结节直径>8 mm者:
建议在下列情况下行手术诊断(2C级)[29,30,31]:(1)临床恶性肿瘤概率高(>65%);(2)PET-CT显示结节高代谢或增强CT扫描为明显阳性时;(3)非手术活检为可疑恶性肿瘤;(4)患者在被充分告知后,愿意接受一种明确诊断的方法。
10.单个不明原因结节直径>8 mm者:选择外科诊断时,建议考虑胸腔镜诊断性亚肺叶切除术[29,30,31](1C级)。需注意的是,对深部和难以准确定位的小结节,可考虑应用先进的定位技术或开胸手术。
(二)≤8 mm的肺结节[1,2,3,4]
可根据图2流程评估≤8 mm的实性结节,并注意以下具体事项:(1)单个实性结节直径≤8 mm且无肺癌危险因素者,建议根据结节大小选择CT随访的频率与持续时间(2C级):①结节直径≤4 mm者不需要进行随访,但应告知患者不随访的潜在好处和危害;②结节直径4~6 mm者应在12个月重新评估,如无变化,其后转为常规年度随访;③结节直径6~8 mm者应在6~12个月之间随访,如未发生变化,则在18~24个月之间再次随访,其后转为常规年度检查。CT检测实性结节>8 mm时,建议使用低剂量CT平扫技术。(2)存在一项或更多肺癌危险因素的直径≤8 mm的单个实性结节者,建议根据结节的大小选择CT随访的频率和持续时间(2C级):①结节直径≤4 mm者应在12个月重新评估,如果没有变化则转为常规年度检查;②结节直径为4~6 mm者应在6~12个月之间随访,如果没有变化,则在18~24个月之间再次随访,其后转为常规年度随访;③结节直径为6~8 mm者应在最初的3~6个月之间随访,随后在9~12个月随访,如果没有变化,在24个月内再次随访,其后转为常规年度检查。CT检测实性结节≤8 mm时,建议使用低剂量CT平扫技术。

图2 直径≤8 mm实性肺结节的临床管理流程
五、孤立性亚实性肺结节评估与处理原则
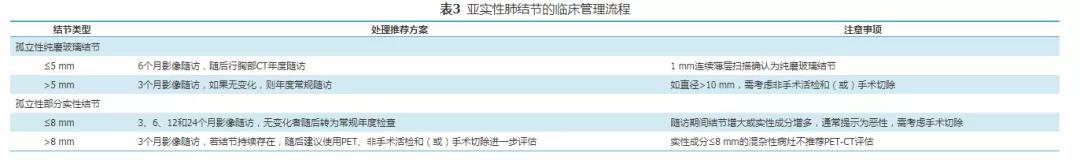
可参照表3列出的亚实性肺结节的随诊推荐方案和注意事项进行管理。
(一)评估pGGN的细则[1,2,3,4,5,6]
pGGN以5 mm大小为界进行分类观察:(1)pGGN直径≤5 mm者:建议在6个月随访胸部CT,随后行胸部CT年度随访。(2)pGGN直径>5 mm者:建议在3个月随访胸部CT,随后行胸部CT年度随访;如果直径超过10 mm,需非手术活检和(或)手术切除(2C级)。需注意的是:①pGGN的CT随访应对结节处采用薄层平扫技术;②如果结节增大(尤其是直径>10 mm),或出现实性成分增加,通常预示为恶性转化,需进行非手术活检和(或)考虑切除;③如果患者同时患有危及生命的合并症,而肺部结节考虑为低度恶性不会很快影响到生存,或可能为惰性肺癌而无需即刻治疗者,则可限定随访时间或减少随访频率。
(二)评估mGGN的细则[1,2,3,4,5,6]
对于mGGN,除评估mGGN病灶大小外,其内部实性成分的比例更加重要。当CT扫描图像中实性成分越多,提示侵袭性越强。
1.单个mGGN直径≤8 mm者:建议在3、6、12和24个月进行CT随访,无变化者随后转为常规年度随访,随访中需要注意:(1)混杂性结节的CT随访检查应对结节处采用病灶薄层平扫技术;(2)如果混杂性结节增大或实性成分增多,通常提示为恶性,需考虑切除,而不是非手术活检;(3)如果患者同时患有危及生命的合并症,而肺部结节考虑为低度恶性不会很快影响到生存,或可能为惰性肺癌而无需即刻治疗者,则可限定随访时间或减少随访频率;(4)如果发现结节的同时有症状或有细菌感染征象时,可考虑经验性抗菌治疗。尽管经验性抗菌治疗有潜在的危害,但如果患者患有如结核、真菌等其他疾病可能性较小时,可以考虑使用经验性抗菌治疗。
2.mGGN直径>8 mm者:建议在3个月重复胸部CT检查,适当考虑经验性抗菌治疗。若结节持续存在,随后建议使用PET-CT、非手术活检和(或)手术切除进一步评估(2C级)。需注意的是:(1)PET-CT不应该被用来描述实性成分≤8 mm的混杂性病灶;(2)非手术活检可用于确立诊断并结合放置定位线、植入放射性粒子或注射染料等技术帮助后续手术切除的定位;(3)非手术活检后仍不能明确诊断者,不能排除恶性肿瘤的可能性;(4)mGGN直径>15 mm者可直接考虑进一步行PET-CT评估、非手术活检和(或)手术切除。
3.对于6 mm及以上实性成分的mGGN,应考虑3~6个月行CT扫描随访来评估结节。对于具有特别可疑形态(即分叶或囊性成分)、连续生长或实性成分>8 mm的mGGN,建议采用PET-CT、活检或切除术。大量的证据提示,mGGN的实性成分越多,发生侵袭和转移的风险越大,实性成分>5 mm与局部侵袭的可能性相关。
六、多发性肺结节评估与处理原则[1,2,3,4,5]
非孤立性多发性肺结节应注意如下方面。
1.评估中发现有1个占主导地位的结节和(或)多个小结节者,建议单独评估每个结节。
2.除非有组织病理学证实转移,否则不可否定根治性治疗(2C级)。
3.对于多发性pGGN,至少1个病变直径>5 mm,但<10 mm,又没有特别突出的病灶,推荐首次检查后3个月再行CT随访;如无变化,其后至少3年内每年1次CT随访,其后也应长期随访,但间隔期可以适当放宽。如果发现病灶变化,应调整随访周期;如果结节增多、增大、增浓,应缩短随访周期,或通过评估病灶部位、大小和肺功能情况,选择性局部切除变化明显的病灶;如果结节减少、变淡或吸收则延长随访周期或终止随访。
4.尽管PET-CT较难鉴别直径≤8 mm结节的性质,但是PET-CT扫描仍有助于诊断转移性肺癌,指导进一步评估。
5.对有1个以上肺结节的肺癌患者进行分类和采取最佳治疗存在困难时,建议多学科讨论。
6.可考虑新技术,如EBUS、VBN和ENB,可在一次检查操作中对多个较小的周边病灶进行活检和组织病理学评估。
7.一般认为>10个弥漫性结节,很可能伴有症状,可由胸外恶性肿瘤转移或活动性感染导致,原发性肺癌的可能性相对较小。但单一主要结节伴有一个或多个小结节的现象越来越普遍,需要进行仔细鉴别诊断。
七、物联网技术辅助评估与管理[1,2,7]
由于早期肺癌(原位和ⅠA期肺癌)多位于直径1 cm的结节内,大多很难取得活体组织标本明确病理诊断,基于临床信息和影像学特征的临床恶性概率评估对诊断早期肺癌具有重要意义。但目前各医院和医生之间医学影像诊断和临床经验差别很大,形成水平高低不一、手工业作坊式的诊疗模式,无法做到同质化,结果造成部分医院和医生对早期肺癌延误诊断率较高,部分医院和医生对早期肺癌的过度治疗率较高。所以,即使有了早期肺癌诊断技术,没有同质化的推广和质量控制方法,简单易行的早期肺癌诊断技术也无法产生应有的社会和经济效益。物联网医学的出现为达到这一目的创造了新契机[7],基于物联网医学平台,既有利于广泛筛查无症状的肺结节患者,对早期肺癌及时进行同质化的精准诊断与科学有效的管理,也有利于联合云中专家进行多学科会诊和随访跟踪。物联网医学技术可从二方面协助肺结节诊断和鉴别诊断,提高早期肺癌诊断和治疗水平。除了运用多种诊断技术,包括视频、电话和网络链接,推动肺结节的早期发现和及时干预外,还可作为特殊远程放射和会诊技术,利于改善偏远地区的卫生保健服务并提升当地专业水平。如有必要,具备网络医疗技术能力的医院应该考虑应用远程医疗协助诊断肺结节。应用远程医疗网络系统、信息挖掘和监控功能协助同质化管理,协助多学科专家会诊和随访。
1.采集信息:物联网医学技术可方便地采集和输入鉴别诊断相关信息,甚至可以直接将病情和病历等发送给其主治的专科医生,为鉴别诊断提供重要参考意见。
2.信息深度挖掘:为提高肺结节的鉴别诊断率,在低剂量CT检查时需描述肺结节所在部位(叶、段以及是否位于胸膜下)、大小(测量最长径,有条件的单位可计算结节体积)、密度(实性、混合性、磨玻璃样)、钙化(有、无,中央、偏心,爆米花样、同心环型、分散点状)、形状(圆形、卵圆形、片状、不规则)、边缘(光滑、分叶、毛刺)。对于随访者,还需与历史影像学资料比较,若结节无明显变化,注明病灶稳定时间;若结节有变化,则注明目前结节数量、大小、密度等与基线特征[1,2,3,4,5,6]。
应用物联网医学三加二式肺结节鉴别诊断法发现以下参数发生变化时,需给予及时处理[7]:(1)基线直径≤15 mm的结节,与基线相比直径增大2 mm;(2)基线直径>15 mm的结节,与基线相比直径增大15%以上;(3)原pGGN密度增加或其中出现实性成分,或原mGGN中实性成分增多;(4)新出现的肺部结节;(5)发现气管、支气管壁增厚、管腔狭窄,或管腔内结节者。肺结节患者参数发生上述变化时,可考虑行气管镜检查(含EBUS-TBLB、VBN及EBN等)或胸腔镜微创手术。
3.协助管理:与常规管理比较,物联网技术辅助评估与管理具有以下优势:(1)深度挖掘,精细计算密度体积、详细评估周边和浸润、探查结节内部结构、评估血管及其生长状态;(2)自动精确的科学随访功能:对同一患者,自动匹配不同时间序列,自动配对相同部位病灶;(3)自动计算体积倍增时间。
应根据本共识对肺结节患者进行恶性肿瘤的概率估计,评估各种替代管理的相关风险,并征求患者的意愿进行评估和管理。与我国肺癌防治联盟签约成立中国肺癌防治联盟肺结节(早期肺癌)诊治分中心,按照联盟计划筛查管理,并且端口开放进行质控,此外,需明确分级诊疗的责任制:(1)基层医院:肺结节
八、小结
鉴于我国的高肺癌发病率和死亡率,端口前移,合理管理肺结节,及时诊断早期肺癌患者可产生显著的社会和经济效益。如要既适合中国的分级诊疗模式,又同时安全有效地诊断和鉴别诊断肺结节,需要制定严谨科学的专家共识,并广泛推广和进行精准管理。为达到这一目标,我们广泛听取多学科专家的意见和参考"肺结节评估:亚洲临床实践指南"以及其他学科共识或指南,修改更新原共识。在本共识中较全面阐述了肺结节定义、分类、评估方法、诊断要点、孤立性和非孤立性肺结节评估与处理原则,以及物联网技术辅助评估与管理技术,其中对肺结节分类是一个新的尝试,根据结节直径将其分为肺结节、小结节和微小结节是为便于指导临床工作,对肺结节患者进行精准管理。物联网技术辅助评估与管理技术为达到这一目的创立了新平台,有利于广泛筛查无症状的肺结节患者,对早期肺癌及时进行同质化的精准诊断与科学有效的管理,也有利于联合云中专家进行多学科会诊和随访跟踪。今后,需要进一步研究切实可行的实性和亚实性结节的非病理诊断替代方法,用于肺结节的良恶性评估,肺癌的早期诊断,进而产生相应的社会和经济效益。本共识也有其局限性,特别是基于肺结节直径的随访时间,由于在实性结节与亚实性结节之间的不同,为临床应用增加了复杂性,这有待于以后证据的积累和研究的深入,逐渐研发出简明的便于临床应用的随访方法。
专家组成员
执笔人(排名不分先后):张晓菊,白莉,金发光,洪群英,胡洁,白春学,陈良安,李为民
专家组成员(排名不分先后):白春学、洪群英、胡洁、葛棣、卢韶华(复旦大学附属中山医院上海呼吸疾病研究所);白莉(第三军医大学附属新桥医院);陈良安(解放军总医院);段国辰(河北省人民医院);樊绮诗(上海交通大学附属瑞金医院);费广鹤(安徽医科大学第一附属医院);郭述良(重庆医科大学第一附属医院);胡成平(中南大学湘雅医院);黄建安(苏州大学附属第一医院);黄云超(云南省肿瘤医院);金发光(第四军医大学第二附属医院);李圣青(复旦大学附属华山医院);李时悦、周承志(广州呼吸健康研究院);李为民(四川大学附属华西医院);林其昌(福建医科大学第一附属医院);刘伟、孙增涛、张硕(天津中医药大学第二附属医院);卢韶华(复旦大学附属中山医院);明树红(卫生部北京医院);施敏骅(苏州大学第二附属医院);宋勇(南京军区南京总医院);唐华平(山东青岛市立医院);王静(郑州大学第一附属医院);王凯(浙江大学医学院附属第二医院);王琪(大连医科大学第二附属医院);王晓萍(山东胸科医院);吴晓梅(哈尔滨医科大学第二医院);肖湘生(第二军医大学附属长征医院);徐兴祥(苏北人民医院);于化鹏(南方医科大学附属珠江医院);曾奕明(福建医科大学第二附属医院);张国祯(复旦大学附属华东医院);张捷(吉林大学白求恩第二医院);张艰(第四军医大学第一附属医院);张晓菊(河南省人民医院);赵培革(山东省聊城市人民医院);赵苏(武汉市中心医院);周彩存(同济大学附属肺科医院);周建英(浙江医科大学附属第一医院);周向东(第三军医大学附属西南医院);朱晓莉(东南大学附属中大医院)
参考文献(略)


















共0条评论