作者:2017年中国胃肠道间质瘤病理共识意见专家组
执笔人:王坚,朱雄增,郑杰,陈杰,刘艳辉
来源:中华病理学杂志2018年1月第47卷第1期
由中国临床肿瘤学会(CSCO)胃肠道间质瘤(gastrointestinal stromal tumor,GIST)专家委员会组织临床、病理和影像学专家在"中国GIST诊断治疗专家共识(2013年版)"基础上编写的"中国GIST诊断治疗专家共识(2017年版)"已于近日发表于Chinese Journal of Cancer Research,本文就其中的病理部分进行解读,并介绍一些新进展,便于病理同行了解相关更新。
一、GIST的定义
GIST是胃肠道最常见的间叶源性肿瘤,在临床表现上可从良性至恶性,免疫组织化学检测通常表达CD117和DOG1,显示卡哈尔间质细胞(interstitialcellsofCajal,ICC)分化,大多数病例具有C-KIT或PDGFRA活化突变,少数病例涉及其他分子改变,包括SDHx、BRAF、NF1、K/N-RAS和PIK3CA等基因突变,以及产生ETV6-NTRK3、FGFR1-HOOK3和FGFR1-TACC1等融合基因。
二、对标本的要求
同2013年版。手术后的标本需要及时固定,标本离体后应在30min内固定,采用足够的3.7%中性缓冲甲醛液(至少3倍于标本体积)完全浸泡固定。对于直径≥2cm的肿瘤组织,必须每隔1cm予以切开,达到充分固定。固定时间应为12~48h,以保证后续的免疫组织化学和分子生物学检测的可行性和准确性。有条件的单位,应留取新鲜组织妥善冻存,以备日后基因检测之用。
三、GIST的病理诊断和辅助检测
1.基本诊断:同2013年版[1]。组织学上,依据瘤细胞的形态可将GIST分为3大类:梭形细胞型(70%)、上皮样细胞型(20%)和梭形细胞-上皮样细胞混合型(10%)。即使为同一亚型,GIST的形态在个例之间也可有很大的差异,包括瘤细胞密度、瘤细胞异型性、核分裂象计数和生长方式等。除经典形态外,GIST还可有一些特殊形态,包括少数病例内还可见多形性细胞,尤见于上皮样细胞型GIST,也可出现于梭形细胞型GIST中。间质可呈硬化性,可伴有钙化,特别是小GIST,偶可呈黏液样等。此外,发生于小肠的GIST内常可见到嗜伊红色的丝团样纤维小结(Skeinoidfiber),对诊断也有一定的提示性意义。
2.靶向治疗后的GIST:经靶向治疗以后,GIST可发生坏死和/或囊性变,部分病例中细胞密度明显降低,瘤细胞成分稀疏,间质伴有广泛胶原化,可伴有多少不等的炎性细胞浸润和组织细胞反应。目前临床上对甲磺酸伊马替尼靶向治疗的疗效评判主要根据影像学Choi标准。近年来,经靶向治疗后再经手术切除的GIST标本也逐渐增多,组织学评估疗效与GIST预后的相关性尚有待于更多病例的积累和研究。根据靶向治疗后所发生的坏死变性区域在肿瘤内所占的比例,推荐的组织学效应(pathologicalresponse)为:(1)轻微效应,0~10%;(2)低度效应,11%~50%;(3)中度效应,51%~90%;(4)高度效应,>90%。部分经靶向治疗的GIST可失表达CD117、发生横纹肌肉瘤分化或去分化等改变。
3.GIST的免疫组织化学:GIST的免疫组织化学检测推荐采用CD117、DOG1、CD34、琥珀酸脱氢酶(succinatedehydrogenase,SDH)B和Ki-67五个标志物,其中CD117和DOG1建议加用阳性对照。疑为SDHA突变或BRAF突变时,可酌情增加SDHA或BRAF标记。Ki-67临界值的设定与GIST危险度或预后的相关性尚有待进一步研究。
4.GIST的分子检测:十分重要,有助于一些疑难病例的诊断、指导临床治疗和预测分子靶向治疗药物的疗效。GIST的分子检测应该在符合资质的实验室进行,推荐采用聚合酶链反应(PCR)扩增-直接测序的方法,以确保检测结果的准确性和一致性。目前二代基因测序(NGS)与液体活检在GIST领域中报道较少,但有少数研究发现其可检测到少见突变类型,并可能提早发现继发基因突变,具有潜在的可应用性。专家委员会推荐存在以下情况时,应该进行分子检测:(1)对疑难病例应进行C-KIT或PDGFRA突变分析,以明确GIST的诊断;(2)术前拟用分子靶向治疗者;(3)所有初次诊断的复发和转移性GIST,拟行分子靶向治疗;(4)原发可切除GIST手术后,中-高度复发风险,拟行分子靶向治疗;(5)鉴别野生型GIST;(6)鉴别同时性和异时性多原发GIST;(7)继发性耐药需要重新检测。检测基因突变的位点,至少应包括C-KIT基因的第9、11、13和17号外显子以及PDGFRA基因的第12、14和18号外显子。对于继发耐药的患者,应增加检测C-KIT基因的第14和18号外显子。由于大多数GIST(65%~85%)的基因突变发生在C-KIT基因第11号外显子或第9号外显子,因此可以优先检测该两个外显子。原发C-KIT基因第11号外显子突变可表现为多种突变类型,其中缺失突变的生物学行为较点突变等非缺失突变更差,表现为自然预后差、甲磺酸伊马替尼治疗有效时间相对较短,其对甲磺酸伊马替尼耐药的后续酪氨酸激酶抑制剂治疗选择具有一定价值。因此,一份完整的GIST分子检测报告应阐明基因突变的具体类型。野生型GIST的发病率较低,多数单位尚不能开展相应的分子检测,可转至有条件的单位进行。
5.GIST的诊断思路和标准:从事GIST病理诊断的病理医师不仅要熟悉GIST的各种形态学表现,也要了解各种易被误诊为GIST的肿瘤。免疫组织化学检测强调联合使用CD117和DOG1标记:(1)对于组织学形态上符合GIST且CD117和DOG1弥漫(+)的病例,可以做出GIST的诊断;(2)形态上呈上皮样但CD117(-)、DOG1(+)或CD117弱(+)、DOG1(+)的病例,需要加做分子检测,以确定是否存在PDGFRA基因突变(特别是D842V突变)或C-KIT基因其他外显子突变;(3)CD117(+)、DOG1(-)的病例首先需要排除其他CD117(+)的肿瘤,必要时加做分子检测帮助鉴别诊断;(4)组织学形态和免疫组织化学标记均符合GIST但分子检测显示无C-KIT或PDFRA基因突变的病例,需考虑是否有野生型GIST的可能性,应加做SDHB标记,表达缺失者要考虑SDHB缺陷型GIST,表达无缺失者要考虑其他野生型GIST的可能性,有条件者加做相应免疫组织化学(如BRAF)和分子检测;(5)CD117(-)、DOG1(-)的病例大多为非GIST,在排除其他类型肿瘤后仍然要考虑GIST时,需加做分子检测,如有C-KIT或PDGFRA基因突变,则符合GIST,但有一个病种例外,即胃肠道炎性纤维性息肉,瘤细胞不表达CD117和DOG1但表达CD34和PDGFRA,分子检测可有PDGFRA基因第12和18号外显子突变。
四、野生型GIST
野生型GIST(GISTWT)特指病理诊断符合GIST但分子检测无C-KIT/PDGFRA基因突变者。约85%的儿童GIST和10%~15%的成人GIST为野生型GIST。根据是否有SDHB表达缺失大致可分为两大类。(1)SDH缺陷型GIST:包括SDHA突变型、散发性GIST、Carney三联征相关性和Carney-Stratakis综合征相关性GIST;(2)非SDH缺陷型GIST,包括BRAF突变、NF1相关性、K/N-RAS突变和四重野生型(quadrupleGISTWT,包括PIK3CA突变、ETV6-NTRK3、FGFR1-HOOK3和FGFR1-TACC1等融合基因)等,参见图1。
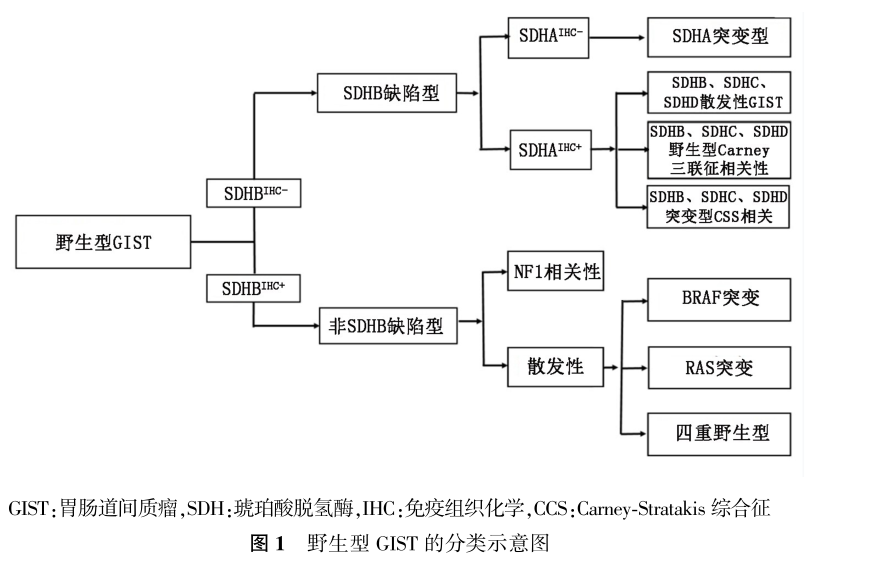
1.SDH缺陷型GIST:约占野生型GIST的半数,包括:(1)无综合征相关的SDH缺陷性GIST:发生于儿童和青年人,女性多见。肿瘤发生于胃,镜下常呈多结节性或呈丛状生长方式,瘤细胞呈上皮样,也可为混合型,约50%的病例于淋巴管内可见瘤栓,10%左右的病例于区域淋巴结内可见瘤转移,免疫组织化学标记显示瘤细胞可表达CD117和DOG1,但SDHB表达缺失。分子检测显示约半数病例SDH亚单位(SDHA、SDHB、SDHC或SDHD)功能丧失性胚系突变,其中约30%为SDHA突变(多为胚系突变),免疫组织化学SDHA失表达,20%为SDHB、SDHC或SDHD突变。另半数病例SDHC促进子高甲基化和SDH复合体表观基因沉默,常过表达胰岛素样生长因子受体1R(IGF1R);
(2)Carney三联征相关性GIST(Carneytriad):无家族性,可伴发肺软骨瘤(常为多灶性)和肾上腺外副神经节瘤,仅22%的病例同时合并三种肿瘤,53%同时有GIST和肺软骨瘤,24%同时有GIST和副神经节瘤。其他可伴发的肿瘤包括嗜铬细胞瘤、肾上腺腺瘤和食管平滑肌瘤。由SDHC甲基化所致,标记SDHB为阴性,标记SDHA为阳性;(3)Carney-Stratakis综合征相关性GIST:是一种遗传学疾病,为常染色体显性遗传,不全外显。由SDHB(10%)、SDHC(80%)和SDHD(10%)的胚系失活性突变所致,突变导致蛋白表达丢失,标记SDHB为阴性。
2.BRAF突变型GIST:占野生型GIST的3%~7%,好发于小肠(56%),其次为胃(22%)。组织形态上多为梭形细胞型,免疫组织化学标记仍显示CD117(+)、DOG1(+)。分子检测显示BRAF基因第15号外显子(p.V600E)突变。少数情况下为甲磺酸伊马替尼耐药性二次突变。BRAF免疫组织化学抗体VE1可帮助识别BRAF突变型GIST。
3.NF1相关性GIST:GIST在NF1患者中的发生率为7%。NF1相关性GIST的患者年龄相对较轻,肿瘤多发生于空肠和回肠,常为多结节性,常伴有ICC的增生。分子检测显示NF1功能丢失性胚系突变,但无热点突变,可为插入/缺失或框内移位突变、错义突变。
4.K/N-RAS突变型GIST:原发耐药GIST或KIT/PDGFRA突变型GIST可发生RAS突变。
5.四重野生型GIST:无KIT/PDGFRA/SDHx/NAS-P(KRAS,BRAF,NF1)信号通路异常,包括PIK3CA突变、ETV6-NTRK3、FGFR1-HOOK3和FGFR1-TACC1融合基因等,以及FGFR1突变、NF1综合征以外的NF1突变和MYC相关因子X(MAX)突变等。
五、小GIST和微小GIST
直径≤2cm的GIST统称为小GIST,直径≤1cm的GIST定义为微小GIST(microGIST),其中的大多数病例为偶然发现,尤其是在内镜检查或因消化道肿瘤手术时。尽管大多数小GIST或微小GIST病例在临床上呈良性或惰性经过,但确有极少数病例显示侵袭性行为,尤其是核分裂象计数>5/50HPF或>10/50HPF者。
六、原发完全切除GIST的危险度评估
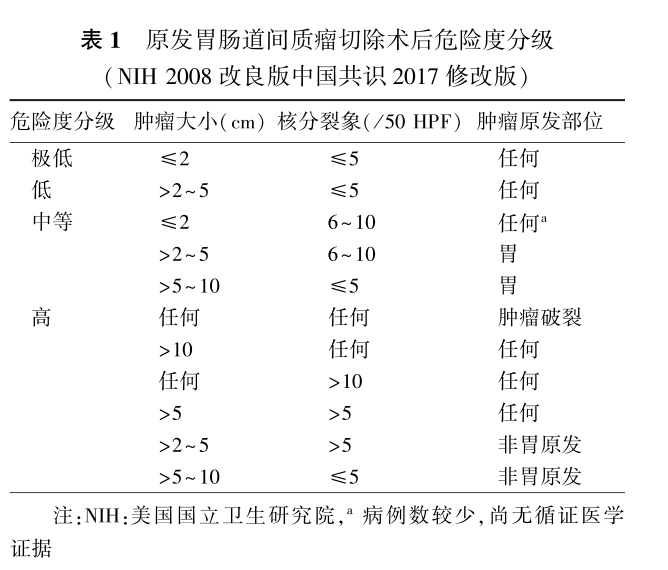
GIST的危险度评估适用于原发完全切除的GIST,目前仍根据肿瘤大小、核分裂象计数(50HPF)、肿瘤原发部位和肿瘤是否破裂4种参数进行评估。以下几种情形不做危险度评估:(1)各类活检标本,包括细针穿刺活检、芯针穿刺活检和内镜活检等;(2)已发生复发和/或转移的GIST;(3)经过靶向治疗的GIST;(4)SDH缺陷型GIST。与普通型GIST有所不同,危险度评估不适用于SDH缺陷型GIST。
原发可切除GIST术后复发风险评估系统包括美国国立卫生研究院(NIH,2008改良版)、WHO(2013年版)、美国武装部队病理研究所(AFIP)、美国国家综合癌症网络(NCCN)指南(2016年第2版)、热像图和列线图(诺模图,Nomogram)。鉴于便捷性与操作简单性,CSCO胃肠间质瘤专家委员会推荐沿用NIH2008改良版[2],可能更适合亚洲人种。在2013年版中国共识对NIH2008版中的错误进行修订的基础上,2017年版中国共识将NIH2008分级中的中危标准“直径<5cm,核分裂象(6~10)/50HPF,任意部位”建议进一步修改为“直径≤2cm,核分裂象(6~10)/50HPF,任何”,如此可基本涵盖全部GIST病例,参见表1,但这部分病例数较少,尚缺乏循证医学证据。
需要指出的是,没有一种评估系统是完美无缺的,各单位可结合本单位具体情况。其中肿瘤破裂包括自发性和医源性,后者可包括剖腹手术和腹腔镜手术时造成,内镜下切除即便肿瘤发生破裂,也多局限于消化道腔内,如消化道壁无穿破现象,则相比腹腔内播散影响较小。肿瘤自发性破裂根据术中所见可做出判断,判断是否为医源性破裂则较为困难。关于核分裂象计数,现有评估系统均采用50HPF,美国病理医师学院和WHO最初定义50HPF相当于5mm²,各单位使用的显微镜目镜有所不同,可做相应换算,比如目镜为22mm时,5mm²相当于21个HPF,10mm²则相当于42个HPF。此外,对GIST的危险度评估临床和病理可有不一致的情形,从事GIST靶向治疗的临床医师应综合临床、影像和病理等各方面的资料进行分析和研判。
七、规范GIST病理诊断报告
病理报告应该规范化,必须准确地注明肿瘤原发部位、肿瘤大小、核分裂象计数(50HPF)和肿瘤破裂等情况。一些临床病理形态指标(如血管浸润、神经浸润、脂肪浸润、黏膜浸润、肿瘤性坏死、异型性、肌层浸润、围绕血管呈项圈样等)可反映在GIST病理报告中,这些形态学指标对判断GIST的生物学行为可能有一定的价值。病理报告中应附有免疫组织化学标记结果,分子检测结果可另附。
GIST病理报告推荐格式请见附件。

中国胃肠道间质瘤病理共识意见专家组成员(按单位名称汉语拼音字母顺序排列):
安徽省立医院病理科(李传应),北京大学第一医院病理科(柳萍),北京大学医学部基础医学院病理学系北京大学第三医院病理科(石雪迎、郑杰),北京大学肿瘤医院病理科(李向红、孙利),东北国际医院病理科(李奕),福建医科大学附属第一医院病理科(王密、张声),复旦大学附属中山医院病理科(侯英勇、罗荣奎),复旦大学附属肿瘤医院病理科(王坚、喻林、朱雄增),广东省医学科学院广东省人民医院病理科(刘超、刘艳辉),海军军医大学附属上海长海医院病理科(白辰光),湖北省肿瘤医院病理科(邓云特),解放军南京总医院病理科(夏秋媛、周晓军),空军军医大学西京医院病理科(李增山),辽宁省肿瘤医院病理科(黄波),南京医科大学第一附属医院病理科(贡其星),四川大学华西医院病理科(陈卉娇、张红英),天津医科大学附属肿瘤医院病理科(孙燕),浙江大学医学院附属第二医院病理科(陈丽荣),中国医学科学院北京协和医学院北京协和医院病理科(陈杰、周炜洵),中国医学科学院北京协和医学院肿瘤医院病理科(石素胜),中山大学附属第一医院病理科(黄勇杰、舒曼、薛玲),中山大学附属肿瘤医院病理科(凌逸虹、张惠忠)
参考文献:略
















共0条评论