作者:周志华 无锡101医院病理科
临床信息:患者,男,64岁,因“腹痛1月,发现AFP、CEA升高半月”入院。血清肿瘤指标:AFP 45.6ug/L,CEA 26.4 ug/L,余正常。
胃镜:胃窦部小弯侧见大小0.8cm的不规则溃疡,上覆白苔,周围粘膜充血(图1a)。取活检组织3块。胃镜病理:胃窦高级别上皮内瘤,疑有浸润性癌(图1b)。
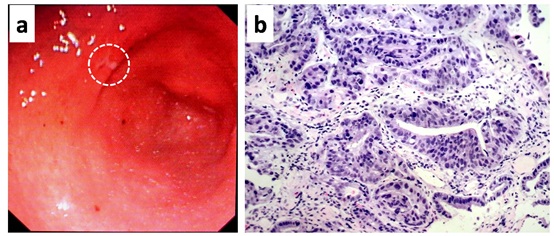
图1. a.胃镜检查,胃窦部见一形状不规则的溃疡(白色圆圈)。b.胃粘膜活检,见增生的腺体,形态不规则,上皮异型性显著,胞核色深,胞质淡粉染或空泡样。
患者入院后完善各项检查,经综合评估后,进行胃癌根治术。
大体所见:大部胃切除标本,大弯长15cm,小弯6.5cm,胃窦部小弯侧黏膜局部粗糙,范围约1.5*1.5cm,中央可见直径约0.8cm的糜烂区。另送胃周各组淋巴结(第1~第8组淋巴结以及第15组淋巴结)共28枚。对胃病变区域充分取材,共7个蜡块。
组织学所见:1.胃原发灶:见增生的不规则腺体,呈管状、囊腺样,也可形成乳头状结构,无实性区域;上皮细胞为柱状或立方状,异型性显著,胞质透明或呈空泡样;此外,部分区域癌性腺体与普通的腺癌类似,癌细胞无透明的胞质。癌组织侵及黏膜下层的中间层,最大深度约1mm。以上见图2,a-c. 2.胃周淋巴结:17枚淋巴结查见癌转移(17/28),癌细胞形态与原发灶相似,异型性亦十分显著,并见透明或空泡样的胞质,部分细胞为嗜酸性胞质,形成类似于肝样腺癌的区域;不同于原发灶,转移灶中的癌细胞以实性结构为主,而腺管及乳头状结构较少(图2d)。
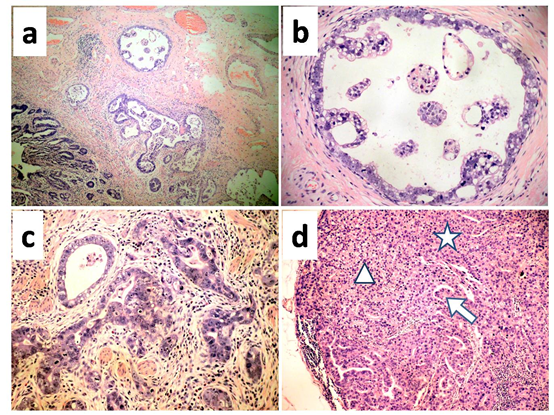
图2.原发灶及转移灶的组织形态学特点。a. 原发灶见异型增生的囊腺样或腺管样结构,侵及黏膜下层的中间层。b. 示图a中的一处囊腺样结构,囊腔中可见乳头样结构,癌细胞为立方状或柱状,胞质透明或空泡样,以上形态类似于胚胎性的肠上皮。c.原发灶中还可见管状腺癌,癌细胞异型性显著,部分仍有透明的胞质,部分无透明的胞质,类似于普通的腺癌。d.淋巴结转移灶,癌细胞少数形成乳头或腺管样结构(箭头),大部分形成实性结构,而实性结构中,部分癌细胞仍有透明的胞质(三角形),部分癌细胞具有嗜酸性的胞质(星形),具有肝样腺癌的的特点。
免疫组化染色:1.原发灶:SALL4(弥漫+),GPC3(局灶+), AFP(-),CDX2(弥漫+),CD10(局灶+),HER2(+++), HepPar-1(-). 2.转移灶:免疫表型与原发灶类似,但AFP为强阳性,而HER2为弥漫均一的强阳性(+++)。以上结果见图3和图4.
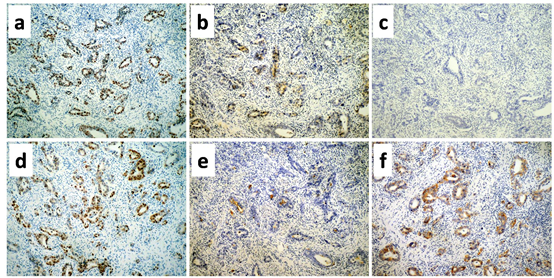
图3.胃原发灶免疫标记结果。a.癌细胞表达SALL4,定位于胞核,呈弥漫阳性。b.少数癌细胞表达GPC3,为局灶阳性,定位于胞质。c.癌细胞AFP表达呈阴性。d.癌细胞表达肠型分化的标记物CDX2,为弥漫阳性,定位于胞核。e.少数癌性腺体表达CD10, 定位于胞膜(腺腔腔缘)f.部分区域(约30%)见癌细胞表达HER2,呈强阳性(+++),定位于胞膜。
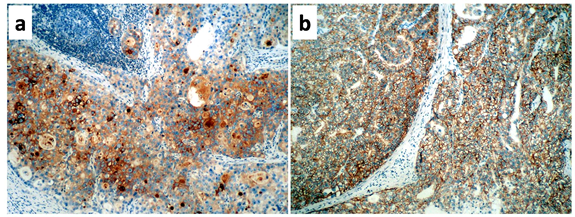
图4.淋巴结转移灶部分免疫标记结果。a.大部分癌细胞表达AFP,以实性区域最为明显。 b.癌细胞表达HER2,呈弥漫均一的强阳性,强阳性范围>90%。
FISH检测(HER2基因):原发灶癌细胞HER2/CEP17比值为2.39,大于2.0,证实存在HER2基因扩增。
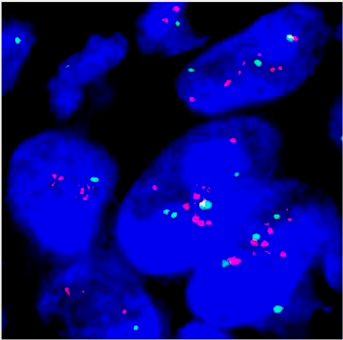
图5.原发灶癌组织行FISH检测,HER2信号红色,CEP17染色体信号为绿色,计数30个细胞,HER2/CEP17比值为2.39,大于2.0,提示存在HER2基因扩增。
讨论
伴有肠母细胞分化的胃腺癌(gastric adenocarcinoma with enteroblastic differentiation,GAED),是一类具有原始肠上皮结构和分化表型的腺癌,癌细胞具有透明的胞质,是GAED显著的形态学特征。此类胃癌极易侵犯血管或淋巴管,肝转移十分多见,患者常有血清AFP升高,预后极差。典型的GEAD由于癌细胞形成管状或乳头状结构,诊断时易忽略其原始肠上皮分化的特点,而将其误认为普通类型的高分化或中分化腺癌,低估其恶性程度。
GAED的发病率较低,既往文献以个案报道为主。新近Yamazawa等人对一组386例胃腺癌的研究发现,其中仅13例表现出胚胎性肠上皮分化的特点,约占所有胃癌的3.4%。2010版WHO的消化系统肿瘤分类所列出的有关胃癌少见的组织学亚型中,未将GAED纳入,但在描述胃肝样腺癌时提到,具有产生AFP特性的胃癌除肝样腺癌以外,还包括“伴有透明胞浆的高分化乳头状、管状腺癌”。
GAED典型的组织学特点为:癌细胞呈管状或乳头状排列,组织学上类似于普通的胃腺癌;而在细胞学上,癌细胞与肠母细胞相似,具有特征性的透明胞质,因此也被称为胃透明细胞癌,这是GAED的重要特征,富含糖原(而非黏液)是导致胞质透明的原因。在免疫表型方面,癌细胞表达多种癌胚蛋白(oncofetal proteins),如AFP, GPC3,SALL4,CLDN6,其中SALL4的表达具有特征性,同时由于GAED具有肠上皮分化的特点,因此还表达CDX2和CD10.
本病例根据其临床表现(血清AFP升高)、组织形态学特征及免疫组化结果,可明确诊断为GAED. 本病例具有如下特点:
1. 肿瘤病灶较小(1.5cm),侵犯深度较浅(侵及粘膜下层的中层,深度约1 mm),属于早期胃癌。然而,本病例同时出现了广泛的淋巴结转移(17/28),说明GAED具有极强的侵袭转移能力。
2.免疫组化提示本病例癌细胞HER2强阳性(+++),FISH证实存在HER2基因的扩增。一般HER2基因扩增见于10%左右的胃腺癌病例,而新近对GAED的研究发现,HER2表达强阳性或出现HER2基因扩增的比率明显更高,可达37%以上。另外,本病例原发灶中约30%的癌细胞呈HER2强阳性,而在淋巴结转移灶,HER2在癌细胞的表达则为弥漫一致的强阳性,强阳性的细胞占90%以上,提示转移过程中可能对HER2基因扩增的癌细胞进行了克隆筛选。
3.原发灶具有典型的GAED的特征,癌细胞多呈腺管或囊腺样排列,无实性结构,而淋巴结转移灶则出现明显的实性区域,且具有肝样腺癌的特征。这一特点与以往文献的报道相一致:日本学者发现,GAED在胃粘膜层的病灶可表现出典型的胚胎性肠母细胞分化的特点,但随着肿瘤的进展,在肿瘤深部的侵袭灶内可出现明显的肝样腺癌区域,癌细胞呈实性巢片样排列,并表达AFP。这一现象说明,随着肿瘤的进展GAED可向肝样腺癌转化,这提示GAED与肝样腺癌可能属于同一实体。新近的研究也发现,胃肝样腺癌与GAED具有相似的临床病理特征和免疫表型,且同样具有较高的TP53突变率(50%以上),因此认为肝样腺癌可能是一种实性的GAED亚型。
GAED的病理诊断主要依据组织形态学表现和免疫组化特征,但目前尚缺乏统一的标准或共识。典型的伴有肠母细胞分化的组织形态应是诊断GAED的重要条件,此外,部分病例可见肝样腺癌区域或卵黄囊样分化的特征,亦可见到普通的腺癌成分。免疫组化诊断方面,可使用AFP, GPC3,SALL4这3个癌胚蛋白的抗体进行标记,GAED至少表达这3个标记之一。其中,GPC3诊断GAED的敏感性最高(77%),而SALL4的特异性最高,可达100%,其表达多呈弥漫阳性;AFP的敏感性仅有11%-45%,因此癌细胞表达AFP并非诊断GAED的必要条件,血清AFP升高也仅出现于部分GAED患者。除表达癌胚蛋白外,GAED还表达CDX2和CD10,具有明确的肠上皮分化的表型,所以CDX2和CD10也是诊断GAED的重要的免疫组化指标。
在鉴别诊断方面,由于GEAD常有肝转移导致肝肿块以及血清AFP升高,同时GAED组织中可出现肝样腺癌的成分,其组织形态酷似肝细胞癌,并可表达AFP和GPC3,因此GAED必须与肝细胞癌的胃转移灶进行鉴别,虽然这一情况较罕见。免疫组化在鉴别GAED与胃转移性肝细胞癌时具有重要作用:尽管GAED可表达肝细胞癌标记AFP和GPC3,但不表达HepPar-1,同时SALL4多为弥漫强阳性,而在肝细胞癌SALL4为阴性;此外,GAED表达肠分化标记物,如CDX2,CD10,而在肝细胞癌上述标记为阴性,因此肠上皮分化的标记物也可用于鉴别诊断。
需与GAED鉴别的另一种情况是胃的转移性肾透明细胞癌,因为GAED的具有明显的透明胞质,同时癌细胞可表达CD10,因此与肾透明细胞癌有一定的相似性。同样,免疫组化染色标记CD10以外的肠型分化标记物和前述的三个癌胚蛋白,可用来鉴别诊断。
由于GAED形成管状、乳头状或囊腺样结构,组织学上类似于普通的胃腺癌,可被误认为是高分化或中分化腺癌。GAED显著的细胞学特点(透明的胞质)以及特殊的免疫表型(表达多种癌胚蛋白,尤其是SALL4)有助于将其从普通腺癌中区分出来。我们应充分认识GAED的形态及免疫表型,避免将GAED和普通腺癌混淆起来而低估其高度恶性的生物学行为。
GAED易侵犯血管,肝转移发生率高,故患者预后极差。一项研究随访了28例GAED患者(随访时间:2-39个月),在第30个月时已有15例患者死于肿瘤,中位生存期仅为29个月。治疗方面,手术和化疗仍是主要手段。鉴于GAED患者发生HER2基因扩增的几率较高,对检测阳性的患者采用HER2抗体治疗有望延长此类患者的生存期。
参考文献
1.Yamazawa S, Ushiku T, Shinozaki-Ushiku A, et al. Gastric cancer with primitive enterocyte phenotype: an Aggressive subgroup of intestinal-type adenocarcinoma. Am J Surg Pathol. 2017, 41(7):989-997.
2.Akazawa Y, Saito T, Hayashi T, et al. Next-generation sequencing analysis for gastric adenocarcinoma with enteroblastic differentiation: emphasis on the relationship with hepatoid adenocarcinoma. Hum Pathol. 2018 May 8. doi: 10.1016/j.humpath.2018.04.022. [Epub ahead of print].
3.Fujimoto M, Matsuzaki I, Nishino M, et al. HER2 is frequently overexpressed in hepatoid adenocarcinoma and gastric carcinoma with enteroblastic differentiation: a comparison of 35 cases to 334 gastric carcinomas of other histological types. J Clin Pathol. 2018 Jan 5. doi: 10.1136/jclinpath-2017-204928. [Epub ahead of print].
4.Sun W, Liu Y, Shou D, et al. AFP (alpha fetoprotein): who are you in gastrology? Cancer Lett. 2015, 357(1):43-46.
5.Kinjo T, Taniguchi H, Kushima R, et al. Histologic and immunohistochemical analyses of α-fetoprotein--producing cancer of the stomach. Am J Surg Pathol. 2012, 36(1):56-65.
6.Ushiku T, Shinozaki A, Shibahara J, et al. SALL4 represents fetal gut differentiation of gastric cancer, and is diagnostically useful in distinguishing hepatoid gastric carcinoma from hepatocellular carcinoma. Am J Surg Pathol. 2010, 34(4):533-540.
7. Murakami T, Yao T, Mitomi H, et al. Clinicopathologic and immunohistochemical characteristics
of gastric adenocarcinoma with enteroblastic differentiation: a study of 29 cases. Gastric Cancer. 2016, 19(2):498-507.


















共0条评论