作者 孙瑞芳 等
来源:白血病·淋巴瘤
淋巴瘤是一组起源于淋巴细胞、主要发生于淋巴结及其他淋巴组织的血液系统恶性肿瘤,其种类繁多,且形态、生物学行为及临床病理特征等方面多具异质性,给病理及临床医生的正确诊断治疗造成了极大的困扰。因此更为精准的淋巴瘤分类及与预后相关的危险因素分层是迫切需要。
淋巴瘤分类历史演变
淋巴瘤分类从早期到2016年版WHO分类经历了一系列变化。1964年的Karl Lennert分类包括:淋巴结病、淋巴肉瘤、滤泡性淋巴瘤(FL)、网状细胞肉瘤、网状细胞增生症。1966年的Henry Rappaport分类包括:分化好的淋巴细胞性淋巴瘤、分化差的淋巴细胞性淋巴瘤、淋巴细胞组织细胞混合性淋巴瘤、组织细胞性淋巴瘤(网状细胞肉瘤)及恶性组织细胞增生症。Lennert和Rappaport分类都是建立在组织细胞/网状细胞经母细胞转化后再增生分化、淋巴细胞进行终末分化的理念之上的。
以下三方面的发现为现代淋巴瘤研究奠定了基础:淋巴细胞有转化为大的母细胞的能力(1962年至1966年);淋巴细胞分为B淋巴细胞和T淋巴细胞(1970年);B淋巴细胞和T淋巴细胞可以在分子水平被识别(1970年)。
Stein等1972年的研究结果第一次表明多数网状细胞肉瘤病例都产生IgM,也正是这些组织的IgM数据促成了KIEL分类(1973年至1975年)的产生。KIEL分类根据淋巴结活检组织中细胞形态和IgM浓度将恶性淋巴瘤分为低度恶性和高度恶性。其中低度恶性淋巴瘤又分为淋巴细胞性、淋巴浆细胞性(伴高组织IgM)、中心细胞性、中心母细胞-中心细胞性淋巴瘤;而高度恶性淋巴瘤又分为中心母细胞滤泡性、淋巴母细胞性、中心母细胞弥漫性(伴高组织IgM )、免疫母细胞性(伴高组织IgM)以及不能分类的恶性淋巴瘤。
从1966年的Rappaport分类到1974年的KIEL、Lukes/Collins、BNLI以及Dorfmann分类,再到1982年Rosenberg建立的临床应用工作体系和Nathwani工作体系标准,人们对淋巴瘤的认识逐渐提高,随后一些新的淋巴瘤类型逐渐被描述。例如, 1983年Isaacson和Wright首次描述了黏膜相关淋巴组织(MALT)淋巴瘤,1985年Stein首次描述了间变大细胞淋巴瘤。与此同时,可以应用在甲醛固定组织中的诊断性单克隆抗体的增多也对认识新的淋巴瘤种类起到了很大作用。
1990年,Isaacson和Stein联合19位欧美国家及中国香港病理学家在德国柏林创建了国际淋巴瘤研究组(ILSG),旨在通过形态及一切可获得的条件建立准确的生物学意义上的淋巴瘤分类。1993年、1994年修订的欧美淋巴瘤分类(REAL分类)公布,整合了浆细胞瘤、霍奇金淋巴瘤及髓系淋巴瘤并每五年更新一次。此举促成了2001年版WHO淋巴瘤分类的产生,后来又更新至2008年版。
随着时间推移及对淋巴瘤认识的提高,淋巴瘤分类逐步更新,2016年版WHO淋巴瘤分类更新将于2016年底至2017年初面世。其间,淋巴瘤分类的作者数从REAL分类时的19位上升到目前的90多位,而淋巴瘤章节的编辑数也从3位增加到6位。
2008年版WHO淋巴瘤分类
2008年版WHO淋巴瘤分类的主要原则是在REAL分类的基础上,综合细胞起源、形态学、免疫表型、遗传特征及临床特征,将恶性淋巴瘤分为前驱细胞淋巴瘤和成熟细胞淋巴瘤。成熟淋巴细胞淋巴瘤主要分为霍奇金淋巴瘤、B细胞非霍奇金淋巴瘤、T/NK细胞非霍奇金淋巴瘤。霍奇金淋巴瘤主要分为结节性淋巴细胞为主型和经典型。
2016年版WHO淋巴瘤分类主要更新及其应用
2016年版WHO淋巴瘤分类在2008年版的基础上增加了一些新类型并对某些种类作了更名(表1)。
表1 2016版世界卫生组织淋巴瘤分类
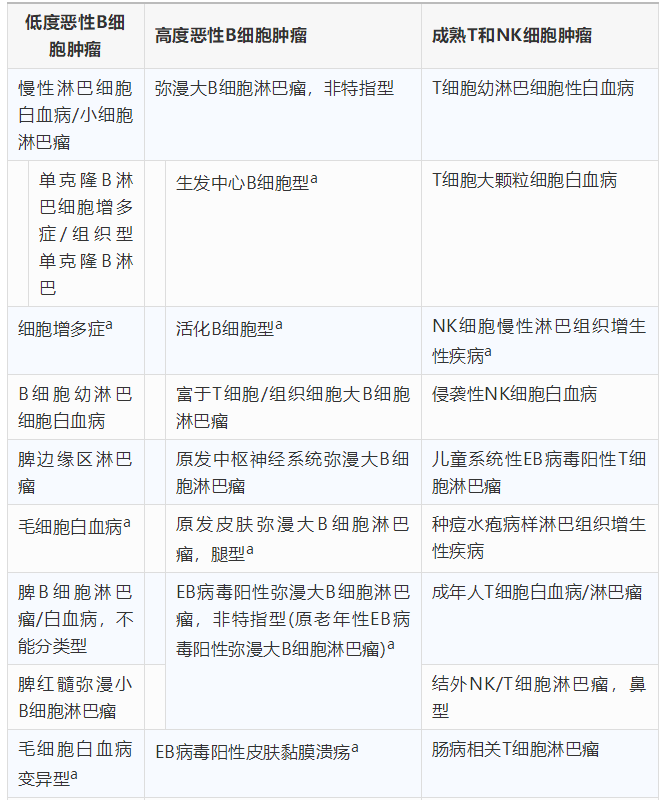
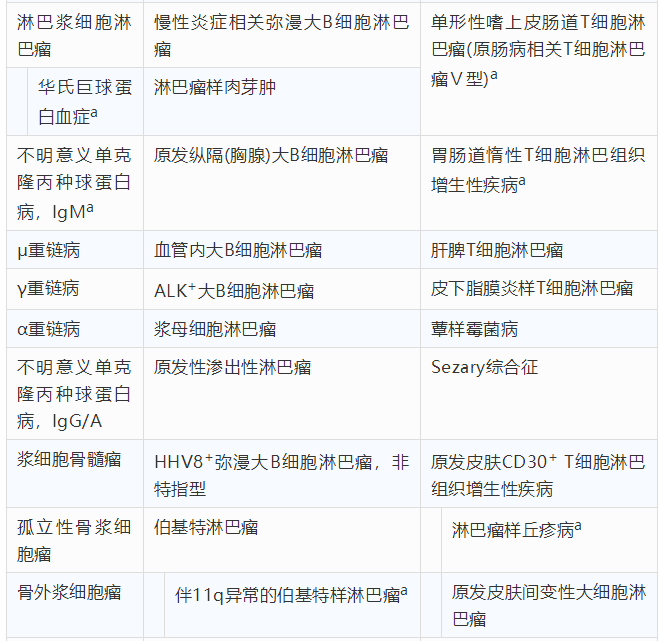
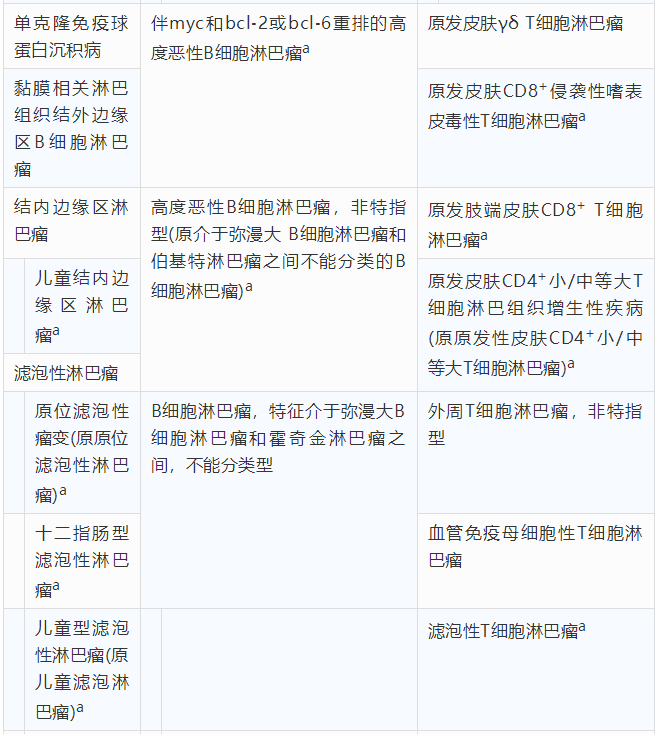

注:a为2008年版比较有更新部分
1、成熟B细胞肿瘤进展
1.慢性淋巴细胞白血病/小细胞淋巴瘤(CLL/SLL)
CLL/SLL虽然多以白血病形式出现,但诊断多依赖病理医生。ZAP70表达及不同位点染色体缺失都与CLL/SLL的预后有密切关系。扩大/融合和(或)高度活跃的增殖中心也是不良预后因素。异常p53核表达可以预测CLL/SLL中17p半合子丢失,且特异度达100%,灵敏度达93.3 %。
单克隆B细胞增多症(MBL)可以是CLL/SLL的早期事件,也具有CLL免疫表型,通常被界定为外周血淋巴细胞计数低于5×109/L。此类人群分为高计数(> 0.5×109/L)和低计数(<0.5×109/L )。高计数的MBL实际上会出现在12%的健康人群中,早于所有CLL/SLL。只有高计数的MBL人群需要定期或每年跟踪随访。淋巴结无增殖中心的SLL可能需要归类于组织型MBL。
2、毛细胞白血病(HCL)
HCL是一种惰性表现的成熟小B细胞恶性疾病,通常伴毛样突起弥漫性渗透进骨髓、脾脏红髓及外周血中,但一般不出现在脾脏白髓及淋巴结。其骨髓石蜡切片免疫表型一般为CD20+、CD103+、CD25+、cyclin D1+/-、T-bet+、CD23-、CD5-。2004年证实HCL病例表达Gas7。Gas7为维持神经突生长所必需,其异位表达可诱导广泛的细胞过程。同年研究证实HCL细胞缺乏CCR7和CXCR5,而这两者能够阻止毛细胞进入淋巴结和脾脏红髓,仅诱导毛细胞占据脾脏红髓。2011年,Falini小组证实BRAF V600E突变可以作为HCL特征性的遗传事件。该研究对47例HCL和193例其他外周B细胞肿瘤中BRAF外显子突变进行了分析,结果发现HCL的BRAF突变率达到了100 %,而其他为0。相关机制研究得出结论:pERK是RAF-MEK-ERK通路激活的标志物; BRAF阻滞剂可以通过对MEK和ERK去磷酸化从而阻断RAF-MEK-ERK通路;pERK免疫组织化学染色可作为预测BRAF阻滞剂治疗反应的标志物。 BRAF阻滞剂PLX-4720应用于HCL患者的临床试验显示出了良好的疗效。
3.淋巴浆细胞淋巴瘤(LPL)/华氏巨球蛋白血症(WM)
LPL是由小B淋巴细胞、浆细胞样淋巴细胞和浆细胞混合组成的肿瘤,它缺乏任何一种其他小B细胞淋巴瘤的诊断标准。WM被界定为骨髓受累并出现任何浓度单克隆丙种球蛋白的LPL。1944年由Jan Gosta Waldenstrom首次描述,其症状为口鼻出血、贫血、血小板减少、红细胞沉降率增快、血清黏稠度增加、血清中出现不典型巨球蛋白及骨髓中出现显著异常的淋巴细胞。
MYD88 L265P突变主要局限于WM和IgM型不明意义丙种球蛋白病,后者现在被认为是少见的WM变异型或独特类型。因此MYD88 L265P突变可以作为对LPL/WM诊断具有重要参考价值的标志物。另外,对MYD88及其下游靶标进行阻断能诱导杀死WM细胞,所以使用骨髓穿刺标本及外周血聚合酶链反应(PCR)检测MYD88可以用来预测治疗反应。对MYD88 L265P突变的认识使WM的诊治进入了一个新时代。
4.边缘区淋巴瘤(MZL)
需要与LPL鉴别的肿瘤是IgM浆细胞瘤和MZL。LPL与伴浆细胞分化的MZL若不能清楚地鉴别时,应诊断为伴浆细胞性分化的小细胞淋巴瘤。对结内及结外边缘区淋巴瘤的诊断应基于其形态标准及其缺乏其他B细胞非霍奇金淋巴瘤的特征性标志物。IRTA1和T-bet是MZL比较特异的标志物。其中IRTA1是Ig超家族受体易位相关蛋白1,其单克隆抗体(克隆MUM2)已由Falini团队研发。T-bet是Th1细胞特异性t-box转录因子,它可以作为HCL和MZL鉴别的良好标志物。结内边缘区淋巴瘤常伴广泛的滤泡植入,免疫表型为IRTA1+、T-bet+、CD10-、 bcl-6-。
2016年版WHO淋巴瘤分类新增儿童结内边缘区淋巴瘤,为暂定类型。
5.FL
原位FL更名为原位滤泡性瘤变,反映了其进展为淋巴瘤的低风险性。
十二指肠型FL不同于其他肠道淋巴瘤,常为局限性进展,播散风险低,预后较好。
儿童型FL由2008年版暂定类型儿童FL更名而来,主要发生于儿童及年轻人,极少发生于老年人,为一种预后较好的局部增生性疾病。该病罕见,形态学上表现为滤泡扩大但无弥漫性区域。
伴IRF4重排的大B细胞淋巴瘤为新增暂定类型,区别于儿童型FL和其他弥漫性大B细胞淋巴瘤。常见于儿童及年轻人,预后较好。该病与儿童型FL相似,但伴IRF4重排或IRF4/MUM1高表达,有弥漫性区域。
伴1p36缺失的弥漫性FL包括一些无bcl-2重排的弥漫性FL,表现为局部包块,累及腹股沟。
6.套细胞淋巴瘤(MCL)
MCL根据不同临床病理特征及分子病理遗传特征分为两种类型:一种为多发的伴无突变/少突变IGHV、常见SOX11表达及侵袭性行为的经典MCL;另一种为少见的MCL,伴IGHV突变、无SOX11表达,表现为惰性白血病的非结内MCL,常累及外周血、骨髓及脾。
原位MCL更名为原位套细胞瘤变,以反映其进展为淋巴瘤的低风险性。
7.弥漫大B细胞淋巴瘤(DLBCL)
DLBCL通过基因表达谱(GEP)根据细胞起源可以分为生发中心型与活化细胞型,此分型可能会影响治疗方案的选择。简便易行的免疫组织化学分型也可以用于对DLBCL分型并被推荐使用,但要标明所使用的分型方法。目前常用的分型方法有Hans分型、Choi分型及Visco/Young分型等。
myc与bcl-2共表达被认为是新的不良预后标志物(双表达DLBCL)。伴myc和bcl-2或bcl-6易位的高度恶性B细胞淋巴瘤被从DLBCL非特指型分出来,作为一种新的类型,也称为双重打击或三重打击淋巴瘤。所有双重打击或三重打击淋巴瘤都比FL或淋巴母细胞淋巴瘤更具不良预后。
高度恶性B细胞淋巴瘤非特指型取代2008年版分类中介于DLBCL与伯基特淋巴瘤之间不能分类的B细胞淋巴瘤。
EB病毒阳性(EBV+)DLBCL非特指型取代老年人EBV+ DLBCL,因其也可以发生在年轻人群中。
EBV+黏膜皮肤溃疡是新增类型,与治疗所致免疫抑制或年龄相关免疫衰老有关。
2、成熟T和NK细胞肿瘤进展
1.肠病相关T细胞淋巴瘤(EATL)
EATL是一类上皮内(IE)T细胞肿瘤,瘤细胞大且具多形性,与腹腔疾病相关,其免疫表型通常为CD3+、CD4-、CD8-、CD56-。2016年WHO淋巴瘤分类将以前的EATLⅠ型和Ⅱ型确定为两种不同类型的疾病。之前公认的Ⅰ型EATL通常与腹腔疾病有关。旧版的Ⅱ型EATL于1998年由Chott等描述,具有独特特征,不常见,与腹腔疾病无关或弱相关,肿瘤中包含具有多形性的小到中等大的IE-T细胞,其免疫表型为CD3+、CD4-、CD8+、CD56+。Ⅱ型EATL究竟是经典EATL的变异型还是一种独特类型淋巴瘤有过争论。Chan等提供了有力证据认为Ⅱ型ETAL是独立的疾病类型,该研究发现18例中国患者均为CD3+、CD4-、CD8+、CD56+、TIA+,78%病例存在γδ T细胞受体(TCR),33%为αβ TCR。患者均有较罕见、无或轻度绒毛萎缩,无营养不良史,出现小肠穿孔,表现为侵袭性的临床过程(通常1年内死亡),所有病例均曾按ETALⅡ型对待。研究结论为ETALⅡ型是单独的一种疾病类型,现更名为单形性嗜上皮性肠道T细胞淋巴瘤(MEITL)。
2.原发皮肤γδT细胞淋巴瘤
除外其他发生于皮肤且可能起源于γδ T细胞的淋巴瘤或淋巴增生性异常如蕈样霉菌病或淋巴瘤样丘疹病非常重要。
3.原发肢端皮肤CD8+ T细胞淋巴瘤
这是一类新的暂定类型,最初由Petrella等描述,发生于耳部,也可发生于鼻和四肢远端皮肤,为CD8+的淋巴组织增生性病变,呈惰性经过。免疫表型通常为CD3+、CD4-、CD8+、CD56-、EBV-、Ki-67+。
4.原发皮肤CD4+小到中等大小T细胞淋巴组织增生性疾病
该病由于预后较好且为局限性疾病以及对克隆性药物反应相似,由原淋巴瘤更名为增生性疾病,仍为暂定类型。免疫表型通常为CD4+、CD8-、CD56-、 PD1+、CXCL13+。
5.伴滤泡辅助性T细胞表型(TFH)的结内T细胞淋巴瘤
以TFH表型为特征的一系列结内淋巴瘤,包括血管免疫母T细胞淋巴瘤、滤泡T细胞淋巴瘤及其他伴TFH表型的淋巴结外周T细胞淋巴瘤,因它们临床病理特征之间的差异,诊断需特异。
6.ALK-间变性大细胞淋巴瘤
该病由暂定类型变更为独立类型,包括一些有预后意义的细胞遗传亚型(如涉及IRF4/DUSP22位点6p25的重排)。ALK-间变性大细胞淋巴瘤比ALK+间变性大细胞淋巴瘤预后要差,但伴IRF4/DUSP22重排的ALK-患者预后却相对要好。
7.乳腺假体植入相关间变性大细胞淋巴瘤
该病是一种发生于乳腺假体植入后0.9 % NaCl溶液或硅胶周围形成纤维包膜内的淋巴瘤,形态上类似于ALK-间变性大细胞淋巴瘤,但通常预后良好,无侵袭性,区别于其他ALK-间变性大细胞淋巴瘤,为暂定类型。免疫表型通常CD30+、ALK-。
结语
2016年版WHO淋巴瘤分类旨在提供最新的淋巴瘤诊断类型、更为准确的诊断标准以及生物学与临床的相关性,从而促进淋巴瘤治疗的进展,并推动淋巴瘤领域的基础研究。
本文来源:白血病·淋巴瘤

















共0条评论