来源:现代泌尿外科杂志
作者:陈铌,周桥(四川大学华西医院病理科)
前列腺导管内癌(intraductal carcinoma of the prostate,IDC-P)是一类具有独特病理特征和重要临床意义的病变。病理医师对IDC-P的认识经历了较长的发展过程,但目前尚有一些医师对该病变不甚了解。本文回顾IDC-P的研究历史、诊断标准、鉴别诊断、分子改变及其临床意义,并提出在穿刺活检标本中报告IDC-P的推荐模式。
1.IDC-P的研究历史
虽然早在20世纪70年代已提出前列腺导管内癌概念,直到80年代才有较为详细的研究。IDC-P这一术语最早用于描述一定数量的癌细胞(不仅包括前列腺腺癌,其它的癌也包括在内,如尿路上皮癌和鳞状细胞癌)浸润到前列腺导管和腺泡[1-2]。KOVI [3]对对前列腺癌病例进行研究,提出这种病变是前列腺癌的导管内播散;对139例前列腺癌标本仔细检查后,发现48%的病例出现导管内播散。该研究提示,前列腺癌细胞可浸润到临近的良性导管,取代其正常上皮成分,而不破坏受累导管的结构(与乳腺癌的导管内播散相似)。但是后来,“高级别前列腺上皮内瘤变(high-grade prostaticintraepithelial neoplasia,HGPIN)的概念提出后,一些作者将许多导管内的病变均纳入HGPIN的范畴[4],甚至包括了IDC-P。1996年,MCNEAL等[5]的重要研究提醒病理学家重新审视IDC-P的意义。该研究仔细分析了476例根治性前列腺癌标本,证实IDC-P与肿瘤的体积成正相关,且是患者预后的独立预后因素。其后,WILCOX等[6]的研究进一步证实IDC-P与HGPIN存在明显差别。该研究分析了252 例前列腺癌根治标本,发现IDC-P 常与Gleason评分高的浸润性癌共存,且与肿瘤体积、精囊腺侵犯、疾病进展成正相关。这些研究及后续报道使病理学家认识到IDC-P是迥异于高级别上皮内瘤变的一种病变,其特点为前列腺腺癌细胞在导管内生长但不破坏基底层,具有实体状或实性筛状结构,或疏松筛状或微乳头状结构伴显著核异型性或粉刺状坏死[5,7-8]。图1示1例典型的IDC-P组织形态。
2.IDC-P的组织学特点
2.1 IDC-P的病理诊断标准 MCNEAL 和YEMOTO等[5]于1996年提出了最早的IDC-P诊断标准,强调前列腺腺泡/导管中呈小梁状、致密筛状或实体状生长的前列腺癌细胞。
2006年GUO和 EPSTEIN[7]提出IDC-P的特点是在具有基底细胞的导管内,出现实体或致密筛状结构,或疏松筛状或微乳头状结构伴明显的核异型性(至少达正常前列腺上皮细胞核的6倍,或伴有粉刺状坏死)。该项研究将IDC-P分为四种形态亚型:实体状、致密筛状、疏松筛状和微乳头状。不同的亚型预后不同。
2007年COHEN 等[8]提出诊断IDC-P的5个主要标准和3个次要标准。主要标准为:①导管直径为正常的2倍以上;②基底细胞存在(可通过基底细胞标志物予以识别);③具有明显恶性特征的肿瘤细胞;④肿瘤细胞在导管腔内生长、播散;⑤粉刺状坏死。前4条改变几乎总是存在,但粉刺状坏死仅见于部分病例。次要标准包括:①腺体分支,常呈直角状;②导管有平滑的、圆形的轮廓;③常见两群细胞,位于外层的高柱状细胞,有多形性,核分裂多,PSA染色弱;位于中央的立方形细胞,形态较单一,核分裂不活跃,PSA染色强。偶见细胞外粘液。
虽然各研究小组提出的诊断标准各有侧重,观察者间一致性也有待提高,[9]但从实用的角度出发,应强调最主要的两条诊断依据:①明显恶性的腺癌细胞在导管内生长;②导管基底细胞至少部分保存。
2.2 IDC-P与浸润癌的关系 IDC-P常与高级别浸润癌共存[5-6,10]。偶见活检标本中仅有IDC-P而无浸润癌存在[7, 11]。GUO 和EPSTEIN[7]报道45,000 例穿刺活检中只有27 例仅见IDC-P而无浸润性癌 (0.06%)。ROBINSON等[11]报道了83例仅有IDC-P而无浸润癌的病例,进一步追踪其中21例进行了根治性前列腺癌切除的标本,其中19例可见浸润癌成份,进一步提示IDC-P不是癌前病变,而是常与浸润癌共存的病变。
3.IDC-P的检出率及组间一致性研究
IDC-P的检出率与样本类型和临床分期有关。根治标本和晚期病例中IDC-P的检出率高于穿刺活检样本和低分期病例。一组312例前列腺癌穿刺活检标本中33例 (10.6%) 检出IDC-P[12],而一组晚期转移性前列腺癌穿刺活检标本中IDC-P的检出率达则达到20.5% (57/278)[13]。根治标本中IDC-P的检出率比穿刺活检标本高。一组901例根治标本中有155例检出IDC-P(17.2%)[14],而另一组高风险前列腺癌根治标本中IDC-P的检出率高达50.5% (104/206)[15]。
4.IDC-P的鉴别诊断
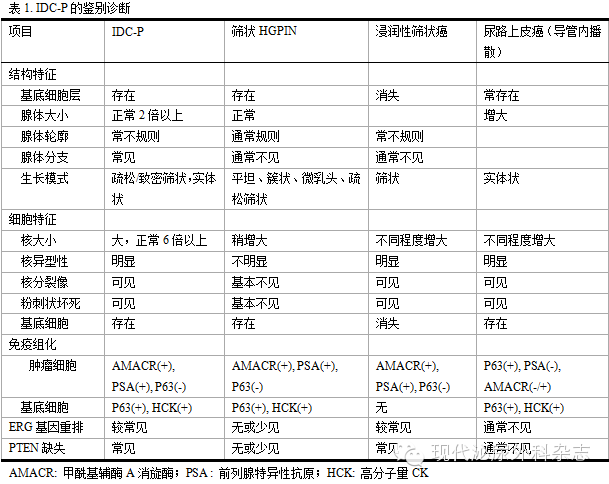
IDC-P需与各种具有筛状和实性生长方式的前列腺病变鉴别,包括筛状HGPIN、前列腺筛状浸润性癌、导管腺癌以及尿路上皮癌累及前列腺等(表1)。
4.1 筛状HGPIN筛状HGPIN是常见的前列腺导管内病变,有与IDC-P相似之处,但生物学行为迥异,为前列腺癌的前驱病变,因此二者的鉴别具有重要临床意义。
二者均表现为导管和腺泡内的上皮不典型增生,IDC-P的细胞和结构异型性更明显,而筛状HGPIN的腺体较小,细胞相对一致,无明显多形性,几乎不见致密筛状和实体状生长方式以及粉刺状坏死。
HGPIN和IDC-P均可见疏松筛状和微乳头结构。如同时具备其他特征,如明显增大的、多形性的核(至少为邻近非肿瘤性腺上皮细胞核的6倍)及非局灶性粉刺状坏死等,才可诊断IDC-P[16-17]。
二者免疫表型相似,均表达PSA、甲基辅酶A消旋酶(methylcoenzyme A racemase ,AMACR)及基底细胞标志物(P63,HCK)等。LOTAN等[18]报道84% 的IDC-P(38/45) 有PTEN基因表达缺失,而HGPIN (0/39) 均无PTEN表达缺失,提示PTEN可作为鉴别IDC-P和HGPIN的免疫组化标记之一。我们的资料显示PTEN的诊断价值尚需进一步研究。
SHAH 等[16-17]提出“不典型筛状病变(atypical cribriform lesion, ACL)”的概念,定义为“前列腺腺体或导管充填有恶性特征的细胞,但基底细胞部分或完全保留(通过高分子量CK和 / 或P63证实)”,具有实体结构和粉刺状坏死的导管内病变也纳入此范畴。作者提出浸润癌成份内或距浸润癌3mm以内的ACLs为前列腺癌相关ACLs (ACL-PCa),等同于IDC-P;而距离3mm以上的ACLs则为非前列腺癌相关的或独立的ACLs,等同于筛状 HGPIN。
4.2 浸润性筛状癌浸润性筛状癌(Gleason 分级4级 ,如有粉刺状坏死则为5级)形态非常类似筛状IDC-P,但没有基底细胞。某些情况下,识别正常导管轮廓和分支有助于区分浸润性筛状癌与IDC-P [16]。但如果不进行基底细胞免疫组织化学染色,大多数IDC-P可能被诊断为浸润性筛状癌。虽然IDC-P多伴有Gleason分级高的浸润性癌,我们最近的研究显示即使在Gleason分级高的转移性前列腺癌中,有IDC-P的病例预后依然明显差于无IDC-P的病例[13],提示通过基底细胞免疫组化区分浸润性筛状癌和IDC-P具有重要临床意义。
4.3 前列腺导管腺癌(ductal adenocarcinoma, DA) 导管腺癌是一种侵袭性前列腺癌亚型,常发生于尿道前列腺部或尿道周导管。肿瘤细胞常呈假复层高柱状,形成筛状或乳头状结构,类似宫内膜腺癌;坏死常见;导管腺癌中的乳头常有真正的纤维血管轴心,细胞核异型性明显,核大,核仁明显,核分裂易见。IDC-P 细胞则常呈立方状,排列成筛状、微乳头状或簇状,没有真正的纤维血管轴心。导管腺癌也易出现导管内播散,可与IDC-P共存,部分病例可见残留的基底细胞。部分学者曾提出将导管腺癌归入导管内癌的范畴[8],但导管腺癌有特殊形态特点,大部分均没有基底细胞,二者仍应分开[16]。
4.4 尿路上皮癌播散入前列腺导管 发生于膀胱的尿路上皮癌,或罕见的前列腺原发的尿路上皮癌,也可扩散至前列腺导管,形态与实体型IDC-P相似,但其肿瘤细胞多形性更明显。免疫组织化学染色有助于鉴别诊断。IDC-P表达前列腺特异性标志物如前列腺特异性抗原(prostate-specific antigen,PSA)、前列腺特异性酸性磷酸酶(prostate-specific acid phosphatase, PSAP)、前列腺特异性膜抗原(prostate-specific membrane antigen ,PSMA),而HCK、P63等基底细胞标记仅表达于肿瘤腺体周围的基底细胞。相反,尿路上皮癌不表达PSA、PSAP和PSMA,多数表达CK7和P63,亦常表达CD20[16]。
5. IDC-P的分子遗传学改变
5.1 IDC-P中ERG基因重排常见雄激素调节基因TMPRSS2或其他一些基因与ETS家族成员(ERG、ETV1、ETV4、ETV5等)发生融合是前列腺癌中常见的遗传学改变。TMPRSS2-ERG是最常见的融合形式,占所有融合形式的50%到70%。在IDC-P中与在浸润性癌中一样,ETS家族基因融合常见[18-20],且IDC-P与周围浸润癌的ERG异常表达一致[21]。与之相反,HGPIN中几乎不能或仅少数病例可检出ERG基因重排[18-20],且有ERG基因重排的HGPIN总是与有ERG基因重排的浸润性癌共存。目前尚无报道显示不伴浸润性癌的孤立性HGPIN中存在这一基因异常[22-23]。因此,ERG基因重排可帮助鉴别形态学诊断困难的IDC-P和HGPIN。一些研究报道ERG免疫组化染色阳性与EGR基因融合状态具有较高吻合率,ERG 基因融合状态可通过常规的ERG免疫组化进行[24-25]。国外文献报道ERG免疫组化阳性病例较多(可达50%~70%),但我们的资料显示国人前列腺癌(包括IDC-P)中ERG阳性率较低(约10%~20%)。
5.2 IDC-P 中PTEN丢失较常见一组病例研究报道84%的IDC-P(38/45)中存在PTEN表达缺失,与浸润性癌相似,而HGPIN (0/39) 未见PTEN表达缺失[18]。另一组病例中,浸润性前列腺癌 PTEN缺失率为76% (38/50),ERG表达率为58%(29/50);IDC-P中PTEN缺失率为61% (20/33) ,ERG表达率为30%(10/33);而19例HGPIN中均未见PTEN表达缺失或ERG表达[19]。这些研究提示ERG和PTEN可能有助于成为IDC-P和HGPIN的鉴别诊断,但需要进一步的研究证实。
5.3IDC-P中的等位基因杂合性缺失(loss of heterozygosity ,LOH) DAWKINS 等[26]在IDC-P和HGPIN中检测前列腺癌中常见的微卫星多态性标记的缺失状况,在HGPIN和Gleason 3级的前列腺癌中很少检出LOH,Gleason 4级前列腺癌中LOH的检出率为29%,而IDC-P的LOH检出率为60%。另一项比较基因组杂交研究显示IDC-P中存在一些染色体不平衡,而 HGPIN几乎无改变;杂合性缺失检测显示IDC-P中TP53和RB 基因的杂合性缺失比例较高(52%),而这些改变在有包膜外侵犯的前列腺癌、浸润性癌、HGPIN和良性前列腺组织中发生的频率分别为44% 、24% 、19%和17%,亦提示IDC-P可能为浸润性癌发展过程中进一步演变形成[27]。
5.4 IDC-P与BRCA2基因突变一项研究比较了家族性BRCA2携带者前列腺癌患者和散发性前列腺癌患者的新鲜肿瘤组织裸鼠移植模型,观察到家族性BRCA2携带者移植瘤中IDC-P发生率较高 (42%),而散发性前列腺癌患者移植瘤中IDC-P发生率较低(9%,P = 0.004)。具有IDC-P的BRCA2 携带者预后差于无IDC-P的携带者[28]。
6. IDC-P的临床意义
研究表明,无论前列腺穿刺活检标本或是根治标本中存在IDC-P均提示预后不良。前列腺根治标本中IDC-P与高级别浸润癌共存,与Gleason评分、肿瘤容积、前列腺外扩散、精囊腺侵犯和淋巴结转移均密切相关[3,5-6,10]。多篇文献报道了根治标本中存在IDC-P为生化复发和总体生存率的独立预测指标[6,14-15,29-30]。进一步研究显示不同组织学亚型的IDC-P患者疾病进展比例不同,小梁状 / 筛状IDC-P患者临床演进率为35%,而实体状/ 粉刺状IDC-P患者的临床演进率高达85% [30]。全基因组测序研究显示同一患者前列腺癌中转移性病灶与IDC-P同源性最高,表明IDC-P可能是更具侵袭性的克隆[31]。穿刺活检标本中IDC-P的临床意义研究较少。我们对一组晚期转移性前列腺癌患者穿刺标本中IDC-P进行分析,显示其为去势抵抗性前列腺癌(castration resistant prostate cancer,CRPC)和总生存率的独立预测指标[13]。KWAST等[32]及我们[33]的另一项研究的研究还显示IDC-P的存在提示病人更易进展为去势抵抗型或者对放疗不敏感。我们对46例CRPC的患者二次穿刺材料进行分析,结果显示29例有IDC-P,且有IDC-P的患者对化疗的敏感性明显低于无IDC-P患者[33]。
7. 前列腺穿刺活检中IDC-P的报告
虽然上述研究显示IDC-P 是前列腺癌重要的预后指标之一,但部分病理医师和临床医师对其认识尚不充分,实际诊断工作中IDC-P可能被低估。多数情况下,IDC-P常伴随浸润性癌,这些癌通常为Gleason分级4或5,故一些学者对报告浸润性癌时是否仍需报告IDC-P存疑。上文所述的研究显示即使晚期转移性前列腺癌,IDC-P仍是CRPC和预后不良的独立预测指标[13],可提供新的预后信息。故在伴有高级别浸润性癌的病例中,仍有必要指出IDC-P的存在。
穿刺活检中仅见IDC-P而未见浸润性癌的情况罕见,这时病理医师宜对IDC-P进行描述,泌尿外科医师应注意这些病变通常与高级别和进展期的前列腺癌相关,可能应进行必要的治疗;或对这种病例立刻再活检。另一种很罕见的情况是,IDC-P存在于仅有Gleason分级3的前列腺癌穿刺活检标本中,此时可通过两种方式报告:①将IDC-P按浸润性癌标准进行Gleason分级,②仅将浸润性癌分级为Gleason 3,在备注中指出存在IDC-P及其临床意义。
如不典型细胞构成的筛状病变不能满足IDC-P的诊断标准但超过HGPIN的标准,应报告为不典型筛状病变,不除外IDC-P,并建议进行再活检[16,34]。
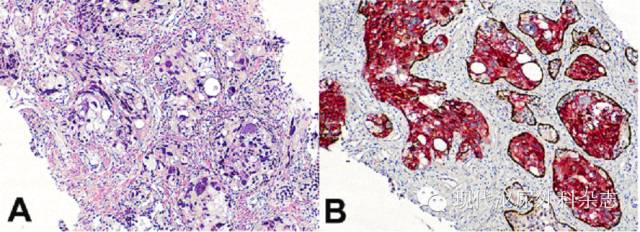
图1:前列腺导管内癌形态
A:HE染色;B:AMACR/P63/HCK三重免疫组化染色,红色信号显示肿瘤细胞胞质表达AMACR,棕黄色信号显示基底细胞表达P63(核)和HCK(胞质)。
此文刊登在《现代泌尿外科杂志》2016年1期专家论坛栏目
参考文献:略















共0条评论