[导读] 欣赏一下黎叔的这例病例的内镜及病理的精美大图(版权归上海市松江区中心医院病理科张黎老师所有!)
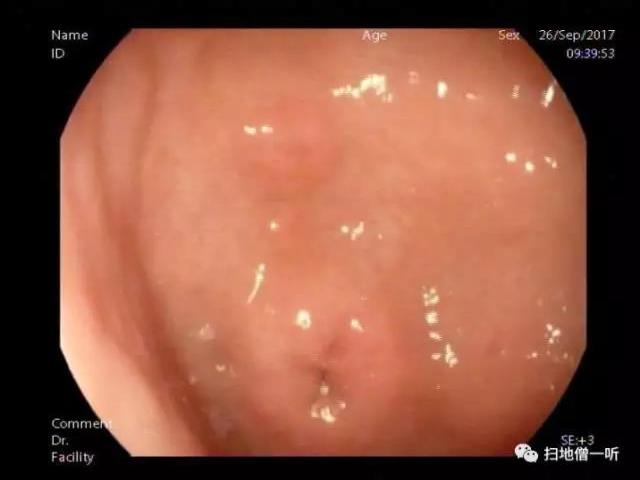
【内镜图】
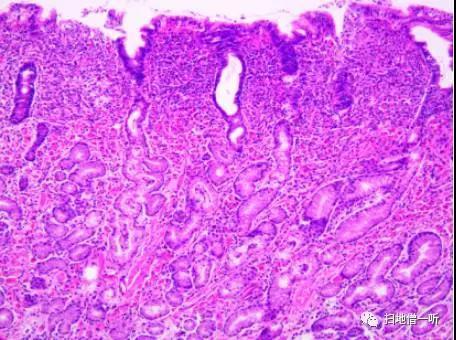
【HE染色】
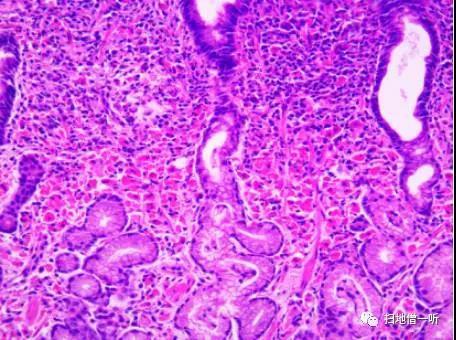
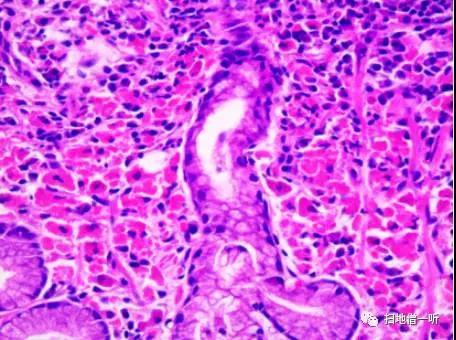
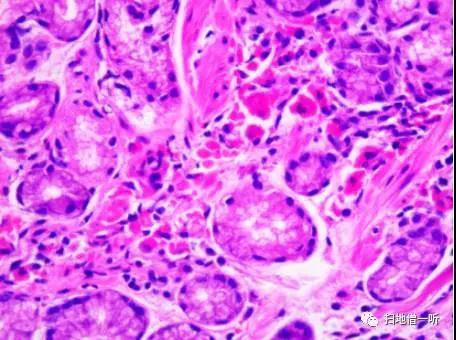
【PAS染色】

【CD138】
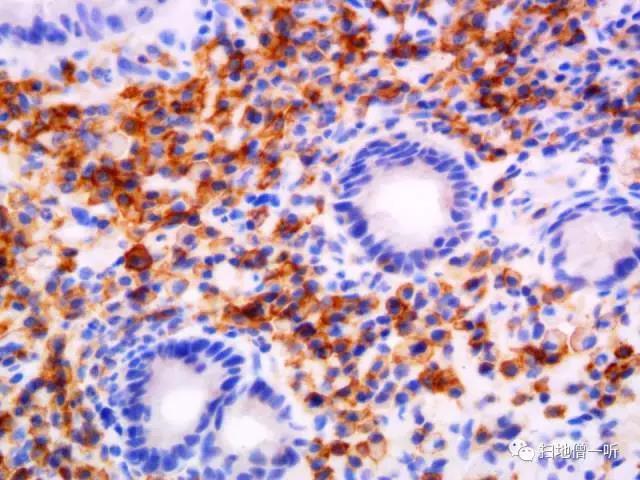
【诊断】Russell 小体性胃炎
另例Russell 小体性胃炎相关资料:
患者,女,年龄78岁,因上腹痛需接受食管胃十二指肠镜检查(EGDS)而被收入消化科病房。EGDS显示胃黏膜充血,从胃窦部和食管胃连接部取活检。根据悉尼分类系统,组织学检查显示胃窦部中度慢性胃炎,无多形核白细胞活化、胃黏膜腺体萎缩或肠上皮化生。
胃食管连接部黏膜的固有层中可见含有透明粉红色小体的细胞,高碘酸-Schiff反应(PAS)阳性且具有PAS淀粉酶抗性(见图A和B)。未见有丝分裂活性或不典型。胃窦及贲门部幽门螺杆菌姬姆萨染色和免疫组化检查结果均呈阴性。
嗜酸性细胞内容物的CD138 (见图C)、CD79a、κ和λ轻链染色均呈阳性,角蛋白池与白细胞共同抗原染色呈阴性。κ和λ轻链显示浆细胞为多克隆起源。免疫学恶液质评估结果为阴性。超微结构检查显示浆细胞中的粗面内质网(RER)上有大量圆形、电子密集性物质,直径可达5 μm(见图D)。上述结果提示为拉塞尔小体胃炎。
该患者行13C尿素氮呼气试验(UBT)、腹部超声、胸部X线、心电图和常规生化检查,结果均呈阴性。由于未能证实幽门螺杆菌感染,对该患者给予质子泵抑制剂(PPI)治疗,上腹痛缓解,计划长期对其进行内镜随访。
拉塞尔小体(Russell小体)胃炎的组织学、免疫组化和超微结构特征。
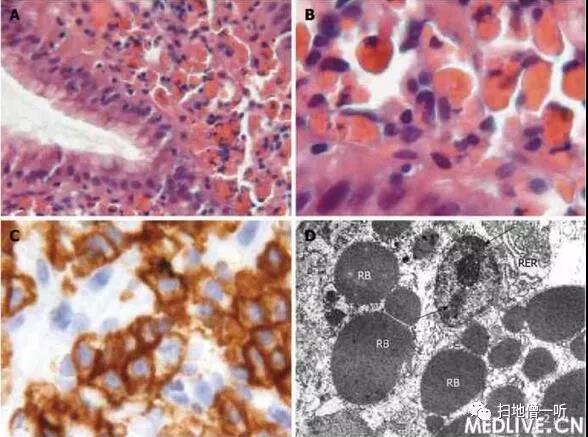
A:胃食管连接部样本显示,含有嗜酸性内容物——拉塞尔小体——单形性细胞;
B:高倍镜下观察到的含有晶体状内容物的浆细胞;
C:浆细胞对CD138抗体的免疫组化反应;
D:电镜下观察到,浆细胞核内有典型的致密染色质(箭头)和发育良好的粗面内质网(RER),膨胀的RER潴泡中有若干直径1~5 μm的拉塞尔小体。
另例Russell 小体性胃炎相关资料:
患者男,69岁。无明显诱因出现上腹隐痛2周于2013年1月14日入院。腹痛程度较轻,不伴他处放射,与进食、体位无关,不伴恶心、呕吐,偶有反酸,无烧心,不伴寒战、发热。既往患有高血压病史10年,口服抗高血压药血压控制稳定,“冠状动脉粥样硬化性心脏病”病史4年,未正规治疗,2年前曾因“短暂性全面遗忘症”于我院神经内科住院治疗,否认特殊病史。实验室检查无特殊;骨髓穿刺活检显示正常骨髓象。上消化道内镜检查:胃窦黏膜粗糙呈粗大颗粒样改变,多发糜烂充血,并见多处黏膜呈黄白色、不规则肿胀(图1),质较硬,表面糜烂充血,取胃窦黏膜活检4块行组织病理学检查。快速尿素酶试验:幽门螺杆菌(HP,+++)。内镜诊断:萎缩性胃炎伴糜烂,胃窦黏膜性质待查。
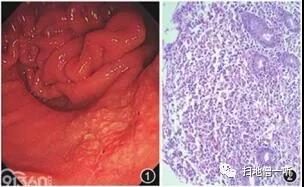
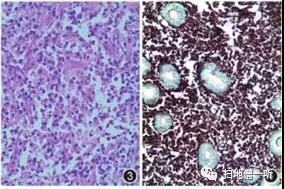
图1 Russell小体胃炎,上消化道内镜显示胃窦部黏膜局部呈黄白色、不规则肿胀,伴糜烂充血;
图2 胃黏膜活检显示腺体轻度萎缩,膨胀的固有层内见大量嗜酸性胞质及偏位核的单形性的细胞弥漫浸润,伴胃窦腺上皮内灶性多形性的中性粒细胞浸润 HE 中倍放大;
图3 大量大小不等的、圆形至椭圆形、均质的嗜酸性小体(Russell小体)及散在的浆细胞,也有数量不等的Russell小体位于浆细胞胞质内,呈“桑葚样”或“葡萄样”外观(即Mott细胞) HE 高倍放大;
图4 κ染色示固有层内浆细胞胞质及Russell小体弥漫阳性 EnVision法 中倍放大。
病理检查:胃黏膜轻度萎缩、中度肠化生,伴灶性多形性中性粒细胞浸润,腺上皮无核分裂象及异型增生;固有层膨胀,其中见大量圆形、椭圆形的嗜酸性透明小体(图2),直径在5~20μm之间,非双折光性(non-birefringent),有单个散在分布,也有些数量不等的聚集在胞质内,并可见被挤压的胞核,呈“桑葚样”或“葡萄样”外观(图3);此外,高倍镜下可观察到小凹上皮表面及其黏液中聚集的、细的波浪状蓝色杆菌。免疫组织化学:胞质内含嗜酸性透明小体的细胞显示广谱细胞角蛋白(CKpan)、CD68、CD20均阴性,但CD79a、CD138阳性,证明是浆细胞,即Mott细胞,并且κ阳性,λ阴性,二者呈单克隆表型(图4)。
病理诊断:Russell小体胃炎伴单克隆浆细胞增生。
随访:患者去上海某医院会诊,诊断意见为浆细胞单克隆增生,不除外黏膜相关淋巴组织结外边缘区B细胞淋巴瘤(MALT淋巴瘤)。然后在该院消化内科行内镜下黏膜切除术,术后病理结果同会诊意见。随后北京某医院会诊意见为胃黏膜中单克隆浆细胞浸润。随访患者3年半,未进行化疗,一般情况好,无病情反复。
【讨论】
Russell小体胃炎(Russell body gastritis,RBG)是以胃黏膜固有层出现大量包含Russell小体的浆细胞浸润为特征的假瘤样病变,最初由Tazawa和Tsutsumi[1]于1998年描述并命名。含有Russell小体的浆细胞,即Mott细胞,具有多克隆免疫表型(κ链和λ链均阳性),以膨胀的粗面内质网为特征,是免疫球蛋白异常分泌并蓄积的结果。RBG是一种罕见的慢性胃炎,包含本例,目前仅检索到35例报道[2]。患者的平均年龄是59岁(24~80岁),包括21例男性和14例女性。患者主要因胃的非特异症状就诊,包括上腹部疼痛或不适、消化不良和恶心。内窥镜下一般表现为黏膜肿胀、隆起和红斑,小部分病例表现为糜烂、溃疡。RBG的病因学目前尚不清楚,在已报道的病例当中,23例(65.7%)有或曾经有过HP感染[2],部分病例在根治HP的抗生素治疗后胃炎消退,因此部分作者指出RBG与HP感染密切相关,提示HP作为抗原刺激因子促使浆细胞过度产生免疫球蛋白。但是HP感染并不总是导致RBG。部分没有HP感染证据的RBG病例当中,有2例人类免疫缺陷病毒(HIV)阳性患者,1例丙型肝炎患者,1例为念珠菌性食管炎的患者,1例为肾和胰腺移植后患者,1例为血脂障碍和横纹肌溶解症患者。此外,还有2例RBG伴发EB病毒相关的胃腺癌,此时Mott细胞增殖很可能是一种反应性的癌旁现象。由此可见,RBG是发生在具有特殊免疫体质的人群,由于某种病原体的存在,慢性炎性病变或恶性肿瘤等原因引起趋化因子的异常表达,刺激浆细胞产生过量的免疫球蛋白,由于分泌受损导致免疫球蛋白异常蓄积而形成大量的Russell小体[2]。
包括本例RBG,目前仅检索到6例单克隆RBG的报道[3,4,5,6,7],其中,5例伴有HP感染,而另1例是丙型肝炎患者。Wolkersdörfer等[3]报道了1例呈λ限制性表达的RBG,其血清蛋白电泳和免疫固定电泳提示该患者伴有意义未定的单克隆γ病,临床根除HP的治疗能使RBG缓解,但副蛋白血症仍然未受影响。其他5例RBG均呈κ单克隆,病变均局限于胃黏膜,组织学证实这些细胞是非肿瘤性的,都没有显示出MALT淋巴瘤、明确的浆细胞肿瘤或相关的血液及淋巴组织恶性肿瘤的临床和病理学特征,并且临床随访评估是安全的。虽然Fan等[8]认为,单克隆性是疾病进展为恶性的预兆,但笔者认为单克隆浆细胞增生并不一定说明是恶性的,也并不意味着将来一定会形成淋巴源性肿瘤。目前已有文献报道,B细胞的单克隆增殖是与慢性炎性病变相伴随的,比如桥本甲状腺炎、慢性乙型肝炎和HP诱导的慢性活动性胃炎等,在这些病例中并没有找到B细胞克隆的存在与淋巴瘤演变之间的必然联系。Araki等[9]也建议病理学者在诊断时需要谨慎,不能仅仅依靠免疫球蛋白轻链的限制性表达就直接诊断为恶性肿瘤,还要通过组织学寻找诊断恶性肿瘤的其他证据。
【鉴别诊断】
本例独特的组织学特征使其在低倍镜下与印戒细胞癌,尤其是嗜酸细胞变异型印戒细胞癌非常相似。但高倍镜观细胞核缺乏异型,核分裂象罕见,并且免疫组织化学CKpan染色阴性可排除之。本例浆细胞具有单克隆表型,因此与浆细胞瘤和伴浆细胞分化的淋巴造血肿瘤鉴别尤为困难,主要包括:(1)伴浆细胞分化的MALT淋巴瘤:MALT由形态多样的小B细胞组成,包括中心细胞样细胞、单核样细胞、小淋巴细胞和散在的免疫母细胞及中心母细胞。发生于胃的MALT淋巴瘤背景中常见多个滤泡样结构,肿瘤细胞多位于滤泡的边缘区及滤泡间区,约1/3的病例伴浆细胞分化,甚至可见Russell小体,并有淋巴上皮病变及滤泡植入现象,本病缺乏诊断MALT淋巴瘤的组织学依据。(2)淋巴浆细胞淋巴瘤:通常侵犯骨髓、有时累及淋巴结和脾脏,并且大多数出现血清IgM增高。组织学主要由小B淋巴细胞混杂数量不等的浆细胞样淋巴细胞(二者CD20阳性)和浆细胞(CD38、CD138阳性)组成的肿瘤,Dutcher小体(核内的免疫球蛋白包涵体)是其特征性改变,不符合任何其他也伴浆细胞性分化的小B细胞淋巴瘤的诊断标准,即本病是排他性诊断。该患者缺乏诊断淋巴浆细胞淋巴瘤的实验室检查阳性结果及骨髓侵犯的证据。(3)髓外浆细胞瘤:本例中Mott细胞出现轻链限制性表达,因此二者的鉴别诊断尤为困难。单克隆RBG诊断名称的提出也是对伴Russell小体形成的髓外浆细胞瘤的一个挑战。因为二者均是局限性的病变,也均无骨髓及血液学受累以及本-周蛋白尿的证据,二者的争论点在于出现浆细胞的单克隆增生是否就是诊断恶性肿瘤(浆细胞瘤)的直接依据。由于该患者具有HP感染的证据,内窥镜所见提示为慢性萎缩性胃炎伴糜烂,并没有明确的瘤块,组织学显示增生的浆细胞和/或Mott细胞均缺乏细胞核的不典型性和有丝分裂活性,也没有侵袭和破坏的证据。而且,患者近3年半的随访一切正常,所以本例更倾向于诊断单克隆性RBG。
【治疗及预后】
RBG非常罕见,在治疗方面缺乏循证医学经验和指导。对于HP阳性的RBG患者,临床上主要实施根治HP的抗生素治疗。对单克隆的RBG患者,临床应排除是否伴有其他感染性因子和肿瘤性病变的存在。本病例是具有单克隆表型的RBG,无论Mott细胞的单克隆增生本质上是反应性的还是某些明确的恶性肿瘤,如MALT淋巴瘤或浆细胞瘤等的前驱病变,此时均无需过度诊治,观察随访及内窥镜下定期复查即可。
【参考文献】
[1]TazawaK, TsutsumiY.Localized accumulation of Russell body-containing plasma cells in gastric mucosa with Helicobacter pylori infection: ′Russell body gastritis′[J]. Pathol Int, 1998, 48(3):242-244.
[2]MuthukumaranaV, SeguraS, O′BrienM, et al. “Russell body gastroenterocolitis” in a posttransplant patient: a case report and review of literature[J]. Int J Surg Pathol, 2015, 23(8):667-672. DOI:10.1177/1066896915601893.
[3]WolkersdörferGW, HaaseM, MorgnerA, et al. Monoclonal gammopathy of undetermined significance and Russell body formation in Helicobacter pylorigastritis[J]. Helicobacter, 2006, 11(5):506-510.
[4]TabataS, TaguchiS, NorikiS. A case of Russell body gastritis[J]. Gastroenterol Endosc, 2010, 52: 2927-2932.
[5]MiuraS, ShirahamaK, SakaguchiM, et al.Russell body gastritis[J].Nihon Shokakibyo Gakkai Zasshi, 2012, 109(6):929-935.
[6]CoyneJD, AzadehB. Russell body gastritis: a case report[J]. Int J Surg Pathol, 2012, 20(1):69-70. DOI:10.1177/1066896911416115.
[7]ArakiD, SudoY, ImamuraY, et al. Russell body gastritis showing IgM kappa-type monoclonality[J]. Pathol Int, 2013, 63(11):565-567. DOI:10.1111/pin.12105.
[8]FanHB, ZhuYF, ChenAS, et al. B-cell clonality in the liver of hepatitis C virus-infected patients[J]. World J Gastroenterol, 2009, 15(13):1636-1640.
[9]ArakiD, SudoY, ImamuraY, et al. Russell body gastritis showing IgM kappa-type monoclonality[J]. Pathol Int, 2013, 63(11):565-567. DOI: 10.1111/pin.12105.























共0条评论