作者:复旦大学附属华山医院病理科张夏玲医生摘译与撰写
审校: 杜尊国 熊佶



2017年WHO内分泌系统肿瘤分类系统近期已发布,关于垂体肿瘤的分类作了全新阐述;Pro. Lopes 也对其作了详尽总结。在此,我们将分2期进行解读。
新版本中垂体前叶/腺垂体肿瘤分类的重大变化如下:
(1)根据垂体腺瘤细胞分化(来源)谱系对其进行新分类;
(2)改变垂体腺瘤的组织学分级,取消“非典型腺瘤”这一术语;
(3)引入新的实体,例如垂体母细胞瘤,重新定义旧的实体,例如零细胞腺瘤。
新分类非常实用,主要是在形态学基础上,结合特定激素和转录因子的免疫组化染色,绝大多数垂体腺瘤便可分类,不需要常规进行超微结构分析,因为这些肿瘤的大多数超微结构特征可以通过免疫组织化学方法来识别,具体方法与标记物选择亦有陈述。新版本虽摒弃非典型腺瘤的术语,却强烈建议通过评估肿瘤增殖潜能,如计数核分裂象和Ki-67指数,以及周围组织有无肿瘤侵犯等其他临床参数,来评估个体病例是否考虑为具有侵袭性生物学行为的腺瘤。依据有无侵袭性生物学行为,将以下五种腺瘤归为“高危型垂体腺瘤”,包括:稀疏颗粒型生长激素细胞腺瘤、男性泌乳素细胞腺瘤、多激素PIT-1阳性腺瘤(以前称为静止性第三亚型腺瘤)、静止性促肾上腺皮质激素细胞腺瘤和 Crooke细胞腺瘤。
新版中也提及了垂体非神经内分泌肿瘤分类的变化,特别是发生于垂体后叶的垂体细胞瘤、颗粒细胞瘤以及梭形细胞嗜酸细胞瘤。这些变化与2016年WHO中枢神经系统肿瘤分类一致。同时,增加了鞍区室管膜瘤这一诊断。
新版本详细介绍了发生于鞍区的其他肿瘤,包括颅咽管瘤、间叶组织肿瘤、生殖细胞肿瘤和造血系统肿瘤。
表1. WHO2017与2014版垂体肿瘤分类对照
2017版分类 | 2014版分类 |
垂体腺瘤 | 生长激素细胞腺瘤 | 分泌生长激素的腺瘤 |
| 泌乳激素细胞腺瘤 | 分泌泌乳激素的腺瘤 |
| 促甲状腺激素细胞腺瘤 | 分泌促甲状腺激素的腺瘤 |
| 促肾上腺皮质激素细胞腺瘤 | 分泌促肾上腺皮质激素的腺瘤 |
| 促性腺激素细胞腺瘤 | 分泌促性腺激素的腺瘤 |
| 零细胞腺瘤 | 零细胞腺瘤 |
| 多激素和双激素细胞腺瘤 | 多激素腺瘤 |
垂体癌 | 垂体癌 | 垂体癌 |
垂体母细胞 |
|
|
垂体后叶肿瘤 | 垂体细胞瘤 |
|
| 鞍区颗粒细胞瘤 | 颗粒细胞瘤 |
| 梭形细胞嗜酸细胞瘤 |
|
| 鞍区室管膜瘤 |
|
神经元和副神经元性肿瘤 | 神经节细胞瘤和混合性神经节细胞瘤-腺瘤 | 节细胞瘤 |
| 神经细胞瘤 |
|
| 副神经节瘤 |
|
| 神经母细胞瘤 |
|
颅咽管瘤 | 造釉细胞型颅咽管瘤 |
|
| 乳头型颅咽管瘤 |
|
间叶组织肿瘤 | 脑膜瘤 | 脑膜瘤 |
| 神经鞘瘤 |
|
| 脊索瘤,NOS | 脊索瘤 |
| 软骨样脊索瘤 |
|
| “去分化”脊索瘤 |
|
| 孤立性纤维瘤/血管外皮细胞瘤 |
|
| 1级SFT/HPC
2级SFT/HPC
3级SFT/HPC |
|
| 其他间叶组织肿瘤 |
|
淋巴造血系统肿瘤 |
|
|
生殖细胞肿瘤 | 生殖细胞瘤 |
|
| 卵黄囊瘤 |
|
| 胚胎性癌 |
|
| 绒毛膜癌 |
|
| 畸胎瘤,NOS |
|
| 成熟畸胎瘤 |
|
| 未成熟畸胎瘤 |
|
| 畸胎瘤伴恶性转化 |
|
| 混合生殖细胞肿瘤 |
|
继发性肿瘤 |
| 继发性肿瘤 |
1.垂体神经内分泌肿瘤新分类原则
一直以来,垂体腺瘤是按照组织病理学特征、垂体激素和肿瘤细胞的超微结构特征来进行分类。2017年WHO新分类的主要变化是采用垂体腺瘤细胞分化谱系进行分类(表2),例如将“分泌生长激素的腺瘤”改为“生长激素细胞腺瘤”(“growthhormone producing adenoma” vs “somatotrophadenoma”),以强调其细胞分化谱系来源。转录因子(和分化驱动因子)对嗜酸性细胞谱系、促性腺激素细胞谱系和促肾上腺皮质激素细胞谱系的神经内分泌细胞的分化和成熟至关重要。具有重要意义的转录因子主要包括:诱导生长激素、泌乳素和促甲状腺激素细胞分化的PIT-1(垂体特异性POU-同源结构域转录因子),调节促性腺激素细胞分化的SF-1(类固醇生成因子1),阿片-促黑素细胞皮质激素(POMC)谱系与促肾上腺皮质激素细胞的分化T-PIT(T-box家族成员TBX19)转录因子。
表2 基于腺瘤细胞谱系的垂体腺瘤分类
谱系 | 主要转录因子和其他辅助因子 | 腺垂体细胞 |
嗜酸性谱系 | PIT-1 | 生长激素细胞 |
| PIT-1, ERα | 泌乳素细胞 |
| PIT-1, GATA-2 | 促甲状腺激素细胞 |
促肾上腺皮质激素细胞谱系 | T-PIT | 促肾上腺皮质激素细胞 |
促性腺激素细胞谱系 | SF-1; GATA-2, ERα | 促性腺激素细胞 |
Pit-1垂体特异POU类同源结构域转录因子1,ERα雌激素受体α,GATA-2 锌指转录调控蛋白的GATA家族成员,T-PIT T-box家族成员TBX19,SF-1 类固醇生成因子1
新分类的主要辅助技术手段是免疫组化,利用垂体激素(GH,PRL,ACTH,β-TSH,β-LH,β-FSH和糖蛋白的α亚基)染色进行分类,必要时加做垂体转录因子(PIT-1,SF-1,T-PIT)及辅助因子ERα染色。在组织形态学基础上,IHC对超微结构具有很好的替代作用,绝大多数肿瘤无需进一步进行超微结构分析。
垂体转录因子在腺瘤分化谱系的识别中非常重要,例如:具有PIT-1表达的多激素腺瘤就定义为多激素PIT-1阳性腺瘤;无细胞谱系分化的零细胞腺瘤缺乏这些转录因子;仅局灶或弱表达促性腺激素的腺瘤,SF-1强阳性提示促性腺激素细胞谱系分化。
低分子量细胞角蛋白(如Cam5.2,CK8或CK18等),在某些腺瘤亚型的识别中具有重要意义。例如,在稀疏颗粒型生长激素细胞腺瘤和嗜酸性干细胞腺瘤的纤维小体中呈点状表达;在促肾上腺皮质激素细胞腺瘤中呈弥漫阳性,在Crooke细胞腺瘤中呈环状表达。
雌激素受体α(ERα)是在泌乳激素和促性腺激素细胞中表达的一种类固醇受体,例如泌乳生长激素细胞腺瘤(mammosomatotroph adenoma)是一类同时伴有生长激素和泌乳素分泌的肿瘤,在超微结构中可见分泌颗粒排出,ERα免疫染色阳性。而一些伴有灶性PRL表达的生长激素细胞腺瘤,ERα免疫染色则不表达,此类肿瘤的预后比致密颗粒型生长激素细胞腺瘤预后要差。
表3显示垂体腺瘤的免疫组化特征、肿瘤的分化及其类型,其中某些高危亚型的识别对其预后及治疗具有指导意义。
表3 垂体腺瘤的病理分类
腺瘤类型 | 免疫表型 | 转录因子及其他辅助因子 |
生长激素细胞腺瘤 |
|
|
致密颗粒型生长激素细胞腺瘤a | GH ± PRL ± α-亚基 | PIT-1 |
| LMWCK:核周或弥漫 |
|
稀疏颗粒型生长激素细胞腺瘤 | GH ± PRL | PIT-1 |
| LMWCK:点状(纤维小体) |
|
泌乳生长激素细胞腺瘤 | GH + PRL (在相同细胞) ± α-subunit | PIT-1, ERα |
混合性泌乳-生长激素细胞腺瘤 | GH + PRL (在不同细胞) ± α-subunit | PIT-1, ERα |
泌乳激素细胞腺瘤 |
|
|
稀疏颗粒型泌乳激素细胞腺瘤a | PRL | PIT-1, ERα |
致密颗粒型泌乳激素细胞腺瘤 | PRL | PIT-1, ERα |
嗜酸性干细胞腺瘤 | PRL, GH (局灶且不稳定) | PIT-1, ERα |
| LMWCK:点状(纤维小体) |
|
促甲状腺激素细胞腺瘤 | β-TSH, α-亚基 | PIT-1,GATA2 |
促肾上腺皮质激素细胞腺瘤 |
|
|
致密颗粒型促肾上腺皮质激素细胞腺瘤a | ACTH, LMWCK:弥漫 | T-PITb |
稀疏颗粒型促肾上腺皮质激素细胞腺瘤 | ACTH, LMWCK:弥漫 | T-PITb |
Crooke细胞腺瘤 | ACTH, LMWCK:环状 | T-PITb |
促性腺激素细胞腺瘤 |
|
|
稀疏颗粒型促性腺激素腺瘤a | β-FSH, β-LH, α-亚基 (不同组合) | SF-1, GATA2, ERα |
零细胞腺瘤 | 无 | 无 |
多激素细胞腺瘤 |
|
|
多激素PIT-1阳性腺瘤 (以前称为静止性第三亚型腺瘤)b | GH, PRL, β-TSH ± α-亚基 | PIT-1 |
具有不常见的免疫组化组合的腺瘤 | 不同组合: ACTH/GH, ACTH/PRL | 其他转录因子 |
双激素细胞腺瘤 |
|
|
同时具有两种不同激素细胞型腺瘤 | PRL和ACTH常见 | PIT-1和T-PITb |
a 常见形态变体
b 尚无可用商业抗体
LMWCK:低分子量CK
以生长激素腺瘤为例,其定义为:主要表达GH并起源于PIT-1细胞谱系的腺瘤。第一类为单纯表达生长激素细胞腺瘤,包括致密颗粒型生长激素腺瘤和稀疏颗粒型生长激素腺瘤。第二类同时表达GH和PRL激素细胞腺瘤,包括单细胞泌乳生长激素细胞腺瘤和双细胞混合性生长激素-泌乳激素细胞腺瘤。研究显示,稀疏颗粒型生长激素腺瘤更具侵袭性,预后差些。通过低分子量CK免疫染色可以区分纯生长激素腺瘤中的致密颗粒型腺瘤和稀疏颗粒型腺瘤,这样就可以更好的指导临床治疗和判断预后(图1)。
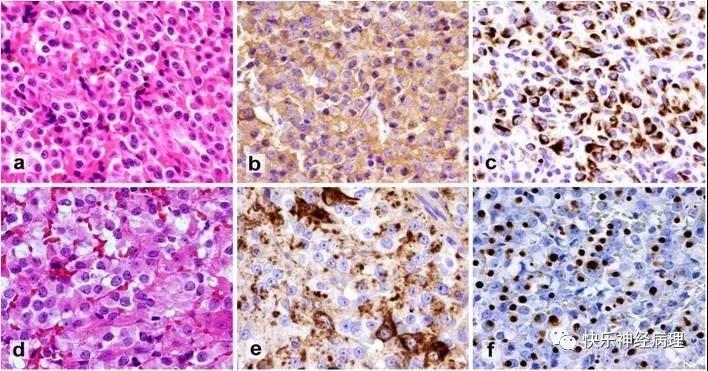
图1 生长激素细胞腺瘤
基于组织学特征和免疫组化分析,可区分致密和稀疏颗粒型生长激素细胞腺瘤。
a-c 致密颗粒型生长激素细胞腺瘤由具有嗜酸性颗粒状胞质和核仁明显的大核细胞组成(a);GH弥漫强阳性(b);细胞角蛋白免疫染色显示核周染色(c)。d-g稀疏颗粒型生长激素细胞腺瘤由嫌色细胞组成, HE染色可见核旁纤维小体(d);GH的免疫染色呈斑片状或颗粒状(e);细胞角蛋白免疫染色突出特征性的胞质内纤维小体(f)。
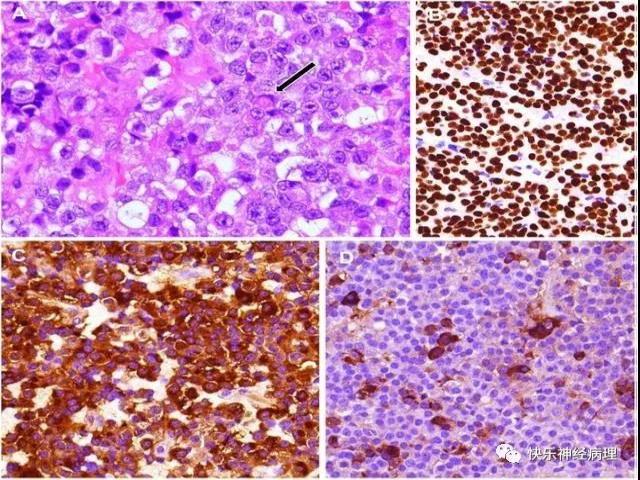
图2 嗜酸干细胞腺瘤
A 肿瘤由含有胞质内空泡或巨大线粒体的嗜酸性细胞组成,可见纤维小体(箭头所示); B 类似于其他嗜酸性腺瘤,Pit-1阳性表达;C PRL弥漫阳性;D 散在GH表达。
2. 垂体腺瘤特殊类型
2.1 促性腺激素细胞腺瘤
促性腺激素细胞腺瘤通常发生于60-70岁患者,男性略多。大多数促性腺激素细胞腺瘤临床上是无功能的。患者的症状和体征包括视觉症状、头痛和垂体功能减退。肿瘤细胞不同程度表达促性腺激素β-LH、β-FSH、α亚基、以及转录因子SF-1(图3)。

图3 促性腺激素细胞腺瘤
嫌色至透明的肿瘤细胞排列成小乳头状结构(a);对于促性腺激素细胞腺瘤的免疫组化染色可以是局部的弱阳性,如图显示的α亚单位仅有很少的阳性(b);FSH(c)和LH(未显示)无阳性表达;表达转录因子SF-1(d),即使在几乎激素免疫阴性腺瘤中也证实了确定的促性腺激素细胞谱系。
2.2 零细胞腺瘤
2014年WHO分类将零细胞腺瘤定义为:激素免疫阴性,没有其他免疫组化及超微结构特征的腺瘤。实际工作中只采用常规激素免疫组化将零细胞腺瘤与其他垂体腺瘤进行区分,证据表明,零细胞腺瘤的诊断不仅只是激素阴性。基于以上因素,2017年WHO分类对零细胞腺瘤进行了重新定义:对垂体激素和转录因子均没有细胞特异性免疫组化证据的腺瘤。因此,零细胞腺瘤的诊断不再适用于激素阴性垂体腺瘤,新分类法需要应用垂体转录因子来评估所有激素阴性的垂体腺瘤。按照新标准,只有少数腺瘤仍被诊断为零细胞腺瘤。
2.3 静止性腺瘤
静止性腺瘤是指患者目前无内分泌亢进症,即临床上无功能的腺瘤,但组织学和免疫组化特征表现出与分化良好的特定谱系腺瘤一致。促肾上腺皮质激素细胞腺瘤是最常见的静止性腺瘤,在缺乏Cushing病和升高的ACTH或皮质醇水平的临床和生化证据患者中,静止性促肾上腺皮质激素细胞腺瘤高达20%。促肾上腺皮质激素细胞腺瘤具有良好的组织学特征和ACTH免疫染色,表达转录因子T-PIT。存在以下三种形态变异特征:致密颗粒型促肾上腺皮质激素腺瘤(最常见)、稀疏颗粒型促肾上腺皮质激素腺瘤和Crooke细胞腺瘤。
静止性促肾上腺皮质激素腺瘤倾向于巨大腺瘤,并且常见海绵窦、蝶窦和骨侵犯。具有梗死和出血倾向,也称为卒中。由于病变具有侵袭性、卒中及复发倾向,因此,这类腺瘤的诊断非常重要。
2.4 多激素腺瘤
除了表达GH 与PRL或β-FSH 与β-LH组合的腺瘤之外,显示一种以上垂体激素表达的腺瘤在2017年WHO分类中被定义为多激素垂体腺瘤。包括:多激素PIT-1阳性腺瘤(以前称为静止性第3亚型腺瘤),临床功能性腺瘤(例如具有肢端肥大症和甲状腺功能障碍的产生GH / PRL / TSH的腺瘤)以及不能通过细胞谱系分化来解释免疫染色的具有异常激素组合的腺瘤。
作为新的实体,即多激素PIT-1阳性腺瘤,转录因子PIT-1呈核弥漫强阳性表达,腺瘤细胞不同程度表达GH、PRL、β-TSH和α亚基(图4)。该肿瘤侵袭性高、无病生存率低、易复发。
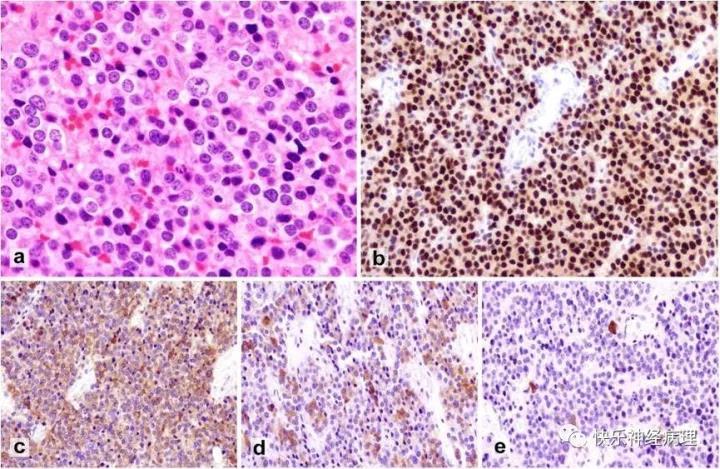
图4 多激素PIT-1阳性腺瘤
瘤细胞胞质嗜酸性(a);转录因子PIT-1弥漫强阳性(b);对于PIT-1家族的一种或多种激素显示出中等至散在的免疫反应,包括α亚基(c),β-TSH(d))和GH(e)。
双激素细胞腺瘤(两种独立的、不同细胞类型的混合肿瘤)及多发性腺瘤(同时存在两个以上的独立肿瘤)不应被误认为是多激素腺瘤。虽然一些多激素腺瘤可以包含一个以上腺瘤细胞谱系,但其他可以是单细胞来源的。使用垂体细胞谱系转录因子有助于区分这些表现。
3. 垂体神经内分泌肿瘤分级的变化
新分类中,垂体神经内分泌肿瘤的组织学分级有明显变化。2004年WHO分类将垂体神经内分泌肿瘤分为三类:腺瘤(典型)、非典型腺瘤和垂体癌。2004年WHO分类的争议性问题是所谓的非典型腺瘤。该定义非常模糊,肿瘤具有侵袭性生物学行为(例如浸润性生长),有丝分裂指数高、Ki-67指数>3%以及p53广泛核染色。采用这些标准,非典型腺瘤的发病率是相对可变的(2-15%),源于Ki-67临界值标准的差异、p53免疫组化染色的评估以及肿瘤浸润。从10年以上的研究回访来看,沿用此类标准,缺乏有效的预后指示作用,并非所有的非典型腺瘤都显示出临床侵袭性行为。基于上述原因,2017新分类删除了“非典型腺瘤”这一术语。
垂体癌的诊断标准未变,以脑脊液和/或全身转移为依据。通常是从多次复发的侵袭性腺瘤演变而来。垂体癌极其罕见,占所有垂体肿瘤的0.5%以下。最常见的是具有高泌乳素血症的泌乳素腺瘤,其次是伴有库欣病的促肾上腺皮质激素腺瘤。在发生转移前,无法根据组织学特征将垂体癌和典型腺瘤进行区分,因此,诊断仅基于转移的存在。
4. 侵袭性垂体腺瘤
4.1 肿瘤浸润
WHO没有将浸润纳入病理分级和分类。原因包括以下几点:(1)可以通过神经影像学标准来评估浸润,神经外科医生手术中注意到的浸润证据或组织浸润的组织病理学证据可能是有争议和不准确的。(2)病理学者往往得不到从神经影像学研究中获得的相关浸润数据或外科医生的手术印象。虽然WHO并没有将肿瘤浸润纳入垂体腺瘤分类中,但是WHO分类强调,浸润应被认为是鉴定临床侵袭性腺瘤的重要预后特征。
4.2 定义
侵袭性腺瘤定义:大的快速增长的肿瘤、早期复发的肿瘤(尽管手术全部切除)及抗常规治疗的肿瘤,区别于具有良性临床过程的典型腺瘤。海绵窦或斜坡的浸润是区分临床侵袭性和非侵袭性腺瘤的具有统计学意义的参数。肿瘤增殖(有丝分裂计数和Ki-67指数)和肿瘤浸润被证明与肿瘤更具侵袭性的临床行为相关。病理医生可在最终诊断中提示有丝 核分裂计数/ Ki-67指数和软组织及骨骼的浸润。
4.3. 特殊亚型
新分类指出,具有侵袭性的腺瘤包括:稀疏颗粒型生长激素腺瘤、多激素PIT-1阳性腺瘤、静止性促肾上腺皮质激素腺瘤和 Crooke细胞腺瘤。此外,男性的泌乳素腺瘤往往具有侵袭性。应提醒临床医生和外科医生这些特定的诊断。表4总结了垂体神经内分泌肿瘤如何根据其临床行为来分类。
表4 复发概率各异的垂体神经内分泌肿瘤
复发率低 | 复发率高 | 恶性肿瘤 |
垂体腺瘤 | 具有高增殖活性的腺瘤 | 垂体癌 |
| 腺瘤的特殊亚型: |
|
| 稀疏颗粒型生长激素细胞腺瘤 |
|
| 男性泌乳素细胞腺瘤 |
|
| 静止性促肾上腺皮质激素细胞腺瘤 |
|
| Crooke细胞腺瘤 |
|
| 多激素PIT-1阳性腺瘤 |
|
5.垂体非神经内分泌肿瘤分类的变化
垂体的非神经内分泌肿瘤比垂体腺瘤更罕见,包括垂体细胞瘤,神经垂体的颗粒细瘤,梭形细胞嗜酸细胞瘤,和非常罕见的鞍区室管膜瘤(图5)。该类肿瘤显示出相同的免疫组织化学特征,即甲状腺转录因子-1(TTF-1)弥漫核阳性,类似于垂体细胞TTF-1的表达方式。此外,这类肿瘤的超微结构形态显示与正常垂体细胞变体相似。目前的推测是,垂体非神经内分泌肿瘤可能代表了同一组织学疾病实体系列,起源于垂体细胞谱系的特殊形态变体。
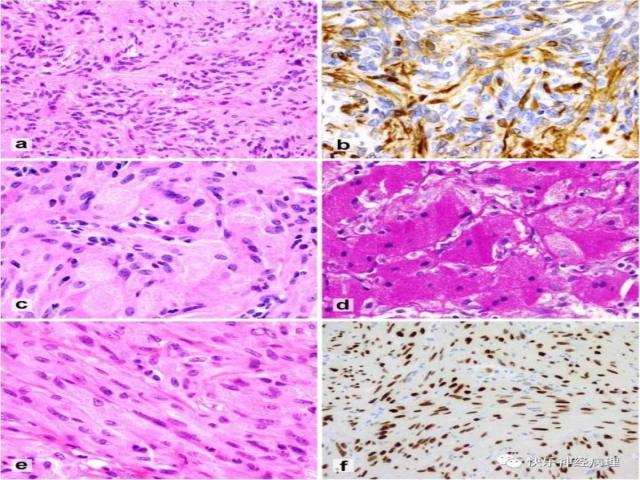
图5 垂体后叶肿瘤
a,b 垂体细胞瘤:核细长的双极纤维细胞呈短束状排列(a);GFAP阳性(b)。c,d 神经垂体颗粒细胞瘤通常由具有颗粒细胞质的大多边形细胞组成(c);PAS染色强阳性(d)。e,f 梭形细胞嗜酸细胞瘤具有各种细胞形态和排列方式,从束状的梭形细胞到巢状的上皮样细胞(e);起源于垂体细胞的所有垂体后叶肿瘤对甲状腺转录因子TTF-1呈核强阳性表达(f),例如在梭形细胞嗜酸细胞瘤中所示(与e图为同一病例)。
6. 新的实体和类别
2017年新分类中新实体是垂体母细胞瘤,一种罕见的垂体腺原始恶性肿瘤。主要发生在24个月以下的婴儿(中位年龄8个月),女性略占优势。患者常有库欣病的症状和体征。肿瘤由具有类似于未成熟Rathke上皮的菊形团样结构的腺上皮、类似胚体的小而原始的细胞和类似于腺垂体细胞的较大分泌性上皮细胞组成(图6)。肿瘤细胞表达神经内分泌标志物,大多数肿瘤表达ACTH;在细胞亚群中表达GH的少数病例已有报道。肿瘤增殖指数不稳定,Ki-67指数高低不等,尚未建立Ki-67指数与预后之间的相关性。垂体母细胞瘤是DICER1基因杂合子种系突变引起的DICER1综合征或胸膜肺母细胞瘤(PPB)-家族性肿瘤和发育不良综合征的一部分。
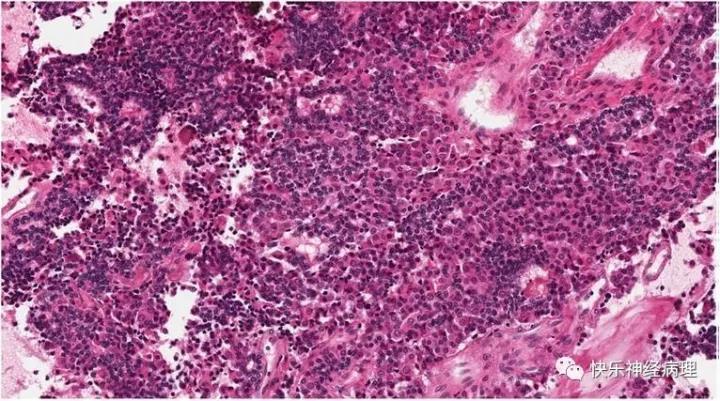
图6 垂体母细胞瘤
三种主要组成成分:类似于未成熟Rathke上皮的菊形团样结构的腺上皮、类似胚状体的小而原始的细胞以及大的嗜碱性分泌性上皮细胞。
新分类中强调的一类肿瘤是神经元和副神经元肿瘤,包括神经节细胞瘤和混合性神经节细胞瘤-腺瘤、神经细胞瘤、神经母细胞瘤和鞍区的副神经节瘤,所有这些都是罕见的肿瘤,但它们在垂体肿瘤的鉴别诊断中特别重要。鞍区神经节瘤可以作为家族性神经节瘤综合征的一部分。
新分类还明确了颅咽管瘤的两种变体(造釉细胞型颅咽管瘤和乳头状颅咽管瘤),两者均具有独特分子学特征。新分类强调,在垂体腺和鞍区肿瘤的鉴别诊断中,其它肿瘤包括:脑膜瘤、孤立性纤维性肿瘤/血管外皮细胞瘤、斜坡脊索瘤、骨和软组织肿瘤、生殖细胞肿瘤、造血系统肿瘤的瘤和继发性(转移性)肿瘤。
7. 垂体腺瘤分子诊断
垂体腺瘤属于不具有特定分子特征的一类肿瘤,尽管对肿瘤抑制基因、致癌基因和可能在垂体腺瘤肿瘤发生中起作用的表观遗传学现象进行了长达几十年的调查,但是肿瘤形成和肿瘤进展中涉及的遗传机制尚不完全了解。大多数垂体腺瘤是散发性肿瘤,只有少部分是遗传性或家族性综合征的一部分。分别在大约40%的散发性生长激素腺瘤和30-60%的散发性促肾上腺皮质激素腺瘤中发现GNAS(鸟嘌呤核苷酸结合蛋白G亚基α)基因和USP8(泛素特异性蛋白酶8)基因的体细胞突变。这些突变在其他垂体腺瘤亚型中很少发现。
与垂体腺瘤发展相关的遗传性综合征包括:(1)多发性内分泌肿瘤(MEN)综合征MEN1和MEN4;(2)Carney’s复合体;(3)McCune-Albright综合征; (4)家族性孤立性垂体腺瘤(FIPA)综合征; (5)与GPR101微复制相关的X性连锁肢端肥大症(XLAG);(6)与琥珀酸脱氢酶(SDH)基因相关的遗传性嗜铬细胞瘤和副神经节瘤综合征。
明确可能的综合征或家族性相关肿瘤的临床和病理学基础,可能有助于患者家族成员筛查出易发生垂体肿瘤的无症状个体,便于进行早期诊断和治疗。
8. 新分类的陷阱
免疫组化作为垂体神经内分泌肿瘤分类的主要辅助诊断工具,垂体激素、垂体转录因子的免疫组化染色以及其他的免疫标记物(例如细胞角蛋白)是新分类的基础。
在大多数垂体腺瘤中,垂体激素免疫组化是诊断的主要依据,无需转录因子免疫染色。然而,在垂体激素免疫染色呈弱阳性、可疑或完全阴性的情况下,转录因子的分析对于确定垂体细胞谱系分化至关重要。工作中使用的主要转录因子是PIT-1和SF-1,尚没有可靠T-PIT商业抗体可用。在实施这些新指南之前,应谨慎选择抗体,特别是针对新的转录因子的抗体。
9.结论
总之,2017年WHO垂体肿瘤分类,对垂体神经内分泌肿瘤、垂体和鞍区其他少见肿瘤的诊断提供了全面的指导。垂体腺瘤是垂体最常见的神经内分泌肿瘤,免疫组化作为主要的辅助诊断工具,根据特异性细胞谱系分化进行分类,必要时仅对罕见肿瘤进行超微结构分析。确定潜在侵袭性腺瘤,应通过参考组织病理学、有丝分裂指数、Ki-67标记指数和肿瘤侵袭单独进行。此外,识别具有高复发风险和不良临床行为的腺瘤势在必行。在鞍区肿瘤的鉴别诊断中应考虑诸多其他肿瘤实体,包括表达甲状腺转录因子TTF-1的垂体非神经内分泌肿瘤、罕见的神经元肿瘤和间叶源性肿瘤。






















共0条评论