[导读] 2016年,Shi Wei在《Arch Pathol Lab Med》发表文章:Papillary Lesions of the Breast: An Update,对乳腺乳头状病变的诊断、分类以及新近的一些分子遗传学进展进行了归纳总结,现将该文章编译如下,不当之处恳请批评指正,希望对大家有所帮助,同时对原文作者致以诚挚谢意:
▌编译:山东省诸城市妇幼保健院病理科 王巍伟
点击下载英文版文献
乳腺乳头状病变的临床表现、组织学特征以及生物学潜能各不相同,该病变具有一个较为广泛的肿瘤谱系。这一类病变中,典型的形态学特征为有分支状纤维血管轴心支持的上皮性增生。虽然偶尔可见乳腺浸润性癌伴显著乳头状结构,但乳腺乳头状病变特指发生于导管内的肿瘤。乳腺导管内病变包括导管内乳头状瘤、乳头状瘤伴非典型导管增生(ADH)、乳头状瘤伴导管内原位癌(DCIS)以及导管内乳头状癌。虽然包裹性乳头状癌和实性乳头状癌的最终分类仍然存在争议且未达成共识,但是出于分期以及治疗的目的,通常认为这两种病变为导管内乳头状癌的亚型。
良性导管内乳头状病变的特征是纤维血管分支中存在单层肌上皮细胞,而恶性病变乳头中缺乏完整肌上皮细胞层。虽然乳头状病变的组织学诊断通常没有任何挑战,但前述病变之鉴别诊断并非总是那么简单。这些病变除了在诊断方面存在一定困难,并且不同的研究者提出了不同的专业术语,同时对某一特定病变也提出了不同的诊断标准。
2016年,Shi Wei在《Arch Pathol Lab Med》发表文章:Papillary Lesions of the Breast: An Update,对乳腺乳头状病变的诊断、分类以及新近的一些分子遗传学进展进行了归纳总结,现将该文章编译如下,不当之处恳请批评指正,希望对大家有所帮助,同时对原文作者致以诚挚谢意:
一、导管内乳头状瘤
导管内乳头状瘤的特征为增生性、分支状纤维血管轴心被覆双层细胞,外层为导管上皮细胞,内层为肌上皮细胞。根据不同的临床表现和病理学特征,导管内乳头状瘤可以分为中央型乳头状瘤(大导管乳头状瘤)和外周型乳头状瘤(小导管乳头状瘤)。
大多数乳头状瘤为中央型。该肿瘤年龄分布较广,但大多数发生于30-50岁。中央型乳头状瘤起源于大导管(例如:段导管以及下一级导管)并且常为实性生长。临床通常表现为浆液性或浆血液性乳头渗出液,少见情况下表现为可触及的肿块。中央型乳头状瘤影像学检查,乳腺X线摄影通常表现为乳晕下、扩张导管内实性肿物,乳腺导管照影术则表现为管腔充盈缺损或导管扩张,乳腺超声检查表现为界限清楚的低回声结节或内壁光滑的囊性病变伴实性成分。大体检查,中央型乳头状瘤通常表现为囊性扩张的导管腔隙内明显、界限清楚的结节。虽然该肿瘤更常表现为圆凸状或疣状,但在较大的病变中才有可能意识到其乳头状结构。
与之不同,周围型乳头状瘤起源于终末导管小叶单位,因此临床上通常较为隐蔽,偶尔由于核磁共振成像发现乳腺钙化或扫描增强肿物而被发现。周围型乳头状瘤同样也是主要发生于中年妇女。与中央型乳头状瘤相比,外周型乳头状瘤在大体上通常不易被发现。
组织学上,两种类型导管内乳头状瘤的纤维血管分支通常均较宽,即使一些区域可以看到较细的乳头。中间肌上皮细胞层始终位于乳头状结构中。高倍镜下,肌上皮细胞通常较明显,但是罕见情况下可能会不太明显,此时需要进行肌上皮标记的免疫组化染色明确,例如: p63、平滑肌肌球蛋白重链(SMMHC)、高分子量角蛋白(CK5/6、CK14、CK903/34βE12)(图1,A-D)。
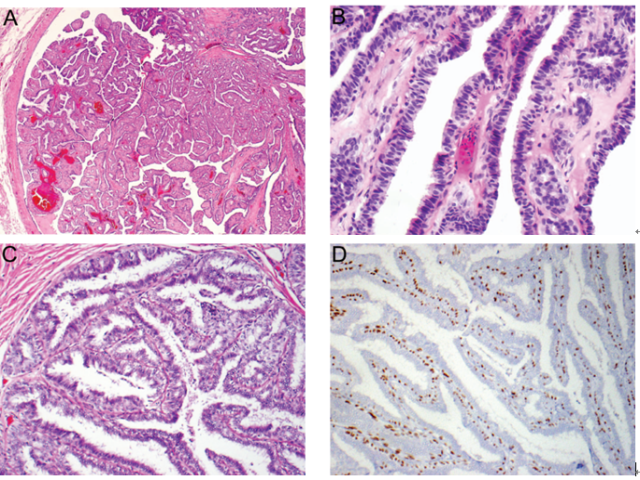
图1 导管内乳头状瘤。(A)纤维血管轴心分支通常较宽,伴有不同程度的间质纤维化;(B)乳头状结构被覆外层腔上皮细胞和内层肌上皮细胞两层;(C)一些区域可见较细乳头,可能导致与导管内乳头状癌混淆;(D)C图中含有肌上皮细胞的乳头p63免疫组化染色突显了肌上皮细胞的存在。
腔上皮成分由单层柱状或立方细胞组成。然而,经常可以看到不同程度的上皮增生,有时候增生过度使得病变中的乳头特征变得模糊不清,致使其与导管内乳头状癌的鉴别出现一定困难。导管上皮的过度增生往往表现为合体细胞样或流水样结构,伴二级裂隙样腔隙或普通型导管增生中的窗孔样结构。导管上皮过度增生也可以存在广基性微乳头。增生性上皮细胞通常具有异质性,可以发生重叠或呈不规则分布,细胞边界不清,细胞核大小不一,常见核沟,可见核内假包涵体(图2,A和B)。如果存在疑虑,可以通过CK5/6免疫组化染色再次证实导管上皮增生的良性属性,其通常呈散在(斑片状)或“马赛克”样着色,这与同类恶性肿瘤不同(CK5/6表达缺失)。p63免疫组化染色仅肌上皮细胞呈阳性,而导管上皮细胞呈阴性,因此,p63在评估纤维血管轴心的成分时最有帮助(图2,C和D)。偶尔可以出现肌上皮细胞增生(图2,E和F)。
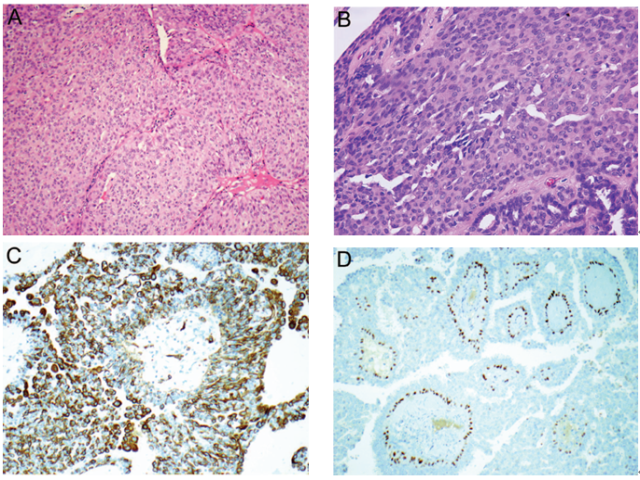
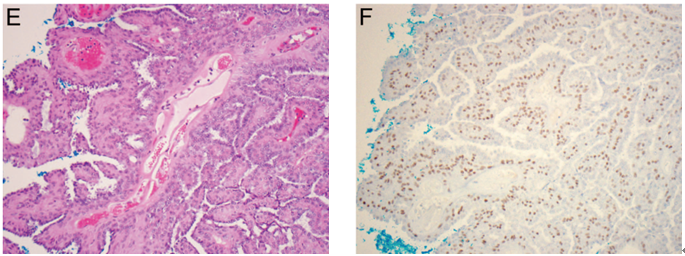
图2 导管内乳头状瘤伴上皮增生。(A)导管内乳头状瘤伴导管上皮过度增生;(B)高倍镜示,增生性上皮细胞发生重叠,异质性细胞形成二级管腔,常见核沟以及核内假包涵体(普通型导管增生常见);(C)增生性上皮细胞CK5/6免疫组化染色呈散在阳性;另外,基底层反应性肌上皮细胞也呈阳性;(D)p63免疫组化染色仅肌上皮细胞呈阳性,而导管上皮细胞呈阴性;(E)导管内乳头状瘤伴局部肌上皮细胞增生;(F)图E病变中p63免疫组化染色突显增生性肌上皮细胞。
导管内乳头状瘤经常可以见到局灶性大汗腺化生,但导管内乳头状癌中几乎不会存在,与其他一些特征一起有助于两种肿瘤的鉴别诊断(图3,A和B)。文献中所报道的其他一些特征性化生包括:鳞状化生、黏液性化生、透明细胞化生以及皮脂腺化生。胶原小球病可以累及乳头状瘤。增生性上皮细胞背景中出现的相关性管状结构可以形成窗孔样外观,类似伴有筛状结构的DCIS。管腔内嗜酸性(罕见情况下为嗜碱性)基底膜物质的识别对于避免误诊至关重要,其被平坦的肌上皮细胞包绕,与筛状型DCIS具有极性的柱状细胞截然不同(图3,C和D)。
乳头状瘤中罕见出血或梗死区域,特别是在较大的和中央型病变之中,为细针穿刺操作或纤维血管分支扭转所致(图3,E)。极罕见情况下,整个病变可以发生梗死。在没有残余存活组织的情况下,该肿瘤应该描述为“梗死性乳头状病变”。梗死区域更常见鳞状化生(图3,F)。
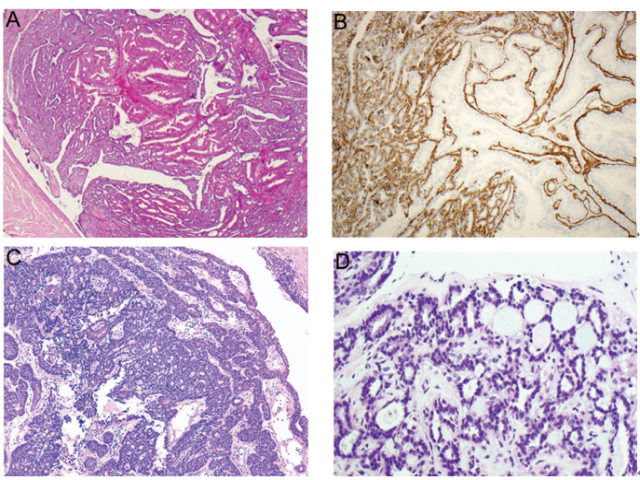
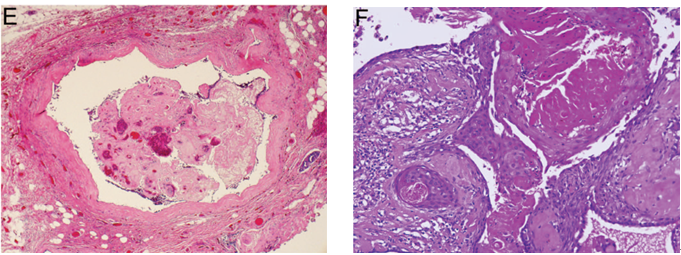
图3 导管内乳头状瘤的各种表现。(A)良性乳头状瘤中常见局灶性大汗腺化生,但是恶性乳头状病变中几乎总是缺失;(B)增生性上皮细胞伴大汗腺化生CK5/6呈阴性,因此不要与导管内乳头状癌相混淆;(C)胶原小球病累及乳头状瘤,低倍镜下与筛状型DCIS极其相似;(D)高倍镜示,胶原小球病中的导管结构内含有腺腔基底膜物质,被平坦的肌上皮细胞包绕;(E)乳头状瘤伴梗死;(F)乳头状瘤伴鳞状化生
乳头状瘤的另外一种常见表现就是出现不同程度的间质纤维化,特别是时间较长的病变。纤维化/硬化偶尔可以非常广泛,以至于使得潜在性乳头状结构消失。这些病变被称之为“硬化性导管内乳头状瘤”(图4,A-C)。值得注意的是,在这些病变中更常见微小钙化灶。硬化性乳头状瘤临床上表现为可触及的、固定于皮肤的肿物,X线影像学表现为放射状、不规则性异常,因此与浸润性癌极其相似。同样,广泛的硬化性和玻璃样变性间质背景中可以出现腺体结构的挤压和扭曲,其在组织学上可以产生假浸润,与癌相似,特别是在粗针穿刺活检样本中。这种情况下,通常至少可以在常规HE染色切片中一些内陷、呈不规则形状的上皮性成分中发现一些肌上皮细胞。如果存在疑问,肌上皮标记的免疫组化染色可以用于识别连续的肌上皮细胞并且解除这种疑虑。
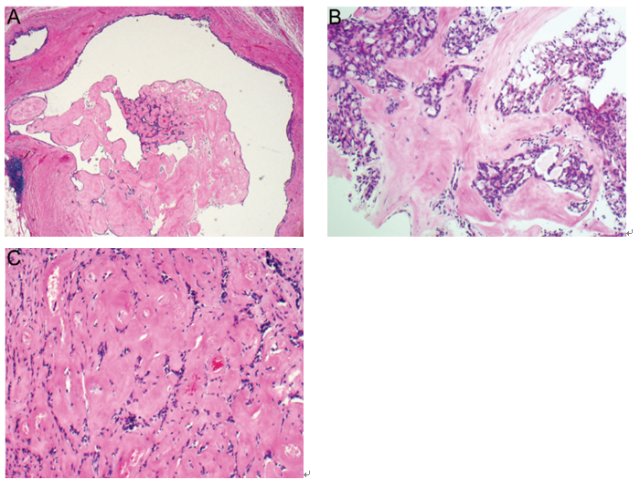
图4 硬化性导管内乳头状瘤。(A)显著的硬化性乳头伴少量上皮性成分;(B)乳头状瘤伴广泛性间质纤维化区域,使得潜在性乳头状结构变的模糊不清;(C)显著硬化导致腺体结构广泛性挤压和扭曲,因此产生了与浸润性癌类似的假浸润。
二、乳头状瘤伴ADH /DCIS
一些导管内乳头状瘤中,乳头状病变背景之外可见非典型导管上皮增生区域(符合ADH或DCIS诊断标准),其在周围型乳头状瘤较为多见(与中央型乳头状瘤相比)。这些病变分别称之为“乳头状瘤伴ADH”和“乳头状瘤伴DCIS”。非典型特征包括肿瘤细胞小、规则、分布均匀,细胞核呈圆形、形态单一(与ADH和低级别DCIS中的肿瘤细胞相似),组织结构类型复杂(例如:实性、筛状或微乳头状)(图5,A-C)。这些细胞灶几乎没有或无肌上皮细胞,不表达高分子量细胞角蛋白,雌激素受体(ER)和孕激素受体(PR)呈强阳性。其中存在一个陷阱就是,伴鳞状分化的恶性肿瘤细胞对CK5/6往往会有较强的免疫反应性;因此,在这种情况下,p63是一种更好的免疫标记(图5,D-F)。
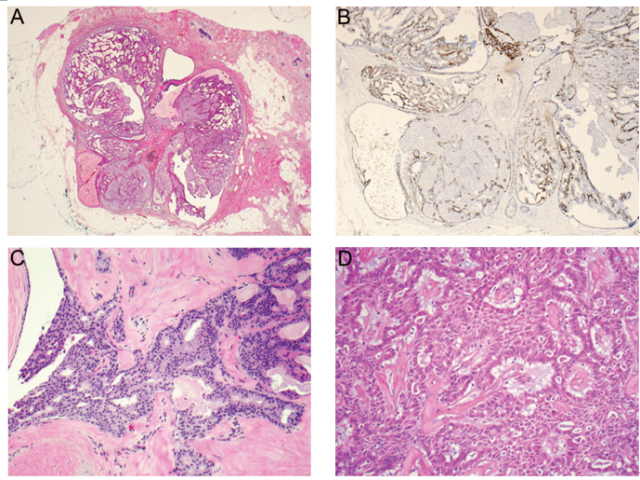
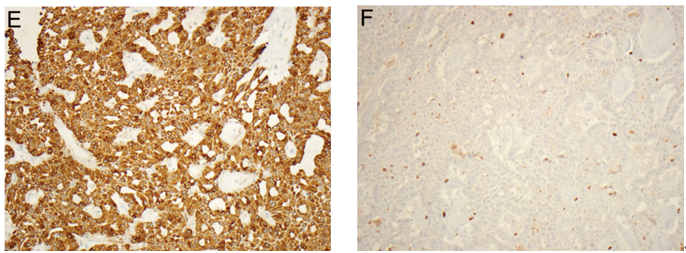
图5 乳头状瘤伴ADH/DCIS。(A)乳头状瘤伴部分区域细胞的单型性增生;(B)A图所示病变区域的CK5/6免疫组化染色,增生性细胞无“马赛克”样着色,因此将其称之为“乳头状瘤伴DCIS”(根据病变的范围/大小标准将其分类,该例病变区域大于3mm);(C)硬化性乳头状瘤伴ADH,局部细胞增生,细胞核小、圆、形态单一、均匀分布,与ADH和低级别DCIS中的肿瘤细胞相似;(D)乳头状伴DCIS,显示有显著的鳞状分化;(E)D图所示肿瘤细胞CK5/6免疫组化呈强阳性;(F)p63免疫组化染色突显D图所示病变中罕见的肌上皮细胞。
目前,关于乳头状瘤伴ADH和乳头状瘤伴DCIS之间的鉴别尚无广泛接受的标准。基于病变范围提出了3mm这一临界值,肿瘤伴非典型上皮增生区域≤3mm诊断为乳头状瘤伴ADH,而肿瘤伴非典型上皮增生区域>3mm则诊断为乳头状瘤伴DCIS。其他一些研究者基于非典型上皮增生的比例提出30%这一临界值,后来又修改为90%,因为当非典型区域不足病变1/3的肿瘤与非典型区域至少为1/3但又不足病变90%的肿瘤比较时,其临床生物学行为并没有发生任何变化。值得注意的是,没有任何一种乳头状病变发现有非典型病灶占肿瘤成分的65%-70%以上。世界卫生组织工作小组推荐在日常实际工作中使用基于范围/大小的诊断标准(而非比例标准)。重点需要强调的是,当非典型上皮增生为中级别或高级别细胞核时,应该将其诊断为“乳头状瘤伴DCIS”而无需顾忌量的多少,与无乳头状瘤的导管内增生性病变中鉴别ADH和DCIS的传统标准一样。此外,邻近乳腺组织中DCIS的存在尤其支持乳头状瘤伴DCIS的诊断。
乳头状瘤伴DCIS需要与导管内乳头状癌进行鉴别。一些研究者认为,导管内乳头状癌具有原发性原位恶性进展特征,因此在预测患者随后发生浸润性疾病的风险方面具有更大的意义。尽管如此,乳头状瘤伴DCIS 完全手术切除后,其预后仍然尚不明确,目前认为其与ADH等同。这与导管内乳头状癌形成对比,其一般与DCIS相似。据报道,多发性非典型乳头状瘤与随后发生浸润性癌的较高风险相关。
三、导管内乳头状癌
导管内乳头状癌,又称之为乳头状DCIS和非浸润性乳头状癌,表现为导管内肿瘤性增生性乳头状分支的肌上皮细胞完全或几乎完全缺失。临床表现为乳头溢液或可触及的肿块,这取决于病变部位和大小。
这些病变的影像学表现为导管内/囊内不规则肿块伴肿瘤内血液供应增加,或与其他DCIS亚型一样,表现为乳腺钙化。与良性乳头状瘤相比,导管内乳头状癌超声学检查表现为非平行方向、回声晕、后部回声增强以及伴微小钙化。对于恶性乳头状病变检查而言,任何一种超声学表现的敏感性和特异性分别为85.7%和64.9%。大体特征无明显区别。
组织学上,导管内乳头状癌的特征为大小不一、扩张的导管-小叶腔隙内充满纤细或呈分支状的乳头,具有纤维血管轴心,被覆多层肿瘤性柱状上皮细胞。与导管内乳头状瘤相比,乳头状癌的乳头通常较薄且易脱落,纤维性间质极少。乳头或增生性上皮内可以存在极少量肌上皮细胞,但是缺乏完整的肌上皮细胞层。正如其他DCIS形态学类型一样,所累及导管壁周围肌上皮细胞层仍然存在,因此明确了病变的原位特性。然而,一些伴有显著导管扩张的较大病变中,周围肌上皮可能不明显或不连续(图6,A)。据报道,多达1/4病例中恶性细胞会出现两种形态,而第二种形态细胞胞质透明,且通常位于基底部,因此可能与肌上皮细胞相混淆,从而会导致潜在性误诊(图6,B)。
肿瘤性上皮细胞增殖可以产生另外一些组织结构类型(例如:实性、筛状、微乳头),当这些组织结构广泛存在时,使得乳头间隙消失(图6,C)。病变的细胞学特征往往为低级别或中级别DCIS细胞特征,即使确实存在罕见的高级别病变。另外一种陷阱就是,当乳头状分支中血管内皮细胞与肿瘤性上皮细胞并列存在时,可能会将其误认为肌上皮细胞。当存在疑虑时,使用肌上皮标记免疫组化染色可以确定诊断(图6,D)。需要注意的是,一些肌上皮标记(例如:SMA、calponin)会与间质纤维母细胞、血管周细胞以及血管内皮细胞发生不同程度的交叉反应,因此在乳头状病变的鉴别诊断中用途极小。因此,这种情况下p63和高分子量角蛋白(CK5/6、CK14、34βE12/CK903)就成为证实肌上皮细胞存在与否的较好免疫标记。肿瘤性上皮细胞高分子量角蛋白呈阴性,且ER、PR均呈强阳性。
导管内乳头状癌的发病机制仍然存在争议。如前所述,一些研究者认为这些病变起初就为恶性乳头状上皮细胞增殖。另外一些研究者认为,其是先前存在的良性乳头状瘤的一种逐渐转化并取代的结果。
一些关于遗传学特征的研究显示,良性和恶性乳头状病变之间的分子学差异极少,并且受限于有限的样本。恶性乳头状病变中仅发现16q23基因位点的杂合性缺失,良性及恶性乳头状病变中均发现16p13和16q21基因位点的杂合性缺失。TP53位点的杂合性缺失与恶性乳头状病变显著相关。另外一项研究发现,与良性乳头状瘤相比,乳头状癌中PIN3CA、AKT1、NRAS基因启动位点的突变频率整体较低。因此,分子学特征多种多样,需要更深入的研究来描述这些乳头状病变的分子起源。
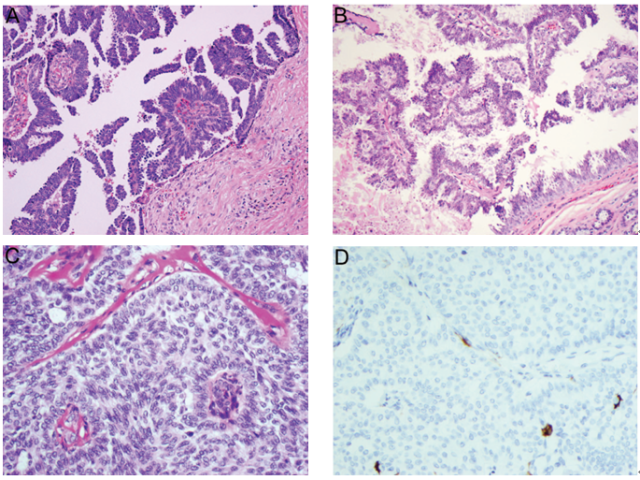
图6 导管内乳头状癌。(A)乳头通常较薄且易脱落,被覆多层肿瘤性柱状上皮细胞,无肌上皮细胞层;肌上皮细胞在受累导管壁周围仍然存在;(B)乳头中含有两种不同的细胞,其中一种细胞位于基底部,呈透明细胞特征,因此与肌上皮细胞相似;(C)肿瘤性上皮细胞增殖呈实性生长方式,使得乳头间隙消失;(D)乳头或上皮性增殖中,肌上皮细胞几乎缺失,示CK5/6免疫染色。
乳腺乳头状病变(二)
参考文献:
Wei S. Papillary Lesions of the Breast: An Update [J]. Arch Pathol Lab Med. 2016 Jul;140(7):628-643.
点击下载英文版文献






















共0条评论