[导读] 2016年,Shi Wei在《Arch Pathol Lab Med》发表文章:Papillary Lesions of the Breast: An Update,对乳腺乳头状病变的诊断、分类以及新近的一些分子遗传学进展进行了归纳总结,现将该文章编译如下,不当之处恳请批评指正,希望对大家有所帮助,同时对原文作者致以诚挚谢意:
▌编译:山东省诸城市妇幼保健院病理科 王巍伟
点击下载英文版文献
四、包裹性(囊内)乳头状癌(EPC)
包裹性乳头状癌在形态学上与导管内乳头状癌相似,但两者唯一不同的就是包裹性乳头状癌周围厚厚的纤维性囊壁中无肌上皮细胞存在。鉴于EPC呈孤立性结节状生长、无间质反应、惰性临床行为以及病变周围中-重度IV型胶原蛋白表达,大多数研究者传统上认为这种病变是DCIS的一种亚型。另外一些研究者对此提出了质疑,他们认为该肿瘤是浸润性癌伴膨胀性生长的一种惰性形式,因为周围肌上皮细胞缺失与当前原位癌这一概念相悖。EPC患者偶尔发现淋巴结和远处转移进一步支持上述后者观点。
EPC通常发生于年长患者,平均年龄65岁。乳腺X线影像学检查通常表现为乳晕下界限清楚的肿物,超声学检查表现为囊性病变伴实性成分。大体检查,通常表现为囊腔内界限清楚、易碎肿物,因此也称之为“囊内乳头状癌”。
组织学上,低倍镜下常清晰可见囊性扩张的导管腔内存在一个或多个界限清楚的结节状肿物,导管周围包绕厚厚的纤维性包膜(图7,A)。导管腔内充满细长、缺乏肌上皮细胞的纤维血管性乳头。乳头状分支被覆增殖性肿瘤上皮,其排列成各种不同结构类型(包括实性和筛状)。肿瘤细胞通常具有低级别或中级别细胞核,即使罕见情况下可以为高级别。肿瘤细胞ER、PR常呈强阳性。
常规HE染色以及免疫组化染色切片中,病变周围无肌上皮细胞层(图7,B)。病变周围有时候可能会存在梭形细胞,其细胞核特征与乳头状分支中的相似、而与肌上皮细胞不同(常表现为扁平、立方形或圆形细胞核)(图7,C和D)。罕见情况下,被覆细胞可以呈柱状细胞特征,含有核下空泡且表现为极性反转,因此与钢琴键盘极其相似。此外,这些被覆细胞的上皮/非肌上皮属性可以通过肌上皮标记免疫组化证实(图7,E和F)。
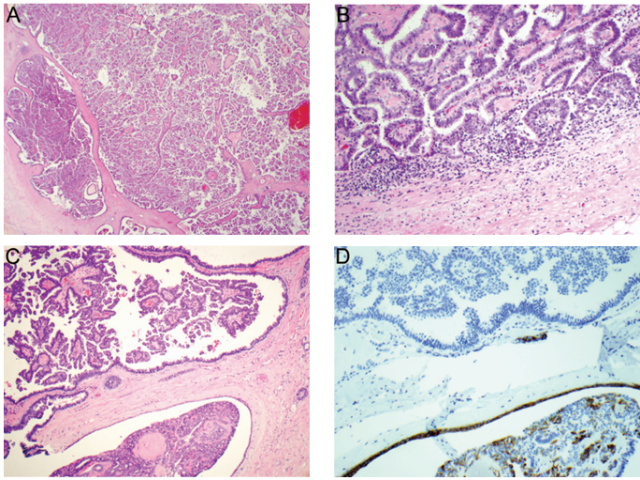
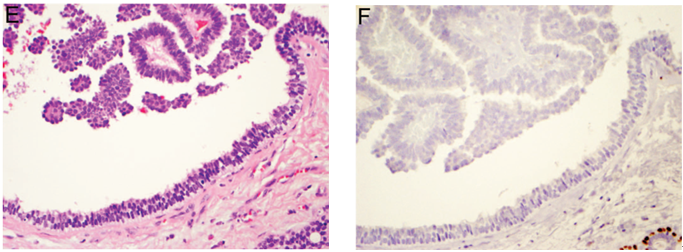
图7 包裹性乳头状癌。(A)该肿瘤常表现为囊性扩张导管腔内存在一个或多个界限清楚的结节性肿物;(B)肿瘤结节包绕一层厚厚的纤维性包膜,伴不同程度慢性炎症;(C)病变周围可以存在多层上皮细胞(与乳头状分支中相似),与周围良性乳头状瘤被覆的肌上皮细胞(常表现为扁平、立方形或圆形细胞核)不同;(D)CK5/6免疫组化染色证实C图包裹性乳头状癌周围肌上皮细胞缺失,而突显了附近乳头状瘤肌上皮细胞的阳性表达;(E)罕见情况下,包裹性乳头状癌周围被覆细胞可以呈钢琴键盘样外观(柱状细胞含有核下空泡且极性反转);(F)p63免疫组化染色证实了E图中被覆细胞的非肌上皮属性。
如果包裹性乳头状癌周围乳腺组织中无DCIS或传统型浸润性癌,那么单独局部适当治疗预后较好。据报道,如果EPC附近乳腺组织同时伴发DCIS,则患者局部复发的风险较高。然而,一小部分EPC可以直接伴发浸润性癌。浸润性成分常为非特殊类型,无乳头特征。鉴于有关该病变的分类存在一定争议,目前关于EPC的分期尚未达成一致。现在一般认可的是,在含有普通型浸润性癌的情况下,仅仅根据浸润性成分的大小对肿瘤进行分期,以此防止过度治疗。尽管罕见EPC发生转移,但普遍共识为:在明确没有浸润性癌的情况下,鉴于EPC的惰性临床过程以及良好预后,其应该按照DCIS进行分期和处理。
基于高分辨率基因芯片对同时伴发DCIS和浸润性癌的EPC进行比较基因组杂交分析显示,三种成分可以分为不同的群组,EPC具有最大数量的基因组拷贝数异常,接着为DCIS和浸润性癌。基于整体分子学改变,EPC更接近于DCIS(与浸润性癌相比)。由于这些研究中病例数量较少,需要其他更多的分子学分析进一步研究这些病变的特征。
五、实性乳头状癌
“实性乳头状癌”这一名称最初用来描述导管内乳头状癌的一种亚型(实性乳头状生长,呈低级别细胞学特征,经常伴有神经内分泌分化以及细胞内或细胞外黏液分泌)。影像学检查,肿瘤通常表现为界限清楚的肿物。大体检查,实性乳头状癌可以表现为肉质性、质韧或质软、界限清楚的结节性肿物,呈灰白色或黄褐色。该肿瘤大多数发生于老年女性,平均年龄70岁。
低倍镜下,实性乳头状癌特征性表现为多发性实性限制性结节,无筛状或离散性乳头状结构(图8,A)。然而,高倍镜下常见无肌上皮细胞层被覆、易碎的潜在性纤维血管间质网。密集的肿瘤细胞经常呈流水样外观,因此可能误诊为导管内乳头状瘤伴旺炽性导管增生。如果存在疑虑,高分子量角蛋白(CK5/6)免疫表达缺失具有诊断意义(图8,B和C)。罕见细胞内和/或细胞外黏液形成(图8,D)。增殖性肿瘤细胞通常较温和且具有黏附性,细胞核呈卵圆形或梭形,低-中级别(图8,E)。纤维血管轴心发生不同程度胶原化,周围肿瘤细胞呈栅栏状排列,形成血管周假菊形团。肿瘤细胞经常表现有神经内分泌特征,包括呈细颗粒状、嗜酸性细胞质和椒盐样细胞核(图8,F)。实际上,在至少一半病例中发现神经内分泌标记免疫反应活性具有不同的浓度和空间分布。可见核分裂象,但核分裂不活跃并且无非典型核分裂象。
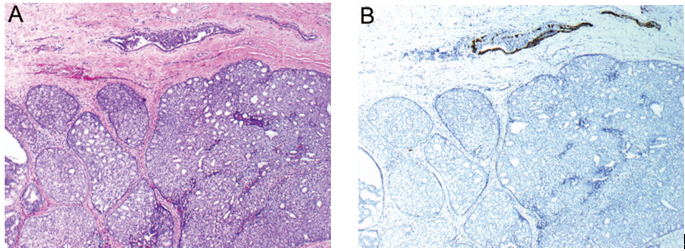

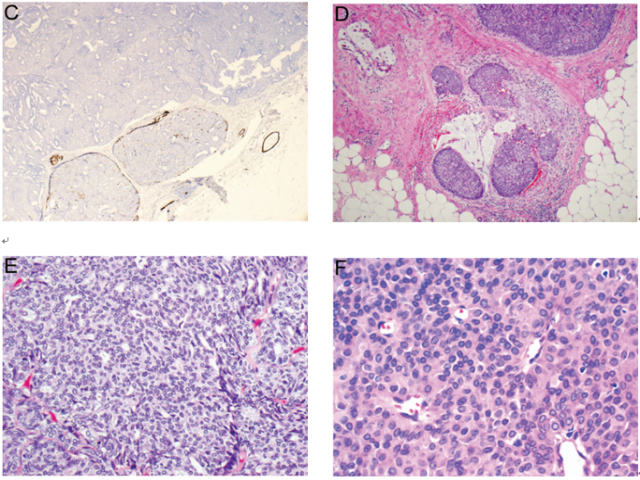
图8 实性乳头状癌。(A)低倍镜示,多发性、实性、限制性结节,无明显乳头状结构;(B)CK5/6免疫组化染色显示周围肌上皮缺失,附近正常导管肌上皮细胞呈阳性;(C)CK5/6免疫组化染色证实,一些肿瘤细胞巢周围可见完整的肌上皮细胞层;(D)实性乳头状癌中罕见黏液生成;(E)肿瘤细胞核常呈低-中级别、卵圆形或梭形;(F)肿瘤细胞常表现有神经内分泌特征,细胞质呈颗粒状、嗜酸性,细胞核呈椒盐样,在不同程度胶原化纤维血管轴心中形成血管周假菊形团。
过去,一些学者认为实性乳头状癌是DCIS的一个独特类型,因为界限清楚的肿瘤细胞巢提示其为非浸润性,并且许多病变周围显示有肌上皮细胞衬覆。然而,随后的免疫组化研究显示,实性肿瘤结节周围肌上皮细胞缺失(图8,B)。这就使人想起一种可能性,即这些病变可能为浸润性癌伴推挤性边缘和膨胀性生长,而非DCIS一种亚型,与包裹性乳头状癌相似。该病变一些肿瘤细胞巢周围可能有完整的肌上皮细胞层(图8,C),这使其变得更加复杂。因此,与包裹性乳头状癌相似,这些病变的准确分类仍然存在争议。尽管如此,由于该肿瘤缺乏普通型浸润性癌成分,故其表现为惰性临床过程(与DCIS相似),普遍认为这些病变在肿瘤分期中应该归为原位癌。该肿瘤罕见转移,但确有发生。
实性乳头状癌结节经常呈地理拼图样并且边缘不规整,因此提示为浸润。在一些病变中,这样的区域可能会混入普通型浸润性癌中(图9,A)。同时经常伴有的浸润性成分为黏液癌或伴内分泌特征的癌,即使也可见一些其他组织学类型的癌(图9,B)。此外,实性乳头状癌细胞ER、PR常呈强阳性表达,无HER2过表达/基因扩增。当同时存在浸润性癌时,其一般保留相同的受体表达谱。
罕见情况下,实性乳头状癌和包裹性乳头状癌可以组合而同时存在于一个肿瘤结节中,因此表现为一种肿瘤向另一肿瘤内生长(图10,A-C)。这种现象引发了一种非常有趣的可能性,即普通的癌变过程中发生了两种不同亚型的癌。
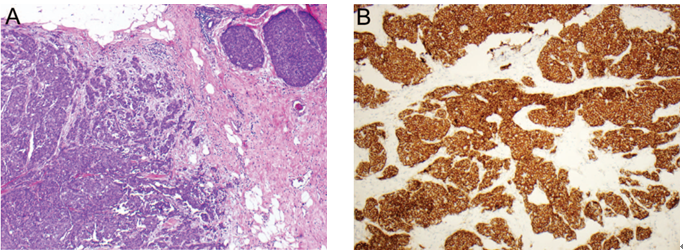
图9 实性乳头状癌伴浸润性癌。(A)实性乳头状癌结节伴浸润性癌(左下);(B)实性乳头状癌起源的浸润性癌成分Syn免疫组化染色显示其神经内分泌分化。
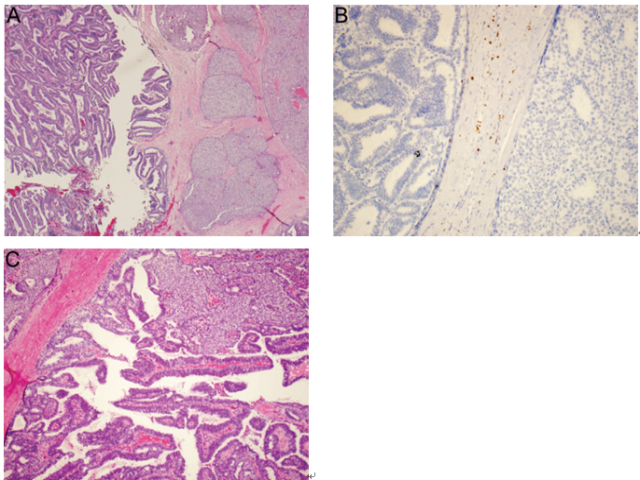
图10 混合性包裹性乳头状癌和实性乳头状癌。(A)低倍镜示,该肿瘤含有两种不同形态学特征的肿瘤成分(包裹性乳头状癌和实性乳头状癌);(B)CK5/6免疫组化染色显示两种肿瘤成分的乳头内以及周围无肌上皮成分;(C)两种肿瘤成分在同一肿瘤结节内混合存在,给人的感觉为一种肿瘤成分向另一肿瘤成分中生长。
鉴于对导管内乳头状病变分类存在一定挑战性,一些学者提出了这类病变的诊断演算方法,即首先确定肌上皮细胞存在与否及其分布,接着正确运用免疫组化方法确定上皮成分的属性特征。最近研究发现,当这种演算方法作为抗体鸡尾酒(包括高分子量细胞角蛋白、低分子量细胞角蛋白和p63)的辅助手段时具有较好的诊断实用性,特别是穿刺活检样本。
导管内乳头状病变重要的组织学和免疫表型特征总结如表1所示。
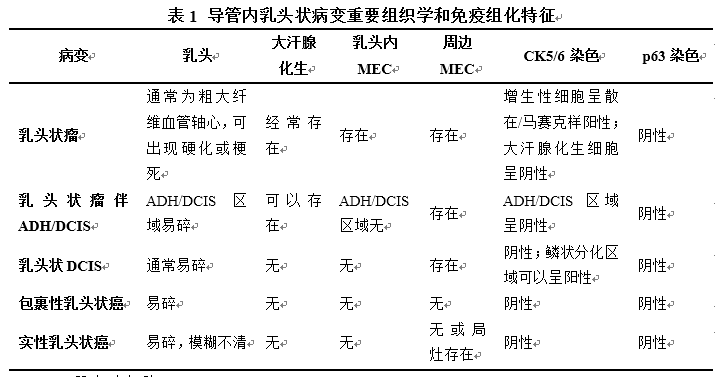
MEC:肌上皮细胞
六、浸润性乳头状癌
“浸润性乳头状癌”这一名称应该保留给浸润性腺癌伴特定乳头状形态(>90%)(图11,A和B)。单纯性浸润性乳头状癌相当罕见;据报道,其发病率约占所有浸润性乳腺癌的0.5%。然而,文献中的一些研究通常并没有明确区分原位乳头状癌和浸润性乳头状癌。由于该原因,这种罕见肿瘤类型的流行病学和临床特征尚未确定。影像学检查,无特殊特征。超声学检查,非浸润性乳头状癌和浸润性乳头状癌之间重要的不同点就是其限制性边缘。
应该注意的是,起源于包裹性乳头状癌或实性乳头状癌的浸润性非乳头状癌不应该归为浸润性乳头状癌。此外,浸润性微乳头状癌也不应该与浸润性乳头状癌相混淆。浸润性微乳头状癌是一种独立的特殊肿瘤类型,特征为无纤维血管轴心的黏附性肿瘤细胞簇或细胞巢,周围有空隙。这种亚型经常伴有淋巴血管浸润和淋巴结转移,因此预后不良。另外,应该时刻要考虑到其他解剖部位乳头状肿瘤的转移(特别是卵巢和肺)(图11,C和D)。
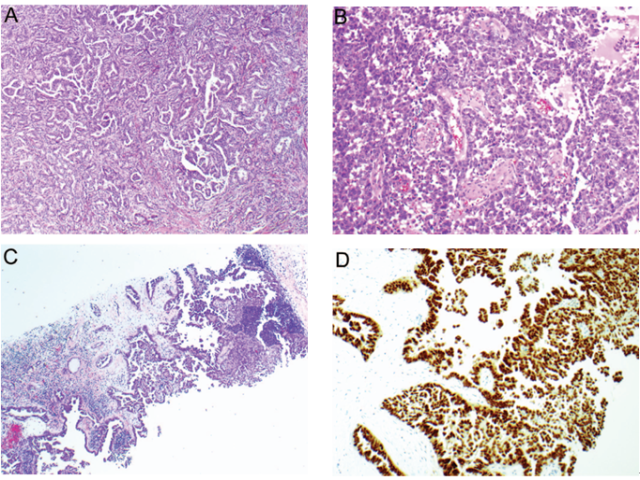
图11 浸润性乳头状癌和转移性乳头状癌。(A)示呈乳头状生长的浸润性肿瘤;(B)高倍镜示纤维血管轴心;(C)卵巢浆液性癌患者乳腺肿物粗针穿刺活检;(D)C图肿瘤PAX-8免疫组化染色呈阳性,提示为卵巢起源。
最近,基于基因芯片的比较基因组杂交分析显示,与级别和ER相匹配的非特殊型浸润性癌相比,乳头状癌这组病变显示有相似的基因拷贝数异常。此外,包裹性乳头状癌、实性乳头状癌以及浸润性乳头状癌的基因表达谱极其相似,因此最好认为乳头状癌是ER阳性乳腺癌系列的一部分,而非一种独特的病变。然而,有限的样本量以及不完整的随访信息使得乳头状癌不同亚型之间的比较变得富有探索性并且引发一些研究假说。
七、上皮移位:一种乳头状现象
上皮器械性移位可以发生于各种各样的穿刺操作后,包括粗针穿刺活检、细针抽吸、麻醉注射、手术缝合、以及定位穿刺。90%以上病例中,人工上皮移位的发生均与潜在性乳头状肿瘤(包括单纯性导管内乳头状瘤)相关,因为这些病变具有内在易碎属性。特别重要的是要知道其如何发生并且从组织形态学上认识它,因为移位上皮与浸润性癌非常相似,并且可以导致对良性病变或原位癌患者的误诊。
医源性上皮移位几乎总是发生于活检部位或针道,典型特征为乳腺间质人工腔隙内孤立性、小的上皮碎片。先前无浸润性乳腺癌病史而创伤性乳腺间质内出现上皮聚集时,这种情况应予以注意。这些上皮细胞簇通常伴有活检部位的一些改变,例如:组织出血、急慢性炎症、异物反应(即:泡沫样组织细胞、巨细胞、胆固醇裂隙)、脂肪坏死、含铁血黄素沉积、肉芽组织或瘢痕,这取决于从穿刺到外科操作之间的时间间隔(图12,A-C)。上皮簇中单独肌上皮细胞缺失并不足以诊断为浸润性癌,特别是乳头状病变。判读为明确浸润只能根据同时所发生的促结缔组织增生性间质反应,并且位于远离先前穿刺操作区域。位于活检针道外乳腺间质的上皮移位罕见,对其性质的判断更为困难。然而,移位上皮通常不会引起间质反应,这与真正的浸润不同。
淋巴管或血管腔也可以发生上皮移位;罕见情况下,最初的粗针穿刺活检组织中也可以出现移位上皮。在没有明确浸润性癌的情况下,我们应该极其小心的判读淋巴管血管腔隙内出现的上皮簇。当关注的焦点局限于活检部位时,鉴别诊断应该考虑到上皮移位。
此外,无真正性浸润性癌时,区域淋巴结内也可出现单个或小簇状上皮细胞,因此可能会引起更多的诊断困惑(图12,D)。假设乳腺组织损伤区域无论任何物质排入区域淋巴结都是组织愈合过程的组成部分,如:硅胶性淋巴结病变。此外,乳腺按摩女性进行区域淋巴结活检也可以发现淋巴结上皮移位。这些情况下,淋巴结内上皮细胞的细胞核特征可以提供良性或恶性起源的相关信息,因为恶性上皮细胞通常较大且具有多形性。淋巴结内含有恶性上皮细胞的病例中,相关反应性改变(例如:泡沫样巨噬细胞、含铁血黄素巨噬细胞、异物巨细胞反应)支持其为机械性操作所致的上皮移位而非真性转移。一些模棱两可的病例,在病理报告中添加注释性评论强调其不确定性比较合理,因为没有任何一种明确的方法可以确定淋巴结内出现的上皮细胞是通过转移而至还是机械性操作所致。
最后,所有部位内移位上皮的生物学命运仍然尚未明确。需要恰当的文献记载和长期临床随访来确定这种独特现象的临床意义。
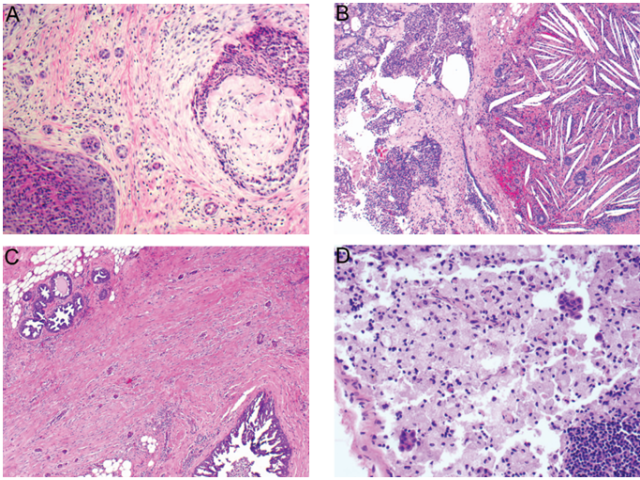
图12 上皮移位。(A)间质中导管内乳头状瘤来源移位上皮簇,针道伴肌纤维母细胞增生及慢性炎症;(B)一定区域内硬化性乳头状瘤来源移位上皮,伴出血、含铁血黄素沉着、慢性炎症、以及活检部位特征性胆固醇裂隙;(C)微小乳头状导管原位癌(DCIS)粗针穿刺活检后发生上皮移位,其局限于针道组织挫伤区域;(D),微小乳头状DCIS患者前哨淋巴结被膜下窦中的移位恶性上皮细胞,周围包绕大量泡沫样组织细胞。
八、总结
乳腺乳头状病变是一组异质性肿瘤,它们的很多形态学具有相似性。这组病变的临床和影像学特征可以发生重叠,但具有不同的临床结果。根据我们对这组病变最新进展的了解,其中一些病变需要进行重新分类。此外,需要更深入的研究来阐明这组病变的发病机制;更重要的是当前所使用的方法存在一定分歧,需要探索潜在性分类方法来对这些病变进行更好的分类。
乳腺乳头状病变(一)
参考文献:
Wei S. Papillary Lesions of the Breast: An Update [J]. Arch Pathol Lab Med. 2016 Jul;140(7):628-643.
点击下载英文版文献






















共0条评论