▌编译:山东省诸城市妇幼保健院病理科 王巍伟
内窥镜检查是一种诊断和治疗方法,随着其不断发展进步,我们在临床实际工作中也会遇到更多量的胃上皮性病变,这将给我们的日常工作带来更大的挑战性。首先,当我们遇到不常见的病变或组织学特征后就会毫无经验,并且很难做出诊断;其次,从异型增生至癌这一谱系中,疾病诊断本身就存在一定困难,尤其是那些需要使用活检标本来确诊的一些交界性病变更是难上加难。
2016年,韩国釜山国立大学Sangjeong Ahn等在《Arch Pathol Lab Med》发表了一篇综述性文章:Practical Points in Gastric Pathology,他们讨论了一些极富挑战性但又值得关注的胃部病变,并且分享了他们实际工作中的一些经验。同时,也回顾了当前的一些观点以及与此相关的一些未解决的问题,并且提出了从活检至内窥镜切除术这一逐步、有效的诊断途径,特别是关于那些交界性肿瘤或非肿瘤性病变的确诊。现将该篇综述性文献编译如下,不当之处恳请批评指正,希望对大家有所帮助,同时也对原文作者致以诚挚谢意。
一、胃上皮性病变中的一些新观念
1、胃癌前病变的定义及术语
胃上皮性病变从异型增生至癌这一谱系之中,同一观察者不同时间的判读结果以及不同观察者之间的判读结果存在一定的差异,这是一个长期存在的问题,尤其是东方和西方病理医师之间。特别是关于上述谱系所存在差异的争论也将持续存在。诊断及报告的国际标准是世界范围内许多研究之间进行比较的先决条件,最终应该形成统一的诊断和治疗指南。为达到这一目的,一些研究者试图减少这些差异并且改善其可重复性。然而,统一的指南仍荡然无存。此外,用来描述胃癌前病变的术语也不统一,一些组织机构或地理区域仍在使用“异型增生”而不是“上皮内瘤变”。
“异型增生”传统上是指存在明显、清晰的细胞学以及组织结构改变(特别是形态学)且无黏膜固有层浸润,而“上皮内瘤变”却意味着存在恶性潜能,不管是否存在形态学改变。西方病理医师认为腺瘤是一种不连续的突起性病变,而日本病理医师认为其还包括其他一些大体类型(例如:平坦和凹陷性病变)。大多数胃异型增生/上皮内瘤变可以分为一些组织学亚型,包括肠表型(腺瘤样)、胃表型(小凹和幽门腺型)以及小凹型异型增生。其中,低级别异型增生(LGD)和高级别异型增生(HGD)两级分类系统相对比较实用。
腺瘤样型是最常见的亚型,其与结肠腺瘤具有相同的组织学特征;小凹型次之,其与正常表面小凹上皮相似,特征为上皮细胞呈立方或低柱状,细胞核圆形、单层。伴有不规则腺体分支和上皮折叠的小凹增生区域常常无杯状细胞和Paneth细胞。从另一角度来讲,混合型会同时具有这两种亚型的形态学特征。这两种形态学亚型具有不同的免疫组化表型,腺瘤样型表达MUC2、CD10以及DCX2,小凹型表达MUC5AC。细胞核呈假复层排列可以作为异型性较轻的腺瘤样型的诊断标准,而假复层这一标准在小凹型中并不适用,因为其为单层排列。其他支持LGD的诊断标准包括轻度拥挤、单纯性小管、核浆比(N/C)增加且黏液枯竭、细胞核重叠以及核深染伴不明显核仁。HGD的组织学特征包括:腺体呈重度背靠背拥挤伴轻度腺体分支、N/C较高、细胞核呈立方形或圆形(而不是柱状并且伸长)、核仁明显。虽然存在一定争议,但是认为筛状结构、分支以及管腔内坏死性碎屑的出现已经超出了上述异型增生的范围,提示为黏膜内癌。如前所述,在小凹型中区分LGD和HGD存在一定困难。全层黏膜异型是小凹型异型增生的典型特征,其可以将该病变与再生性异型进行区分,而支持HGD的组织学特征包括:(1)细胞核大小为小成熟淋巴细胞3-4倍;(2)核仁数量增加;(3)嗜酸性胞浆增多;(4)腺体结构拥挤至不规则。
2、幽门腺腺瘤伴恶性转化
幽门腺腺瘤(PGA)是胃型腺瘤的一种亚型,其是最近才注意到的一种具有不同特征的病变。幽门腺腺瘤罕见,仅占非综合征患者的2.7%;与之相反,家族性腺瘤性息肉和Lynch综合征患者发病率较高,分别为6%(4/66)和20%(3/15)。散发性和家族性腺瘤性息肉相关性PGA多发生于老年女性,且多位于胃底部黏膜,而Lynch综合征相关性PGA与之不同,常见于年轻男性。显微镜下观察,这些病变由排列紧密的小管组成,偶尔伴有小管扩张,被覆单层立方至低柱状上皮细胞,细胞核呈圆形、位于基底部,胞浆淡染至嗜酸性,无顶端黏液性小帽。此外,自身免疫性(化生性)萎缩性胃炎背景中经常可以见到PGA,这很可能与所观察到的女性占主导优势有关。异型性改变(不规则至复杂性腺体)及细胞核非典型性是经常发生的事件,占PGA患者的52.6%(LGD:2/19;HGD:8/19),发生恶性转化病例的比率从15.9%(3/19)至45.8%(22/48)不等。形态学提示为癌的特征包括腺管融合或腺体呈横向膨胀性生长;然而,从细胞形态学角度区分PGA中的HGD和癌可能非常困难。PGA具有独特的MUC6和MUC5AC免疫组化表达模式,MUC6在整个病变中均呈弥漫、强阳性表达,而MUC5AC仅为表面上皮的低表达(或有时表达缺失)。PGA同样也具有诸多的染色体异常,与通常所报道的胃腺癌相似。散发性PGA显示有一些染色体的异常,包括17pq和20q的获得以及4q、5q和6q的缺失,同时伴有GNAS(48%,11/23)和KRAS(41%,9/23)的频发性突变。从另一方面来说,Lynch综合征相关性PGA受各种各样DNA错配修复基因突变的影响,最终导致错配修复蛋白表达。由于其具有高度的恶性转化潜能,临床医师和病理医师应该注意这一特殊病变。
图1示PGA向黏膜内癌的转化过程。大体上,PGA表现为胃底部黏膜的息肉状病变。显微镜下观察,PGA表现为小至中等大小的腺体,偶尔呈囊性扩张,细胞核呈圆形、位于基底部(图1,A和C)。一些区域具有高级别特征,N/C显著增加、核仁明显、可见呈背靠背和复杂的腺体(图1,D和E),同时伴有可疑的间质浸润(例如:腺体呈横向膨胀性生长以及腺管融合)(图1,F)。免疫组化示特征性表达方式(图1,B)。更有趣的是,癌性转化与MUC6(幽门腺黏蛋白标记,Novocastra Laboratories,Newcastle,United Kingdom)部分表达缺失相关,而MUC5AC(小凹黏蛋白标记,Novocastra Laboratories)表达却增加(图1,B,插图),基于MUC5AC表达与高级别形态学之间的这种关系,其对高级别形态学的鉴别可能会有所帮助。这一实例表明,胃腺癌起源于伴有HGD的PGA。
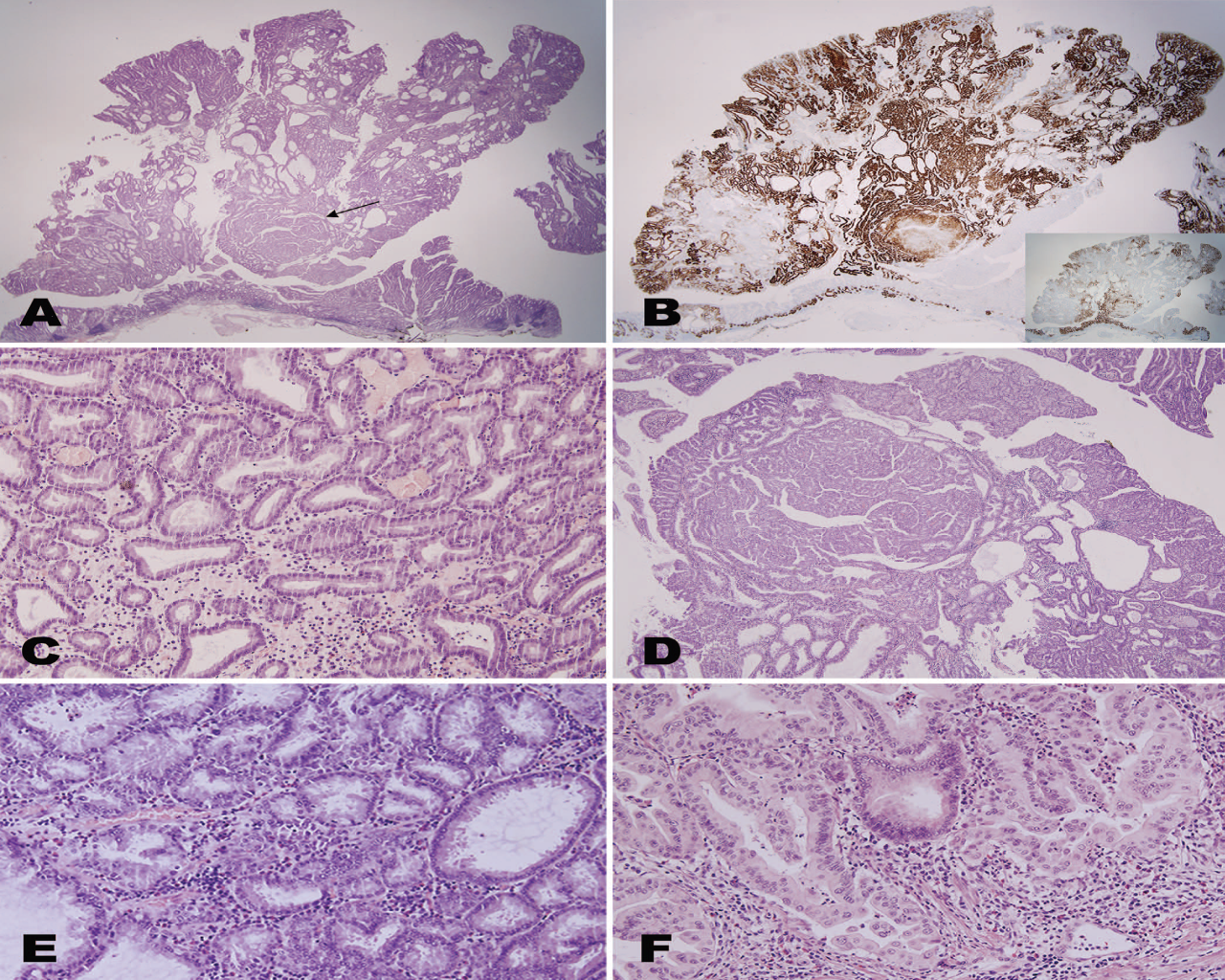 图1 A,幽门腺腺瘤伴癌性转化(箭头所示)低倍图像;B,MUC6呈弥漫阳性表达(MUC5AC在表面及癌变区域呈阳性表达[插图]);C,幽门腺腺瘤伴低级别异型增生和高级别异型增生(D,E)、间质浸润(F)。
图1 A,幽门腺腺瘤伴癌性转化(箭头所示)低倍图像;B,MUC6呈弥漫阳性表达(MUC5AC在表面及癌变区域呈阳性表达[插图]);C,幽门腺腺瘤伴低级别异型增生和高级别异型增生(D,E)、间质浸润(F)。
3、胃腺癌伴微乳头状癌成分
微乳头状癌(MPC)具有不同的形态学特征,表现为清晰的间隙中漂浮的缺乏纤维血管轴心的小巢状肿瘤细胞。自第一例胃部微乳头状癌确诊以来,随后研究表明,伴有MPC成分的胃癌(GC)具有侵袭性生物学行为,会经常发生淋巴管浸润、广泛淋巴结转移,患者整体生存率较低。发生于其他器官的MPC与之相似。此外有报道显示,具有MPC成分的GC患者预后较差,特别是那些早期GC患者,与结肠癌和肺癌相似。然而,MPC成分在胃部并不常见, GC中所报道的比例通常为1%至6%不等(1.5%,14/930、17/1178、32/2036;6.1%,72/1171),即使前面的一项研究高达13.4%(23/172)。GC伴MPC成分的比例为5%-90%。然而,MPC成分的范围(或多少)似乎并不影响患者的整体生存率,因为即使具有较低比例MPC成分(小于5%)的患者同样也具有不良预后。MPC成分通常存在于肠型和乳头状或管状腺癌亚型。免疫组织化学,MPC成分上皮膜抗原(亦称MUC1)呈典型的“里面朝外模式(inside-out pattern)”,而其他黏蛋白标记(MUC5AC、MUC6、MUC2和CD10)均呈胃表型。由于MPC成分与患者不良预后相关,因此外科病理学报告中应该特别注意发生于GC中的MPC成分,即使其范围非常小(5%)。
4、胃腺癌伴透明细胞样改变
肿瘤透明细胞样改变是由于胞浆内糖原、黏液、脂质、和/或水分的积聚所致。虽然这种改变在许多其他器官有所描述,但是GC伴透明细胞样改变尚无充分研究,关于这一问题也仅有少量的文献报道。表达α-甲胎蛋白(AFP)且伴有内生芽殖型分化的GC通常会表现为胞浆透明。然而,GC伴透明细胞样改变并非总是与表达AFP的GC相关,约14.5%(9/62)透明细胞型GC呈AFP阳性。据报道,透明细胞样改变可以发生于74%(17/23)表达AFP以及36%(36/101)表达glypican-3的GC。最近,我们的大样本研究显示,透明细胞样改变可以发生于8.5%(65/762)的GC,这些患者均具有不良预后。此外,在我们这一研究人群中,GC伴透明细胞样改变与年龄较小、胃窦部位置以及侵袭性增加相关,当与无这种改变的GC比较时,显示其为一个独立的预后因素。免疫组织化学,由于糖原沉积而导致透明细胞样改变的GC表达AFP、glypican-3、和/或CD10,而由于黏蛋白沉积而导致透明细胞样改变的GC通常表达MUC5AC和/或MUC6。另外,所有类型伴有透明细胞样改变的GC中,hepatocyte nuclear factor-1β阳性免疫组化表达也有所增加。
图2示肿瘤复杂的管状和小梁状形态结构,肿瘤细胞呈多边形,胞浆界限清晰。整个肿瘤中超过90%的细胞呈显著透明细胞样改变(图2,A)。免疫组织化学染色,肿瘤细胞AFP(Dako, Carpinteria, California)和glypican-3(Cell Marque, San Francisco, California)呈阳性表达(图2,D和E)。联合使用过碘酸-Schiff-淀粉酶(periodic acid-Schiff-diastase)染色和过碘酸-Schiff(periodic acid-Schiff,PAS)染色能够清晰显示透明胞浆内沉积的糖原(图2,B和C)。
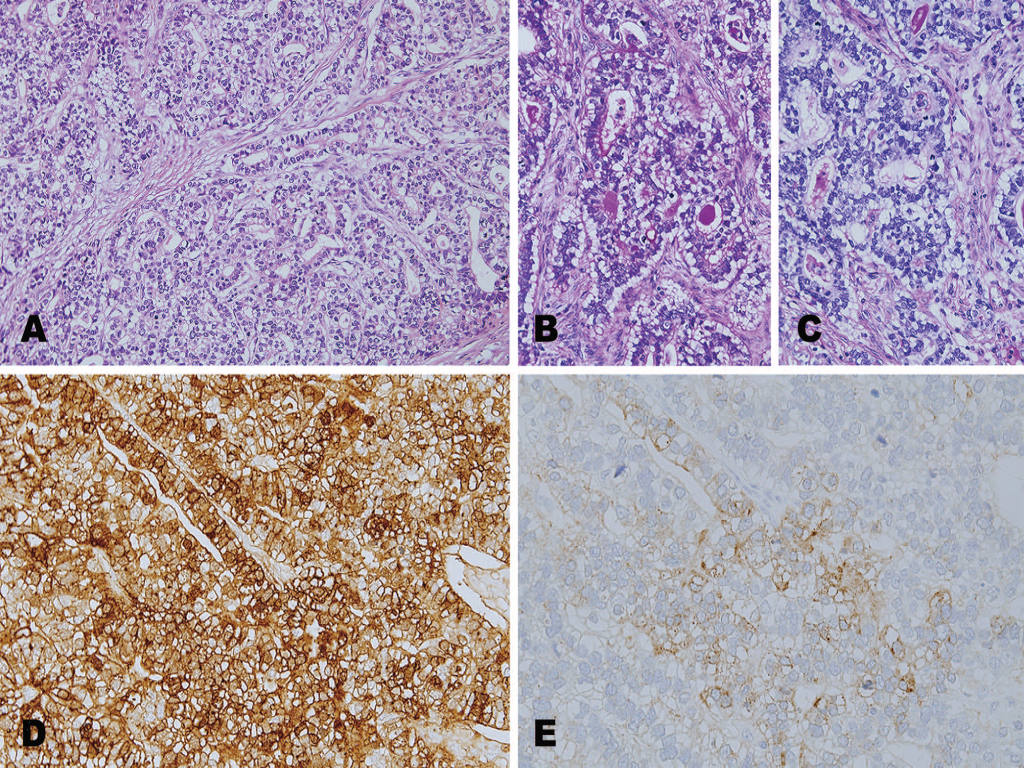 图2 A,组织学示显著的透明胞浆。联合过碘酸-Schiff(PAS)染色(B)和PAS-淀粉酶染色(C)显示糖原沉积。D和E分别为AFP和glypican-3的免疫组化表达情况。
图2 A,组织学示显著的透明胞浆。联合过碘酸-Schiff(PAS)染色(B)和PAS-淀粉酶染色(C)显示糖原沉积。D和E分别为AFP和glypican-3的免疫组化表达情况。
— 未完待续 —
参考文献:
Sangjeong Ahn, Do Youn Park. Practical Points in Gastric Pathology. Arch Pathol Lab Med, 2016 , 140(5):397-405. (点击可直接下载英文版附件)















共0条评论