[导读] 编译整理:强子
导管原位癌:临床-病理联系要点(一)
导管原位癌:临床-病理联系要点(二)
DCIS的切缘评估
目前,美国外科肿瘤学会(SSO)、美国放射肿瘤学会(ASTRO)、美国临床肿瘤学会(ASCO)相关共识性意见及最近发布的早期乳腺癌St. Gallen国际专家共识中都建议对切缘进行评估。具体详述如下。
1.切缘阳性
大量证据表明,切缘阳性(墨染处具有DCIS)是肿瘤复发的独立危险因素。对于这类患者,放疗可以降低复发风险,但不会使得该风险完全消失。因此,切缘阳性时提示应二次手术。
2.切缘距离≥2mm
术后进行全乳放疗的DCIS患者如切缘距离≥2mm,则同侧复发风险显著降低;切缘距离更大(如>5mm、>10mm)并不会进一步降低复发风险。
3.切缘距离0-1.9mm
对于术后进行全乳放疗的患者来说,仅更近的切缘(0-1.9mm)这一项指标并不意味着必须二次手术,需结合其他指标综合考虑,如患者年龄、其余乳腺有无异常、DCIS范围、肿瘤级别。实际最近有证据表明在辅助放疗的情况下,切缘距离0-1mm与切缘距离≥2mm患者的复发风险近似。但如不进行辅助放疗,则切缘较近的患者复发风险显著升高,因此对这部分患者应考虑进行二次手术。
需要指出的是,切缘阴性并不意味着绝对没有DCIS残余,因为DCIS病灶之间存在未受累的组织这一点,早已广为人知。此外,二次手术标本中癌残余的比例与切缘距离呈反比。这些也进一步说明放疗还是有必要的。
4.DCIS切除标本的处理
毫无疑问,保乳手术标本的准确、恰当处理对于切缘评估至关重要。X线的应用可以确保对病变范围、是否多灶、切缘状态等进行完整评估。大部分实验室日常工作中都是通过不同颜色对切缘进行分别标记。
理想状态下,应在标本切下来后立即进行定位和涂墨标记,因为切除后的处理过程可能会对外科医师做好的切缘标记有影响。如应用X线检查,相应过程也会对标本有所挤压,可导致深部切缘的距离人为变窄。此外,病理医师根据标准的两条线标记进行定位,也有很大比例的病例定位并不准确。不过,就切缘阳性率以及二次手术后病变残余率来说,病理医师对切缘的识别及涂墨似乎要优于外科医师。
所有切缘均应进行组织学评估;因此楔形切缘法可以在一个切片中评估更多的切缘,但这一做法无法区分阴性切缘的具体数据(如0-1mm vs. ≥2mm)。最常应用的还是垂直切缘评估。
5.切缘的镜下判读
应对每一处切缘与DCIS的距离进行评估,并记录至毫米;实际工作中镜下通过标尺,可以记录至0.1mm。理想状态下,切缘应是平滑、且均匀墨染并有烧灼现象。镜下判读时需注意不要将裂隙等判读为切缘,即使这样的区域有墨染及烧灼现象,也大部分并非真正的切缘。
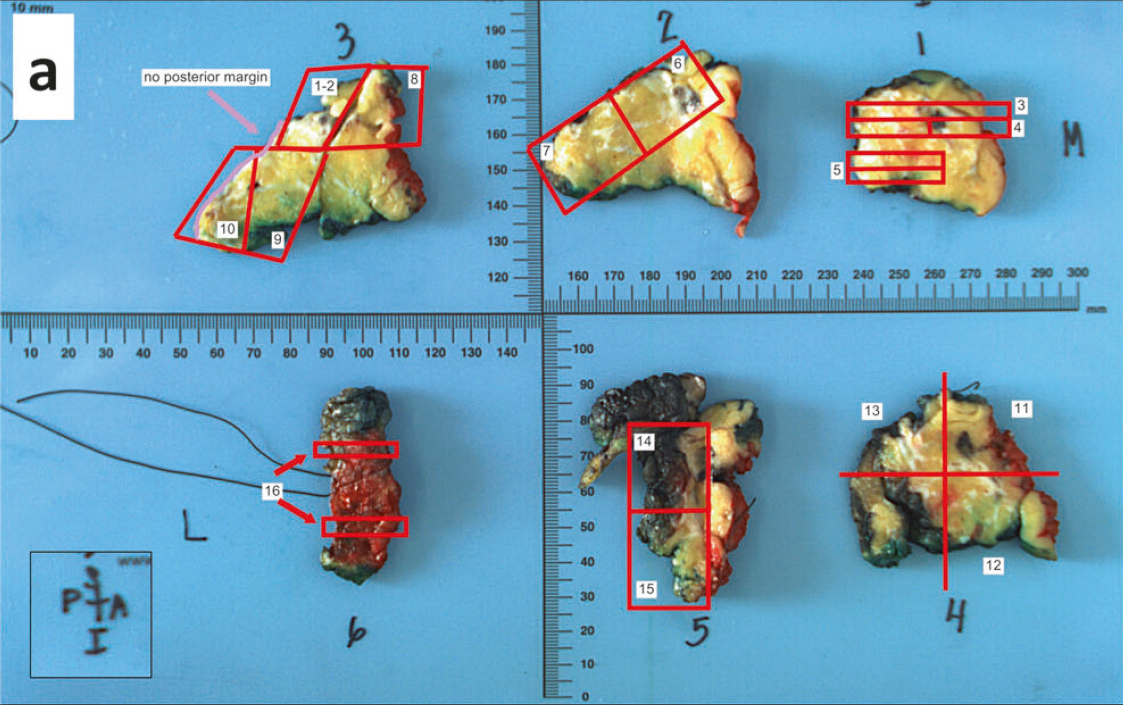 图2. DCIS切缘的评估。切片应与大体准确对应,这样才可以准确评估切缘。尽量在一张切片上可以看到全部切缘,如需多张切片进行评估,则应对切片中不是切缘的部分进行标记说明。
图2. DCIS切缘的评估。切片应与大体准确对应,这样才可以准确评估切缘。尽量在一张切片上可以看到全部切缘,如需多张切片进行评估,则应对切片中不是切缘的部分进行标记说明。
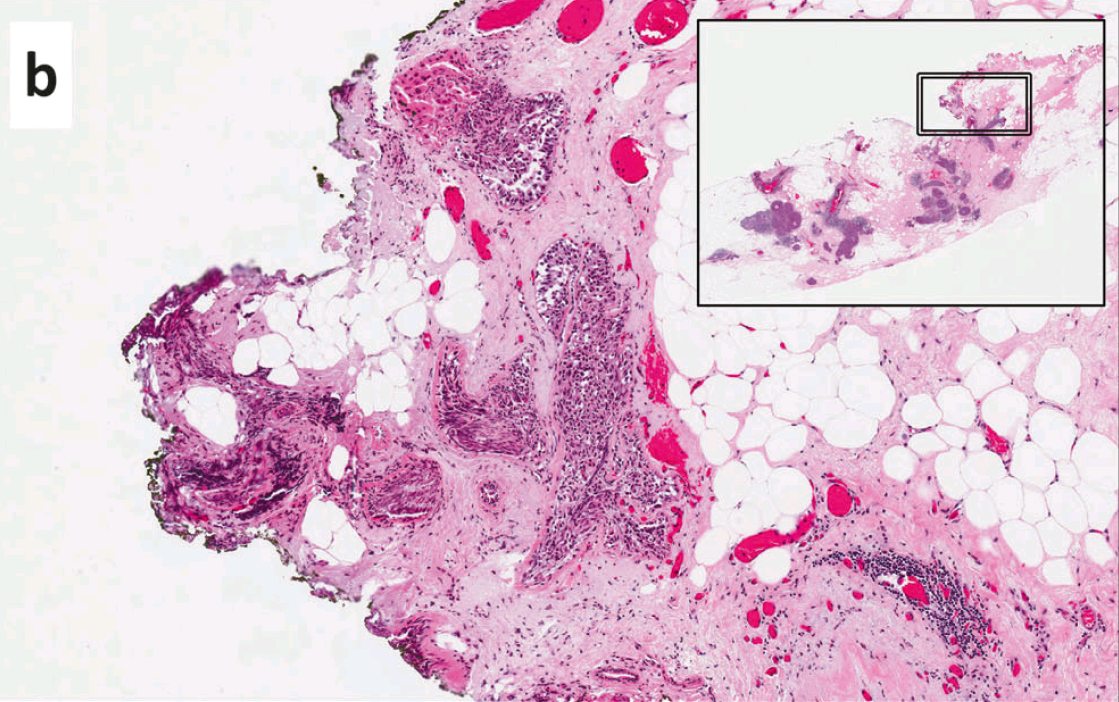 图3. 切缘阳性,即墨染切缘处有DCIS。
图3. 切缘阳性,即墨染切缘处有DCIS。
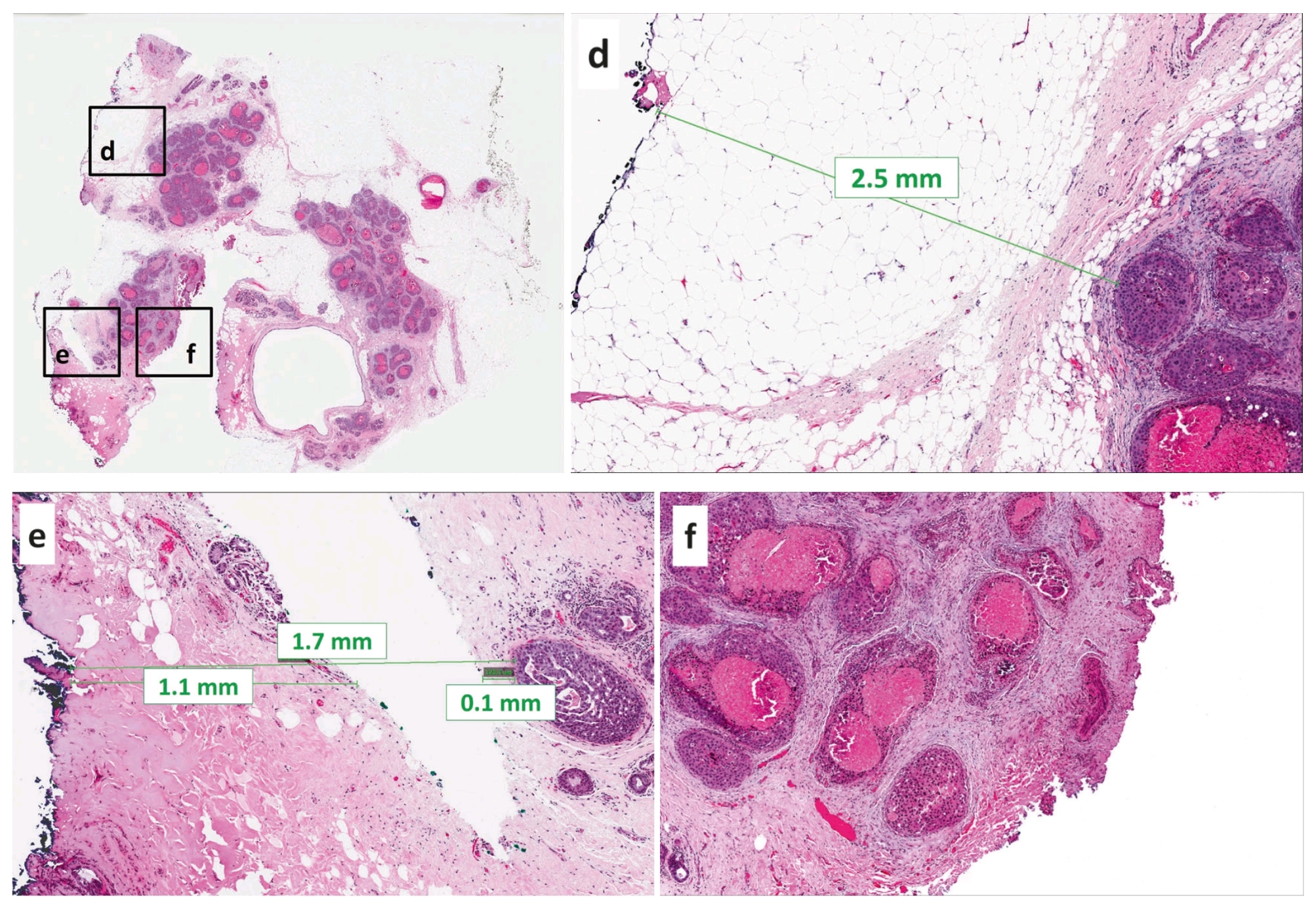 图4. 真正的切缘必须有墨染,且如果医生使用电刀、还会有烧灼现象,且切缘的轮廓一般较光滑。手术医师切开或取材过程中导致的组织裂隙,不要误判为切缘。如该图中d处,这是真正的切缘阴性,DCIS与切缘的距离≥2mm;图中e处则为人工假象,此时切缘距离的判读时应注意减去相应距离,因此该例中切缘距离应为1.1+0.1=1.2mm,而不是1.7mm;图中f处也不是真正的切缘,而是外科医师手术过程中造成的。
图4. 真正的切缘必须有墨染,且如果医生使用电刀、还会有烧灼现象,且切缘的轮廓一般较光滑。手术医师切开或取材过程中导致的组织裂隙,不要误判为切缘。如该图中d处,这是真正的切缘阴性,DCIS与切缘的距离≥2mm;图中e处则为人工假象,此时切缘距离的判读时应注意减去相应距离,因此该例中切缘距离应为1.1+0.1=1.2mm,而不是1.7mm;图中f处也不是真正的切缘,而是外科医师手术过程中造成的。
6.切缘的病理报告
目前,CAP要求对DCIS的切缘按照如下方式报告:
(A)切缘可见DCIS,并列出具体的阳性切缘。受累切缘的范围也可以报告,因为这与二次手术中残余病变的几率有关。具体报告方式有两种,一种是将阳性切缘分为局灶性(阳性切缘的长度1mm)、微小性(阳性切缘的长度1-15mm)、广泛性(阳性切缘的长度≥15mm);另一种局灶性切缘阳性的定义是指仅一张切片中有单灶阳性,微小性切缘阳性是指2-4张切片阳性、或阳性区域占1个低倍视野,中等程度切缘阳性是指5-7张切片阳性或2-4个低倍视野阳性,广泛切缘阳性是指≥8张切片阳性或阳性区域>4个低倍视野。
(B)切缘未见DCIS,并注明距离DCIS最近的切缘及切缘与DCIS的距离。其他阴性切缘的距离并不强制要求。切缘与DCIS的距离报告方式可以精确至毫米,也可用大于多少、或少于多少来报告,推荐应用前者;如用后者,则应用2mm作为阈值来报告。
DCIS标本中的前哨淋巴结取材
根据相关研究及非正式共识,美国临床肿瘤学会建议对乳腺切除的DCIS患者进行前哨淋巴结活检。术前诊断DCIS的某些病例切除后会诊断为浸润性癌,此外即使术后诊断也是DCIS、同样也有部分患者前哨淋巴结内有转移癌成分,这可能是病理评估未能检出浸润性癌成分所致。这种情况下的前哨淋巴结转移多为微转移(micrometastase)及孤立性肿瘤细胞(isolated tumor cell),但也有宏转移(macrometastase)的病例。
保乳手术者一般不建议进行前哨淋巴结活检,因为这类患者即使最终病理结果提示需进一步做前哨淋巴结活检,也是比较容易的。具体是否需进行前哨淋巴结活检,还需结合DCIS范围、是否有肿物形成、活检中细胞核的级别等进行考虑。
未完待续
点击下载英文文献
参考文献
Hanna WM,Parra-Herran C,Lu FI,et al.Ductal carcinoma in situ of the breast: an update for the pathologist in the era of individualized risk assessment and tailored therapies[J].Modern pathology,2019.
DOI:10.1038/s41379-019-0204-1





 图2. DCIS切缘的评估。切片应与大体准确对应,这样才可以准确评估切缘。尽量在一张切片上可以看到全部切缘,如需多张切片进行评估,则应对切片中不是切缘的部分进行标记说明。
图2. DCIS切缘的评估。切片应与大体准确对应,这样才可以准确评估切缘。尽量在一张切片上可以看到全部切缘,如需多张切片进行评估,则应对切片中不是切缘的部分进行标记说明。 图3. 切缘阳性,即墨染切缘处有DCIS。
图3. 切缘阳性,即墨染切缘处有DCIS。 图4. 真正的切缘必须有墨染,且如果医生使用电刀、还会有烧灼现象,且切缘的轮廓一般较光滑。手术医师切开或取材过程中导致的组织裂隙,不要误判为切缘。如该图中d处,这是真正的切缘阴性,DCIS与切缘的距离≥2mm;图中e处则为人工假象,此时切缘距离的判读时应注意减去相应距离,因此该例中切缘距离应为1.1+0.1=1.2mm,而不是1.7mm;图中f处也不是真正的切缘,而是外科医师手术过程中造成的。
图4. 真正的切缘必须有墨染,且如果医生使用电刀、还会有烧灼现象,且切缘的轮廓一般较光滑。手术医师切开或取材过程中导致的组织裂隙,不要误判为切缘。如该图中d处,这是真正的切缘阴性,DCIS与切缘的距离≥2mm;图中e处则为人工假象,此时切缘距离的判读时应注意减去相应距离,因此该例中切缘距离应为1.1+0.1=1.2mm,而不是1.7mm;图中f处也不是真正的切缘,而是外科医师手术过程中造成的。







共0条评论