[导读] 编译整理:张仁亚,王强
戈谢病
戈谢病(Gaucher disease)是一种常染色体隐性遗传的溶酶体贮积症,可累及肝脏、脾脏、骨髓及中枢神经系统等多个器官。临床表现包括肝脾肿大、骨髓浸润、凝血功能障碍、骨病、骨骼畸形,罕见情况下可伴神经系统受累。该病由GBA基因突变导致溶酶体葡萄糖脑苷脂(GBA)酶活性缺陷引起,致使单核吞噬细胞系统细胞内糖鞘脂异常贮积。
戈谢病累及肝脏的程度不一,从轻微结构异常、散在灶性细胞受累、直至肝实质被广泛取代、进展性纤维化及肝硬化等均可出现。组织学标志是存在戈谢细胞:增大的巨噬细胞,细胞核偏位或居中,胞质丰富,内有条纹状葡萄糖脑苷脂沉积,形似皱褶的绵纸。该特征可能并不明显,因为戈谢细胞可能稀疏分布。一般来说,这些细胞在肝小叶3区更为丰富,在门脉及门脉周围区域则较少见。三色染色和PAS染色有助于突出戈谢细胞胞质内特征性的条纹状结构,其中也可能含有少量铁沉积。由于增大的戈谢细胞挤压,因此肝细胞可出现萎缩或退行性变。常见窦周纤维化。肝硬化或肝实质被戈谢细胞广泛取代则通常仅见于重症病例。
尼曼-匹克病
尼曼-匹克病(Niemann-Pick disease)是一组遗传性溶酶体贮积病,根据基因突变和临床表现又可进一步分为A、B、C三种类型。A型和B型是编码酸性鞘磷脂酶的SMPD1基因突变所致:此酶可水解鞘磷脂,其缺乏会导致鞘磷脂在溶酶体内积累。A型和B型的区分则在于发病年龄和疾病表现:前者发生于婴儿期,表现为快速进展的神经退行性疾病;后者是一种慢性、进行性的内脏疾病,伴有肝脾肿大,可进展为肝硬化及肺部病变。B型也可表现为急性肝功能衰竭。C型者为NPC1基因突变,少见情况下为NPC2基因突变,导致细胞内胆固醇及脂质运输障碍,因此胆固醇和脂质在内吞体和溶酶体中积累。
尼曼-匹克病累及肝脏的组织学标志是存在泡沫细胞,主要为吞噬了脂质的增大巨噬细胞。这些细胞胞质丰富、微泡状,细胞核偏位或居中,主要分布于汇管区和肝窦内。肝细胞和胆管上皮也可有进行性的脂质蓄积,从而形成与泡沫状巨噬细胞无法区分的泡沫样表现。
图11的B、C为一例5岁的肥胖女孩,因持续数日的发热和咳嗽就诊。临床检查可见肝脾肿大,肝脏相关的酶轻度升高。影像学检查为双肺下叶肺炎。为评估脂肪性肝病、贮积性疾病、感染的情况,行肝脏活检。组织学可见肝细胞增大,散在体积增大的组织细胞,胞质丰富、泡沫状。无脂肪变性。这些巨噬细胞因其更肿胀、更苍白的外观而易于区分,且PAS染色中可轻易识别出来。电子显微镜下,胞质内可见溶酶体样结构,部分具有板层状内部构型以及膜包绕的、电子密度不等的退变性脂质颗粒。这些结果符合脂质或溶酶体贮积性疾病。后续溶酶体酶筛查发现鞘磷脂酶活性降低。遗传学检测在SMPD1基因查见两个致病性编译,证实为B型尼曼-匹克病的诊断。
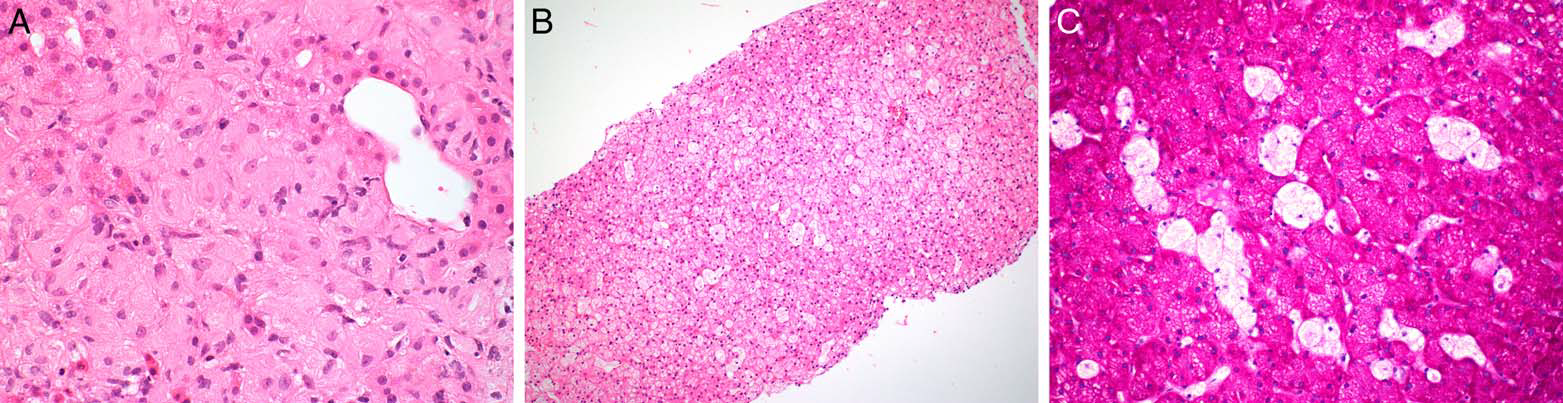 图11.(A)戈谢病中呈皱纹纸样表现的戈谢细胞。(B、C)尼曼-匹克病可见增大的肝细胞、散在巨噬细胞,后者胞质丰富、泡沫状,其胞质肿胀、淡染,PAS染色中更容易识别。
图11.(A)戈谢病中呈皱纹纸样表现的戈谢细胞。(B、C)尼曼-匹克病可见增大的肝细胞、散在巨噬细胞,后者胞质丰富、泡沫状,其胞质肿胀、淡染,PAS染色中更容易识别。
维生素A过多症(星状细胞增生)
维生素A主要以视黄酯的方式储存于肝脏星状细胞中(hepatic stellate cells,HSC;也称为Ito细胞,或窦周储脂肪细胞)。无论是药物、补充剂、还是膳食来源(如鱼油或鱼肝),过量摄入维生素A均可导致其过量而引起肝脏星状细胞的增生与肥大。活化的肝脏星状细胞可能会呈现肌纤维母细胞样表现,具体为合成平滑肌肌动蛋白和细胞外基质成分为,并启动肝脏纤维化进程。维生素A过量的病例中,也有报道称会募集炎症细胞从而导致肝细胞损伤。
维生素A中毒所致的肝损伤已明确是有剂量依赖性和时间依赖性的。其临床表现多样,从仅有肝脏酶谱持续升高的无症状病例、到非肝硬化性门静脉高压、乃至明确的肝硬化都可能出现。已有因慢性维生素A过量导致肝硬化而需接受肝移植的病例记录。
维生素A过量相关肝损伤的诊断可能具有挑战性,尤其临床过量摄入相关病史不明确的情况下。其特征性组织学改变是位于肝窦周隙(Disse间隙)的肝脏星状细胞增生与肥大。受累的肝脏星状细胞异常增大,胞质内充满丰富的脂质空泡,细胞核被挤压至周边,形态类似脂肪细胞。这些改变在活检组织中的分布可呈局灶性或弥漫性。此外,还可能伴有轻度汇管区或小叶内炎症、散在凋亡小体、肝窦扩张、不同程度的纤维化以及结节性再生性增生。
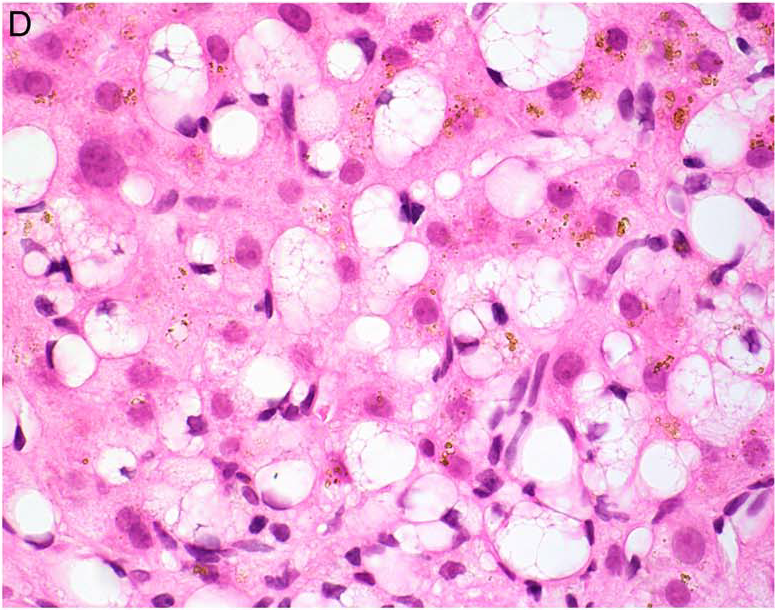 图12.本例患者长期大量服用维生素和草本补充剂,肝活检标本中可见肝脏星状细胞内存在胞质脂质空泡,支持维生素A过量的诊断。同时可见存在轻度的铁沉积。
图12.本例患者长期大量服用维生素和草本补充剂,肝活检标本中可见肝脏星状细胞内存在胞质脂质空泡,支持维生素A过量的诊断。同时可见存在轻度的铁沉积。
全文完
往期回顾:
明察秋毫-活检貌似正常的某些肝脏疾病(一)
明察秋毫-活检貌似正常的某些肝脏疾病(二)
明察秋毫-活检貌似正常的某些肝脏疾病(三)
明察秋毫-活检貌似正常的某些肝脏疾病(四)
明察秋毫-活检貌似正常的某些肝脏疾病(五)















共0条评论