[导读] 作者:abin
摘要
乳腺癌(尤其是三阴性乳腺癌TNBC)缺乏敏感和特异的诊断标志物,用于可靠地区分其他来源的癌。TRPS1是一种较新的免疫组织化学(IHC)标记物,在乳腺癌(包括TNBC)中显示较高的敏感性。然而,随着其使用日益增多,已发现更广泛的免疫反应性。本文评估TRPS1在乳腺癌诊断中的应用价值,与其他标志物(GATA3和SOX10)的诊断敏感性和特异性进行比较。本研究共106例,其中原发部位17例,远处转移89例。综合形态学、免疫表型和分子研究,确诊94例(88.7%)为乳腺原发(37.9%的ER+/HER2-,4.6%的ER-/HER2+,1.1%的ER+/ER2neu+,56.3%的TNBC),12例(11.3%)非乳腺原发。非乳腺原发部位包括肺、膀胱、苗勒管和胃肠道。TRPS1的敏感性和特异性分别为93.6%和58.3%。GATA3的敏感性和特异性分别为76.9%和66.7%。SOX10的敏感性和特异性分别为47.9%和100%。有三例转移性乳腺癌(部位:膀胱、肺和骨),其中TRPS1是唯一的阳性标志物,而GATA3和SOX10是阴性。TRPS1在TNBC中的阳性率(92.0%)高于GATA3(63.4%)和SOX10(56.7%)。TRPS1在其他肿瘤类型中也有表达,包括苗勒管起源的癌、膀胱癌和肺癌,这限制了其在鉴别诊断中的应用。结论 与GATA3和SOX10相比,TRPS1对乳腺原发癌的敏感性更高,而特异性较低。虽然TRPS1可以作为乳腺癌的可靠标志物,但它在其他肿瘤类型中的表达应仔细解读,以免误诊。
简介
除激素受体外,支持乳腺原发癌的常用IHC标记物包括乳腺球蛋白(mammaglobin,MMG)、大囊性病液体蛋白15(GCDFP-15)、GATA结合蛋白3(GATA3)和SRY相关HMG盒10(SOX10)。其中GATA3和SOX10是最有用的标记;然而,它们对乳腺癌没有特异性。GATA3还表达于尿路上皮癌、皮肤附件肿瘤、副神经节瘤、T细胞造血系统恶性肿瘤等。同样,SOX10在黑色素瘤和一些软组织肿瘤中呈阳性。
毛发-鼻-指(趾)综合征1型(Trichorhinophalangeal syndrome type 1,TRPS1)是一个GATA家族的锌转录因子,参与乳腺癌的发生和肿瘤细胞的生存。研究表明,TRPS1对乳腺癌具有较高的敏感性:ER阳性乳腺癌(98%)、HER2阳性乳腺癌(87%)和三阴性乳腺癌(TNBC)(86%),高于其他乳腺标志物,包括GATA3。TRPS1也表达于皮肤和皮肤附件肿瘤,这与GATA3相同。但TRPS1在尿路上皮癌中不表达,这与GATA3不同。随着越来越多地使用TRPS1,我们已经观察到TRPS1在乳腺癌以外的多种恶性肿瘤中的表达。
本研究使用TRPS1兔单抗(克隆号EPR171671, Abcam),10%以上肿瘤细胞呈弱至中度染色判读为阳性。任何数量的肿瘤细胞核呈强染色也视为阳性大多数病例呈弥漫性阳性表达。大多数病例同时染GATA3(克隆L50-823;Biocare Medical)和SOX10(克隆BC34;Biocare Medical)。
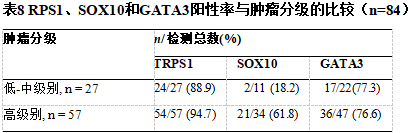
106例在诊断时检测了TRPS1 IHC。其中,TRPS1用于评估17例乳腺标本,以确定肿瘤是原发性乳腺癌(n=14)还是乳腺癌外转移(n=3,肺)。在其余89例患者中,TRPS1 IHC用于诊断远处转移,以确定转移癌是起源于乳腺(n=80)还是来自其他部位(n=9)。
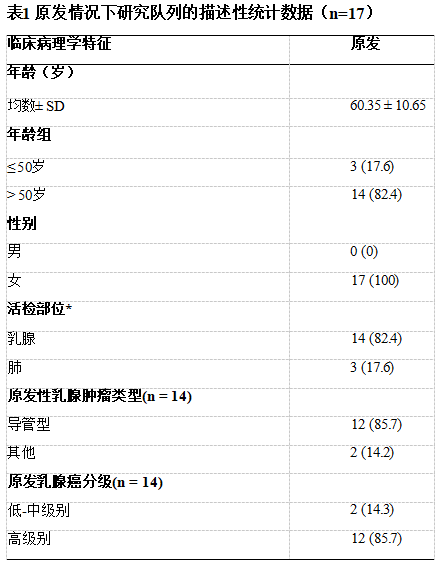
*乳腺活检中,有14例使用了TRPS1,以确认乳腺原发。同样地,在3例肺活检中也使用TRPS1以确认乳腺原发,但确诊为肺癌,因此被纳入原发情况下的研究队列
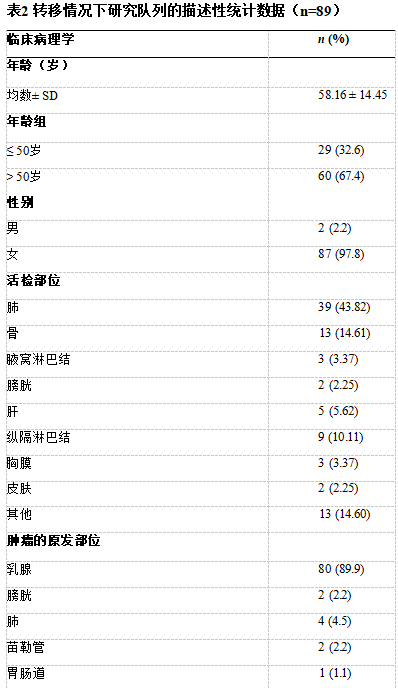
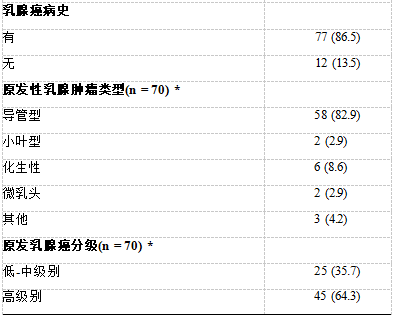
*在80例转移性乳腺癌患者中,只有70例患者的肿瘤类型/分级可供回顾
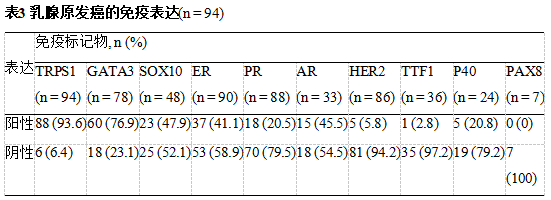
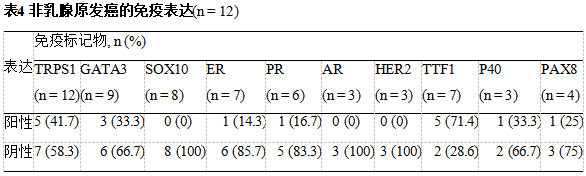
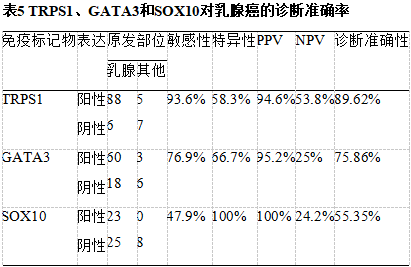
PPV: 阳性预测值; NPV:阴性预测值
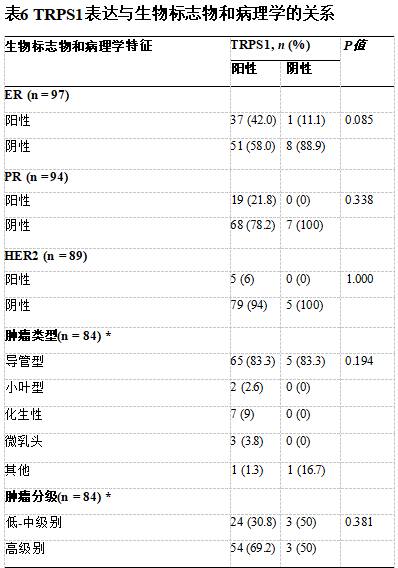
采用Fisher精确检验
*在94例起源于乳腺(总体)的病例中,仅84例有肿瘤类型/分级可供回顾
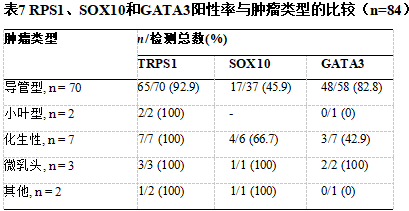
讨论
本研究发现,在原发性和转移性乳腺癌中,TRPS1对确定原发性乳腺癌起源的敏感性较高;然而,其特异性低于其他常用标记物,包括GATA3和SOX10,限制了其在转移性疾病中的应用。在化生性和TNBC中,TRPS1的阳性率高于GATA3和SOX10。相反,转移癌(肺,膀胱和苗勒管起源)中TRPS1显示明显阳性,把它用作唯一的乳腺标志物令人怀疑。
TRPS1在三阴性和化生乳腺癌中的高敏感性
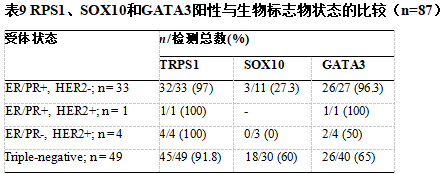
在转移性疾病中,激素受体(ER/PR)阳性与其他免疫标记物共同使用,有助于证实原发性乳腺起源。如果没有免疫组织化学,特别是无法开展分子检测时,TNBC与远处转移很难诊断。TRPS1在TNBC中的阳性率高于GATA3和SOX10(分别为93.6%和76.9%,SOX10为47.9%)。这些发现与现有文献中的结果具有可比性。Yoon等人比较了这三种免疫标记物的阳性率,发现三阴性导管癌中TRPS1的阳性率为99%,而GATA3和SOX10的阳性率分别为63%和74%。同样,Ai等人在分子/mRNA和蛋白表达/IHC水平上研究了TRPS1的表达。他们发现TRPS1在所研究的31种不同实体瘤中,所有乳腺癌亚型的mRNA水平均高表达。TRPS1在luminal A、luminal B、HER2和basal-like/TNBC中的表达与GATA3不同,GATA3在basal-like/TNBC中的表达较低。在IHC水平上,他们发现尽管TRPS1和GATA3在激素阳性和HER2阳性肿瘤中的表达相当,但是TRPS1在TNBC尤其是化生癌中高于GATA3(86%与21%)。与这些发现一致,我们注意到,与GATA3(42.9%)和SOX10(66.7%)相比,TRPS1在化生乳腺癌中的阳性率相当高(100%)。
其他研究也发现了类似的结果。Parkinson等人发现在化生乳腺癌中TRPS1的阳性率高于GATA3(TRPS1为91%,GATA3为55.2%)。还值得考虑的是,TRPS1是软骨和骨发育的标志物,因此,当鉴别诊断为原发性或转移性肉瘤或具有骨软骨样分化的恶性叶状肿瘤时,TRPS1的实用性受到影响。因此,TRPS1不能作为鉴别化生癌和恶性叶状肿瘤的诊断工具。此外,TRPS1在皮肤肿瘤(包括鳞状细胞癌)中表达,因此,不清楚TRPS1在化生癌中的阳性表达是否代表真正的乳腺特异性表达,或者仅仅是因为鳞状/间充质分化。
TRPS1与其他免疫标记物相比特异性低
尽管TRPS1的诊断准确率较高,但其特异性低于GATA3和SOX10。已发现Müllerian来源的肿瘤呈TRPS1阳性。我们有两例苗勒管源性肿瘤显示TRPS1阳性。第一例为高级别卵巢-输卵管源性浆液性癌转移至乳腺,TRPS1阳性,且强弥漫性PAX8和WT1阳性,结合形态学确定诊断。在以前的研究中也注意到Müllerian肿瘤中TRPS1阳性。Rammal等人发现71%的子宫内膜癌TRPS1阳性。这种免疫反应性限制了TRPS1的应用,特别是当诊断鉴别包括Müllerian癌时。在这些情况下,免疫组化套餐应包括PAX8和WT1。我们的研究中没有包括细胞学样本。一项评估TRPS1在恶性胸腔积液鉴别诊断中的应用的研究发现,TRPS1在输卵管-卵巢来源的转移癌癌/高级别浆液性癌(75%)中具有高免疫反应性。
虽然在我们的研究中,我们没有发现任何皮肤/附件癌,但是之前的研究表明TRPS1在所有皮肤和附件肿瘤中都有高表达。皮肤鳞状细胞癌和基底细胞癌中TRPS1的表达率均在90%以上。同样,黏液腺和汗腺肿瘤(良性和恶性)TRPS1高表达。此外,尽管乳腺罕见各种涎腺型肿瘤,这些成为重大的诊断挑战。最近的一项研究表明,大约92%的涎腺癌表达TRPS。因此,应该记住,在这种情况下,当鉴别诊断包括原发性TNBC与涎腺恶性肿瘤时,TRPS1可能没有帮助。不用赘述,GATA3在涎腺肿瘤中也可以是阳性的。上述研究的作者强调SOX10在这种罕见的临床环境中有区分作用。
尿路上皮癌中GATA3阳性限制了其在膀胱癌鉴别诊断中的应用。我们还发现转移性尿路上皮癌患者TRPS1阳性。初步研究表明,TRPS1在膀胱癌中不表达,因此,当鉴别诊断包括膀胱癌和乳腺癌时,认为TRPS1可能优于GATA3。然而,随着TRPS1更广泛的免疫反应性被揭示,最近的文献反驳了这一观点。最近的一项研究表明,24.6%的前列腺癌和20.5%的尿路上皮癌表达TRPS1。这些发现得到了我们研究的支持。
除了苗勒管源性肿瘤和膀胱源性肿瘤外,我们队列中2例肺源性肿瘤中也发现TRPS1阳性。与肺癌中TRPS1免疫表达相关的数据很少且多变。虽然最初的研究表明TRPS1在肺癌中表达较低,但最近的研究表明,肺癌中TRPS1的表达比例较高。对胸腔积液标本进行的研究表明,21.6%的转移性肺癌具有TRPS1免疫反应性。TRPS1在肺癌中的表达在分子水平上也得到了证实。这些发现提示TRPS1不能作为确定乳腺原发癌的唯一免疫标记物,但是由于其在所有乳腺癌类型中的高表达,它可以被纳入排除或确定乳腺原发癌的免疫组化套餐。Du等人提出了一种类似的方法,他们建议将乳腺特异性标记物(包括GATA3、TRPS1和MGP)纳入免疫组化套餐,以确定乳腺原发性疾病。MGP是基质Gla蛋白(matrix Gla protein,MGP),在Du等人研究中,TRPS1在IBC-NST的表达率达91.7%,而MGP和GATA3的表达率分别为89.6%和80.7%。
局限性
本研究的主要局限性在于回顾性设计,有些病例未能全面检测所有的免疫标记物。此外,非乳腺原发性乳腺癌患者数量较少。在所有病例中,原发肿瘤的起源是通过结合形态学和IHC检查以及某些病例(必要时)的分子分析来确定的。此外,我们未从分子/mRNA水平研究TRPS1的表达,也未评估TRPS1在乳腺癌中的预后意义。
另一个局限性是,当转移样本中发现TRPS1阳性时,原发性乳腺肿瘤样本中未同时进行TRPS1检测。转移癌的诊断是在临床背景下进行的,并结合了形态学、IHC谱和分子研究(在一部分病例中)。我们发现,与TRPS1相比,SOX10在我们的队列中具有更高的特异性。但是,我们未包括原发性或转移性黑色素瘤,未来研究TRPS1在黑色素瘤的表达可能很有用。
结论
与GATA3和SOX10相比,TRPS1在乳腺癌发生中具有更高的敏感性。与GATA3和SOX10相比,TNBC和化生乳腺癌中TRPS1的阳性率更高。相反,TRPS1的特异性低于GATA3和SOX10,限制了其应用。
除乳腺癌外,TRPS1在非乳腺肿瘤(包括肺癌、苗勒管癌和膀胱癌)中观察到更广泛的免疫反应性。这些结果表明,尽管TRPS1具有较高的敏感性,但不能作为确定原发性乳腺起源的唯一标志物。此外,先前的研究表明TRPS1在皮肤肿瘤、软骨和骨中呈阳性;因此,其在化生癌中的高阳性率可能是由于鳞状/间质分化,而不是乳腺起源的标志物。虽然这些发现也暗示TRPS1在鉴别化生癌和叶状肿瘤方面缺乏实用价值,但需要更多的研究来证明这一假设。
总之,我们建议TRPS1只能作为诊断套餐的一部分,与GATA3或SOX10一起使用,具体取决于活检部位和鉴别诊断。
文献来源:
Hashmi AA, Brogi E, Wen HY. Trichorhinophalangeal syndrome type 1 (TRPS1) in breast pathology: diagnostic utility and pitfalls. Diagn Pathol. 2025 Mar 1;20(1):26. doi: 10.1186/s13000-025-01623-4. PMID: 40025593; PMCID: PMC11872298.
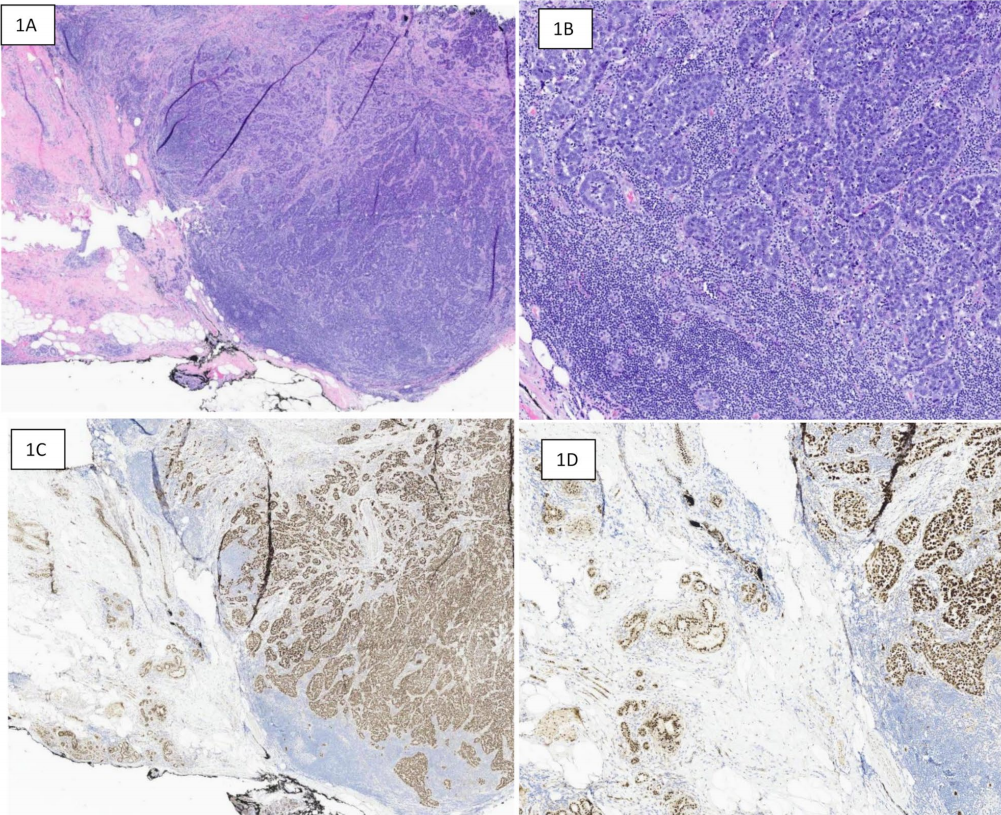
图1 三阴性低分化原发性乳腺癌,TRPS1表达。1A:低倍显示低分化癌,背景炎性浸润密集,边界相对清楚。1B:高倍镜显示高级别实性生长模式。1C:低倍显示TRPS1在肿瘤细胞和背景良性正常乳腺导管和小叶中均显示弥漫强阳性染色。1D:高倍镜显示TRPS1在肿瘤(右)和正常乳腺实质(左)中均显示核阳性,正常乳腺实质作为阳性内部对照。
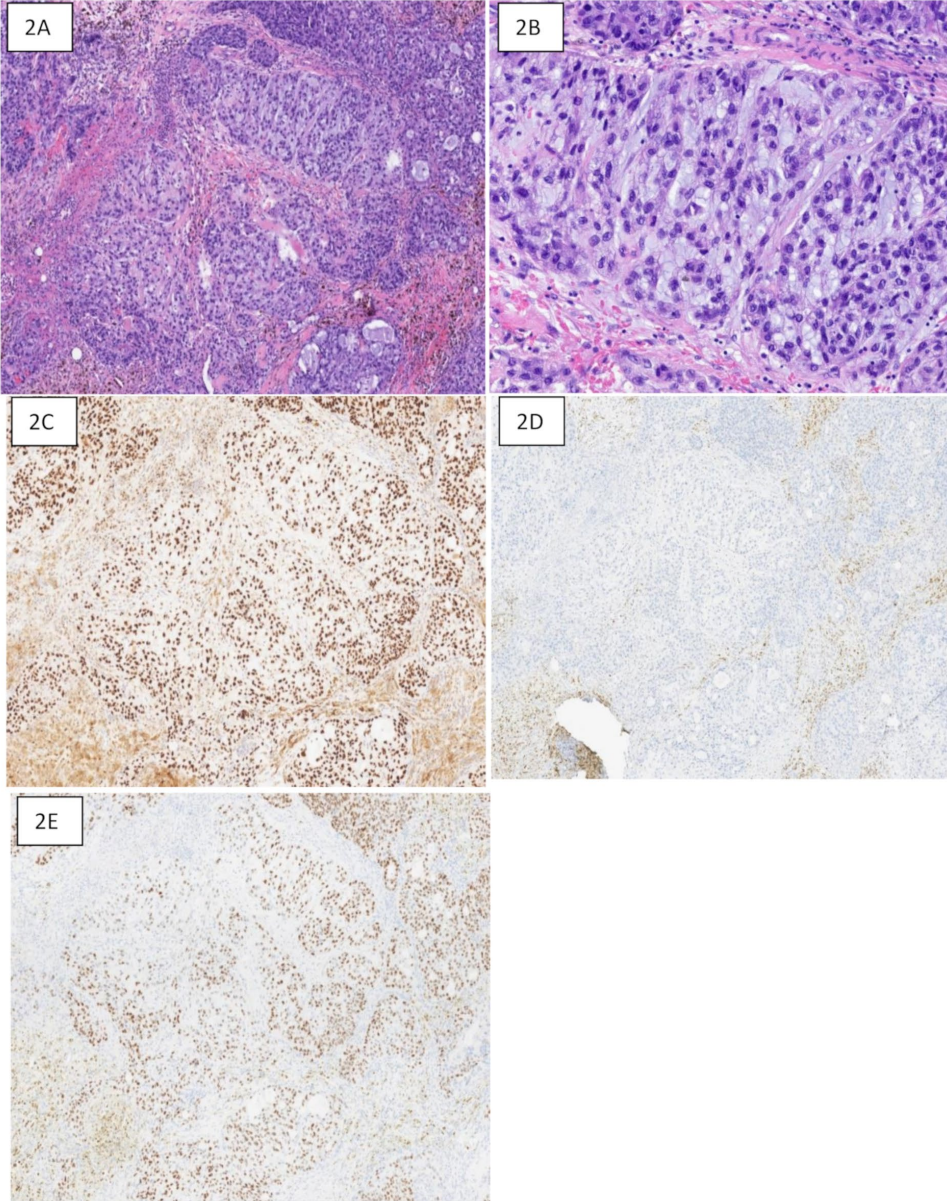
图2 化生型原发性乳腺癌,TPRS1、GATA3和SOX10免疫染色。2A:50倍放大,显示低分化癌,伴有产基质性间质,符合化生性乳腺癌。2B:100放大,显示背景中含有产基质的肿瘤细胞。2C:50倍放大,TRPS1免疫染色,显示肿瘤细胞核呈弥漫性强阳性。2D:GATA3免疫组化,显示细胞核阴性。背景间质内可见胞质染色。2E:SOX10免疫染色,显示肿瘤细胞中的斑片状中等核染色。
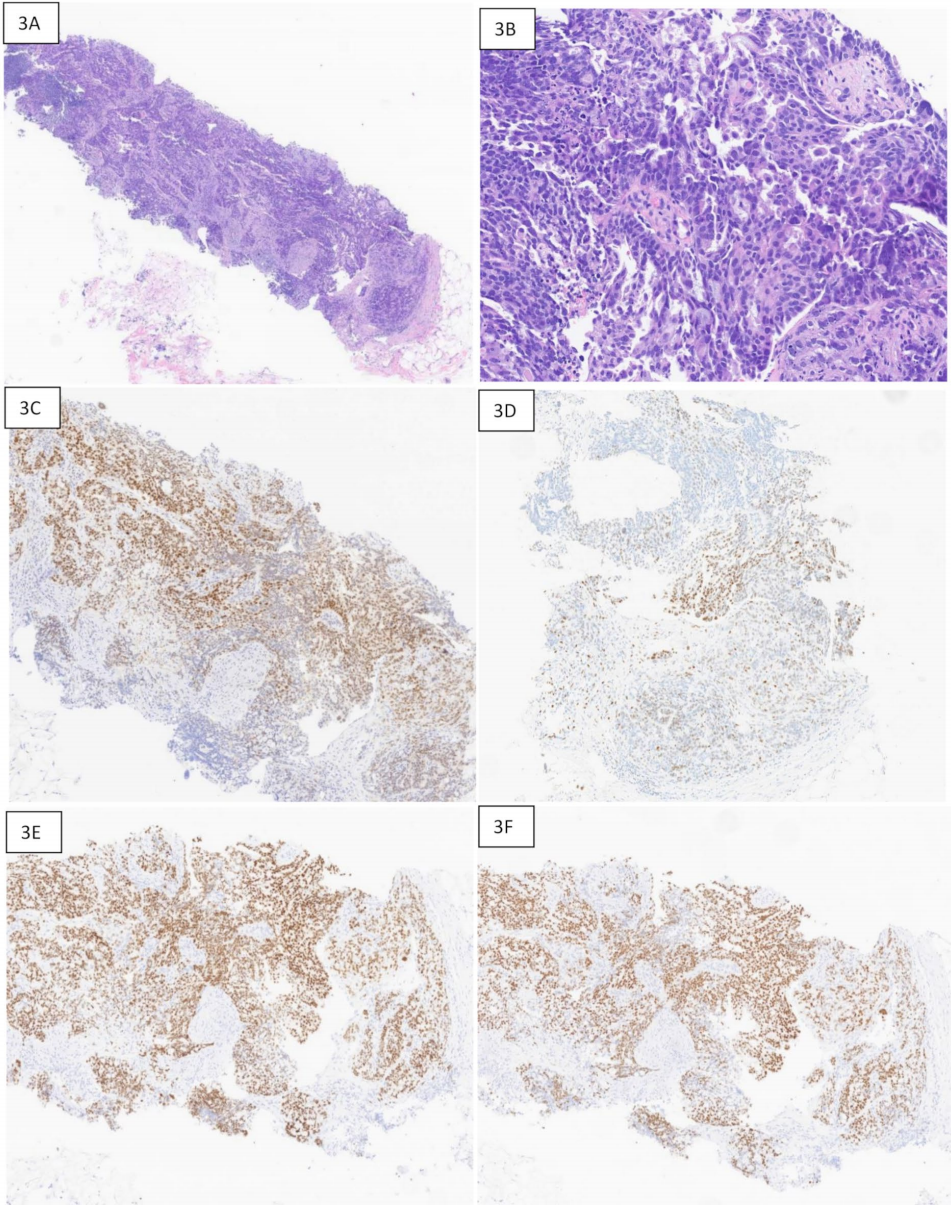
图3 起源于输卵管卵巢的浆液性癌,转移至乳腺,TPRS1、GATA3、PAX8和WT1免疫染色。3A:20倍放大,显示乳腺粗针穿刺活检中的浸润性癌。3B:50倍放大,显示乳头状生长模式。3C:放大50倍,TRPS1免疫染色,显示中度核染色。3D:GATA3免疫组化,显示斑片状中度染色。3E:PAX8免疫组化染色,显示强核染色。3F:WT1免疫染色,显示细胞核呈弥漫强阳性,符合输卵管卵巢起源。
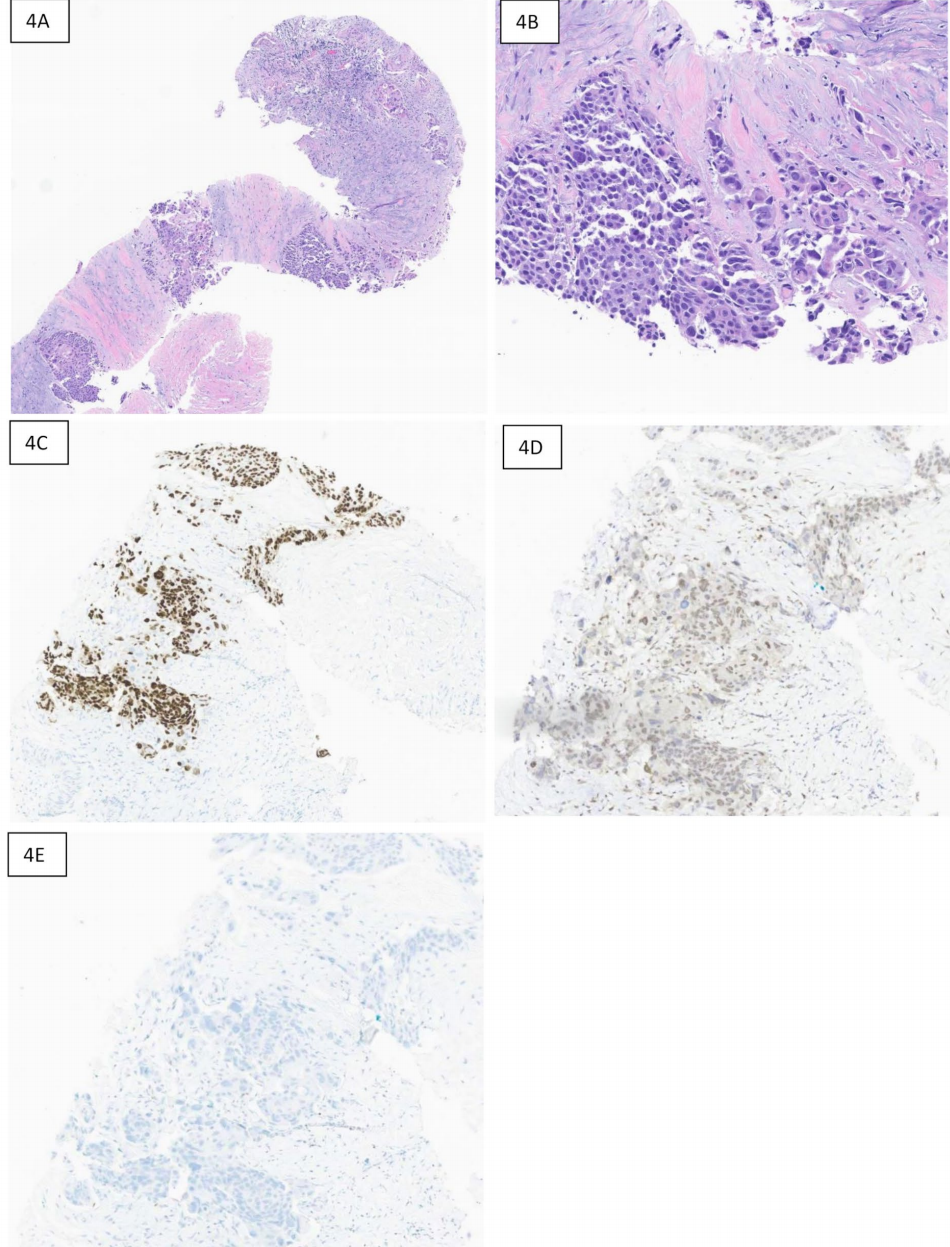
图4 肾盂的转移性尿路上皮癌,P63、TRPS1和GATA3免疫染色。4A:50倍放大,显示纤维组织中巢状和簇状转移癌。4B:100倍放大,显示上皮样肿瘤细胞。4C:P63免疫染色,显示细胞核呈弥漫强阳性。4D:TRPS1免疫染色,显示细胞核呈斑片状弱阳性。4E:GATA3免疫组化,显示肿瘤细胞呈阴性染色



























共0条评论