[导读] 编译:张波
摘要 目的:透明细胞癌(Hyalinizing clear cell carcinoma,HCCC)常见于头颈部,原发于肺部的极为罕见。本病例描述了一位54岁女性患者的肺HCCC。研究方法:总结分析本病例及先前报道的3例肺原发性HCCC的组织形态学、免疫表型和分子特征,强调了潜在的误诊风险。结果:边界清晰的3.5cm肺肿块,HE切片的组织学特征是支气管中心性肿瘤在透明化基质的背景下呈片状、巢状和条索状生长。肿瘤细胞胞质清晰透明至嗜酸性,缺乏明显的核多形性或核分裂活性。免疫组化肿瘤细胞强阳性表达pan-CK、p63和CK5/6,而CK7,CK20,TTF-1,NapsinA,CgA和Syn为阴性。下一代测序证实了具有EWSR1-ATF1融合转录。结论:认识肺HCCC的关键形态学特征对于诊断这种罕见的肺实体至关重要。辅助检查,包括免疫组织化学和分子检测,是必不可少的用于与该肿瘤的形态学相似病变的鉴别诊断方法。
临床病史
一名54岁的非裔美国女性,有高血压、胃食管反流病和间歇性胸痛病史,因最近左上叶肺门肿块逐渐增大而就诊。患者为既往吸烟者(每周少于1包×3年),5年前首次在胸部X线检查中发现肺部肿块,每3至6个月进行一次计算机断层扫描(CT)。审查患者最近的胸部CT扫描显示左上叶肺门肿块最大直径3.2cm,左肺下叶外侧7mm非钙化肺结节(图1)。正电子发射断层扫描显示,中央高代谢活动的肺门上肿块怀疑肿瘤。左下叶小结节未见氟脱氧葡萄糖蓄积,倾向于良性病变。可疑肿块的活检(在外部机构进行)被诊断为中度至低分化鳞状细胞癌。术前肺功能检查显示用力呼气量为2.50(预测值的113%),一氧化碳弥散量为25.8(预测值的86%)。行左上肺叶切除术,伴肺门和纵隔淋巴结清扫术。大体肉眼所见,明确为一个实性、孤立、边界清楚的3.5cm棕褐色肿块,无胸膜受累。
组织形态学和辅助检查
HE染色切片显示肿瘤位于主支气管中心,可能起源于主支气管(图2)。肿瘤细胞主要以片状、巢状和条索状生长于透明变的间质中(图3),没有确定的腺样或鳞状分化。间质稀少区可见丰富的淡嗜酸性细胞质为主的肿瘤细胞(图4),与间质丰富区的透明细胞(图5)并存。肿瘤细胞核淡染,核仁很小或不明显,染色质较细或呈空泡状(图6),罕见核内假包涵体,没有坏死或核多形性的证据。肿瘤周边可见慢性炎症聚集,在肿瘤细胞丰富的区域,可见显著的浆细胞与肿瘤细胞混合浸润(图7)。核分裂计数显示平均1/10HPF。免疫组织化学染色,肿瘤细胞强阳性表达pan-CK、p63(图8) 和CK5/6,而CK7、CK20、甲状腺转录因子1(TTF-1)、NapsinA、嗜铬粒蛋白(CgA)和突触素(Syn)均呈阴性。12个淋巴结均未见癌转移。无胸膜受累或淋巴管间隙侵犯。所有手术切缘均为肿瘤阴性。初步诊断为中度分化鳞状细胞癌(伴透明细胞改变),肿瘤分期为pT2aN0(IB期)。由于患者有轻度吸烟史,患者的肿瘤科医生要求进行分子检测。通过基于杂交捕获的下一代测序进行的基因组分析证实为EWSR1-ATF1融合(图9),因此对该病例进行组织学重新评估、文献检索和综合外部专家咨询意见,最终诊断为肺透明细胞癌(HCCC)(唾液腺型)。患者头部和颈部没有任何病变或肿块的证据。在临床随访(手术后16个月)时,患者情况良好,胸部CT显示无复发或转移性疾病的证据。
透明细胞癌(HCCC)
头颈部HCCC
1994年,Milchgrub等人首次将HCCC描述为一种罕见的肿瘤,主要发生于头颈部的小唾液腺。截至2014年,报告了136例头颈部HCCC,并在最近的一份报告中进行了总结。肿瘤最常见于口腔内粘膜下,表现为相对界限清楚的肿块,常见于50岁或60岁的患者中,女性较男性少些。这种低级别癌的关键组织形态学特征包括透明细胞在透明化间质内呈条索状和巢状生长。核轻度异型,核仁小或不明显,无坏死,核分裂像罕见(<1个/10HPF,或最多不超过5个/10HPF)。可见粘液细胞,但不是特征性形态。值得注意的是,只有少数病例显示透明细胞占显著优势;事实上,大多数肿瘤细胞显示嗜酸性细胞质。尽管透明细胞很少或甚至缺乏,但肿瘤细胞的特征性结构生长模式(条索状、巢状、片状、薄小梁状)以及透明化间质的背景为正确诊断提供了有用的线索。罕见的高级别转化(出现坏死、核分裂指数高、病理性核分裂及核多形性)病例已被排除。
辅助检测
HCCC的超微结构特征、特殊染色和免疫组织化学染色特征以及分子变化已在头颈部原发灶中进行了专门研究。HCCC现在被认为是一种具有鳞状分化的低度恶性肿瘤;不鼓励使用旧术语,如透明细胞腺癌或透明细胞癌。超微结构上,桥粒和张力丝的存在支持鳞状分化。鳞状分化也得到34βE12和p63免疫组化反应性的支持。其他局灶性或弥漫性阳性免疫反应见于角蛋白AE1/AE3、CK5/6、CK7、CK14、CK19、EMA、Cam5.2和波形蛋白抗体。PAS染色阳性并对淀粉酶敏感也是其特征,反映了细胞质糖原含量。相关的阴性染色包括S-100、MSA、平滑肌肌动蛋白(SMA)和钙调蛋白,这种免疫表型有助于排除肌上皮分化。虽然透明化基质可能类似淀粉样变性,但实际上透明化基质是致密胶原,刚果红染色为阴性。
EWSR1荧光原位杂交(FISH)是诊断HCCC的一种有用的辅助检测。EWSR1在87%至91%的头颈部HCCC中发生重排。这种重排的伴侣基因通常是激活转录因子1(ATF1)。通过逆转录-聚合酶链式反应(RT-PCR)和测序,大多数HCCC(93%)显示具有EWSR1-ATF1融合转录。其他肿瘤也可能显示EWSR1-ATF1融合,包括肌腱和腱膜透明细胞肉瘤,血管瘤样纤维组织细胞瘤,以及其他几种;这些几乎总是具有与HCCC非常不同的临床特征、组织学和免疫表型,因此,这种分子特征的存在与上述HCCC的组织形态和免疫表型相结合,可以作为HCCC与模拟其形态学特征病变的鉴别诊断方法。
肺HCCC
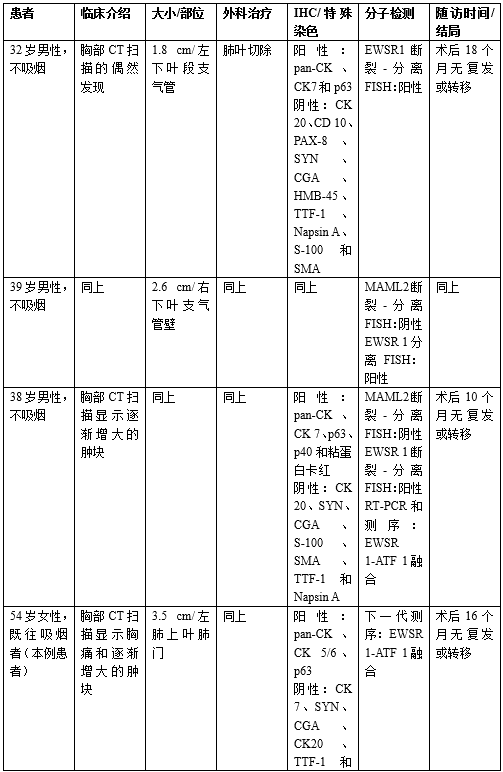
迄今为止,文献中仅报告了3例发生在肺部的HCCC病例。Shah等人在2014年描述了2例肺部HCCC患者。这两名患者都是30多岁的年轻男性(不吸烟),胸部CT扫描偶然发现肺部肿块。两例患者均行肺叶切除术,显示边界清楚,支气管中心性肿瘤突出到气道。组织形态学特征与头颈部HCCC所述相似。值得注意的是,其中一例病例显示小面积的肿瘤细胞坏死,但未提及核多形性或高核分裂指数(与高级别转化相关的特征)。未讨论手术切缘状态或淋巴结受累情况。辅助检测包括一系列免疫组织化学(IHC)染色,对pan-CK、CK7和p63呈阳性,对CK20、CD10、PAX-8、嗜铬粒蛋白、突触素、HMB-45、TTF-1、NapsinA、S-100和SMA呈阴性。两例均经FISH证实EWSR 1基因重排。值得注意的是,两名患者均未发现头颈部病变,均被诊断为肺原发性HCCC(唾液腺型)。未给予辅助治疗,随访1.5年后未检测到复发或转移性疾病。在Shah等人病例报告的同一年(2014年), García及其同事发表了一份关于一名38岁非吸烟者因肺部肿块逐渐增大而接受右下叶切除术的肺部HCCC的报告。肿块被很好地包围并集中在支气管。组织形态学特征在头颈部HCCC所描述的范围内。明显不存在坏死、核分裂活性增加或核多形性。未说明手术切缘状态或淋巴结受累。辅助检测包括一系列免疫组化染色,pan-CK、CK7、p63和p40呈阳性,CK20、嗜铬粒蛋白、突触素、S-100、SMA、TTF1和NapsinA呈阴性。粘液蛋白卡红染色在较少细胞中呈阳性。支持低度粘液表皮样癌诊断的MAML2 FISH为阴性。EWSR1的FISH显示重排,随后的RT-PCR和测序显示为EWSR1-ATF1融合转录。考虑到这些结果以及没有头颈部病变,患者被诊断为肺原发性HCCC(唾液腺型)。未给予任何辅助治疗,随访10个月后未发现复发或转移性疾病。上述4例报告的肺部HCCC(包括本例患者)的临床病理学特征总结见(表1)。虽然报告的组织学、免疫表型和肺HCCCs的分子特征反映了发生在头颈部的HCCC的分子特征,但值得注意的是,所有3例先前报道的肺HCCCs都发生在30多岁的男性中(表1)。本研究病例在年龄和性别分布上有所不同,本研究报道的是第一例原发性肺HCCC的女性患者,更符合头颈部HCCC特征。
正如我们的病例所示,肺内HCCC的罕见、透明细胞的缺乏和鳞状细胞免疫表型是这种低度恶性肿瘤错误分类的潜在陷阱。仅从组织学角度来看,主要的诊断鉴别因素包括但不限于鳞状细胞癌伴透明细胞改变、累及肺的唾液腺肿瘤(例如,“粘蛋白缺失型”低级别粘液表皮样癌)、肌上皮肿瘤或具有透明细胞的转移性癌,如转移性肾细胞癌。如病变在肺部,且组织学形态表现为上述肿瘤生长模式和透明化间质,此时需要考虑罕见的肺原发性HCCC(但要密切关注临床相关信息排除继发可能)。
鉴别诊断方面,尽管p63、CK5/6和角蛋白呈阳性,但总体上组织形态学特征温和、核分裂指数低和无角化与伴有透明细胞改变的鳞状细胞癌的诊断不符。从粘蛋白缺失的低级别粘液表皮样癌中分离HCCC可能具有挑战性,因为HCCC可能表现出罕见的粘蛋白阳性细胞。在困难的情况下,MAML2和EWSR1的分离FISH可能是一种有用的辅助检测方法,可以用于进行鉴别诊断。具有肌上皮分化的肿瘤也被列入鉴别诊断当中,特别是胸部肌上皮肿瘤,其瘤细胞为巢状和实性,由透明细胞组成,并与透明化间质相关。虽然角蛋白和p63经常呈阳性,但这些肿瘤也共表达S-100和/或肌源性标志物(SMA或钙调蛋白),有助于与HCCC的免疫表型区分。与HCCC类似,胸部肌上皮肿瘤可以显示EWSR1重排,但融合伴侣不同,包括PBX-1和ZNF444。最后,肺是转移性疾病的常见部位。考虑到头颈部有HCCC的倾向,根据临床病史或转诊至耳鼻喉专科医生排除从唾液腺原发部位转移到肺的过程是必要的。此外,必须排除其他具有透明细胞的转移性恶性肿瘤,当然要与临床表现、病史和/或免疫组织化学辅助检查(例如,肾细胞癌的PAX-8)相关。
治疗及预后
由于该肿瘤的罕见性,目前尚没有标准化的治疗方法。根据肿瘤的位置,手术切除肿瘤,手术切缘阴性是主要的治疗选择。肺叶切除术后肺HCCC(表1)的结局非常好(没有区域淋巴结受累、远处转移或局部复发的报告),但由于报告病例较少,因此限制了有意义的结论。据报告,头颈部HCCC的结局为良好至极好。局部复发率范围为11%-20%;转移性疾病罕见。需要强调的是,淋巴结受累、手术切缘阳性状态和肿瘤细胞坏死与复发风险增加相关,在最初2年和5-7年内复发风险最高。另外,具有高级别特征(坏死、核多形性、高核分裂指数、病理性核分裂像)的HCCC自然具有相对较差的预后。
总结
HCCC是一种罕见的低度恶性肿瘤,好发于头颈部。在本病例之前,仅报告了3例肺部HCCC病例。本研究病例增加了关于这一主题的较少的但不断增长的文献,这是第一例女性患者的肺部HCCC报告。肺HCCC具有头颈部HCCC的组织学、免疫表型和分子特征。了解特征性的形态学特征是识别这种罕见的肺实体的关键。在我们的病例中很明显,缺乏透明细胞优势的肿瘤结合鳞状分化的免疫表型证据(p63,CK5/6)可能导致鳞状细胞癌的错误分类。与典型的非小细胞肺癌不同的临床特征包括诊断时相对年轻,缺乏明显的吸烟史。然而,特征EWSR1-ATF1融合转录的分子检测是一个非常有用的辅助诊断方式,从而可以支持诊断的正确性。

图1胸部计算机断层扫描显示左肺上叶肿块
图2浸润性肿瘤细胞以支气管为中心
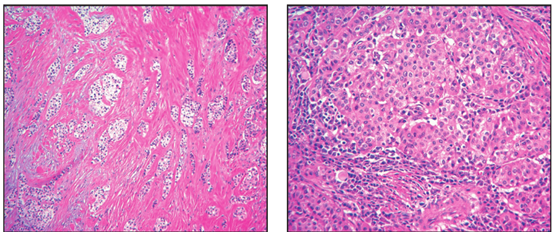
图3肿瘤细胞主要以片状、巢状和条索状生长于透明变的间质中
图4间质稀少区可见丰富的淡嗜酸性细胞质为主的肿瘤细胞
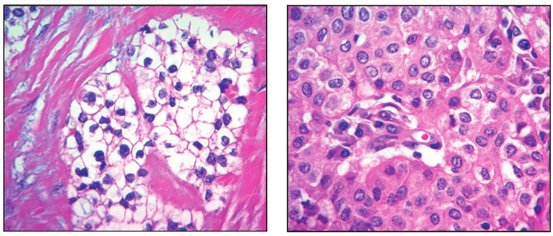
图5富含胶原透明化间质的透明细胞区
图6肿瘤细胞核淡染,核仁很小或不明显,染色质较细或呈空泡状
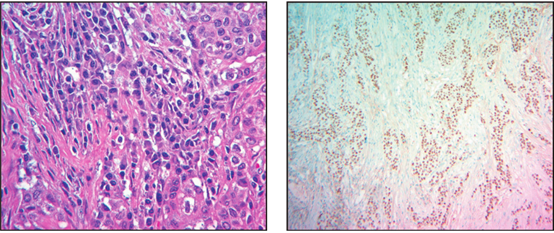
图7在肿瘤细胞丰富的区域,可见显著的浆细胞与肿瘤细胞混合浸润
图8免疫组织化学染色,肿瘤细胞强阳性表达p63
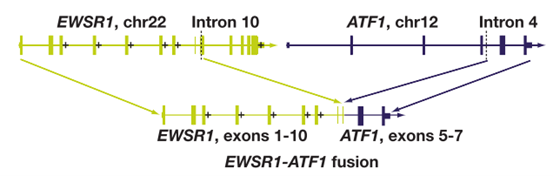
图9基于杂交捕获的下一代测序进行的基因组分析证实为EWSR1-ATF1融合
表1.所有报告的肺透明细胞癌的临床病理特征总结
点此下载原文献



















共0条评论