[导读] 编译整理:强子
病种详解之放射性瘢痕/复杂性硬化性病变
放射性瘢痕的定义,是“伴纤维弹性组织增生及腺体结构陷入、伴或不伴上皮增生的病变”。该病变一般小于1cm,且呈星型构型;结构杂乱的较大病变则称为复杂性硬化性病变。
粗针穿刺活检中检出放射性瘢痕的比例为1%-2%。临床可为双侧、和/或多发;一般表现为X线检出星型肿物、类似浸润性癌,或为偶发。虽然影像学上病变中央存在透光区倾向于放射性瘢痕,但大部分影像学可见的病变都会被归为BIRADS的4类(即可疑恶性)而导致粗针穿刺活检。
大体表现方面,放射性瘢痕可能并不明显,或表现为不规则、质实区域并伴黄色条纹而类似浸润性癌。组织学上,放射性瘢痕表现为不规则、星型构型;中央呈分带状结构,细胞数量不等,且胶原化/玻璃样变的弹力纤维增生中央区会有陷入的、小而不规则的管状/腺样结构,这些管状或腺体结构均有上皮和肌上皮;由此向外,中部为受挤压的放射性导管、伴普通型导管上皮增生;最外侧为表现不一的良性改变,具体如导管扩张、大汗腺化生、硬化性腺病。复杂性硬化性病变则更大、境界不清,无病变中央的特点,且更加杂乱,混有上皮增生、硬化性腺泡、微小乳头状瘤(常伴硬化)等,且有时呈结节状表现。复杂性硬化性病变大多和相邻的较小病变混杂在一起。
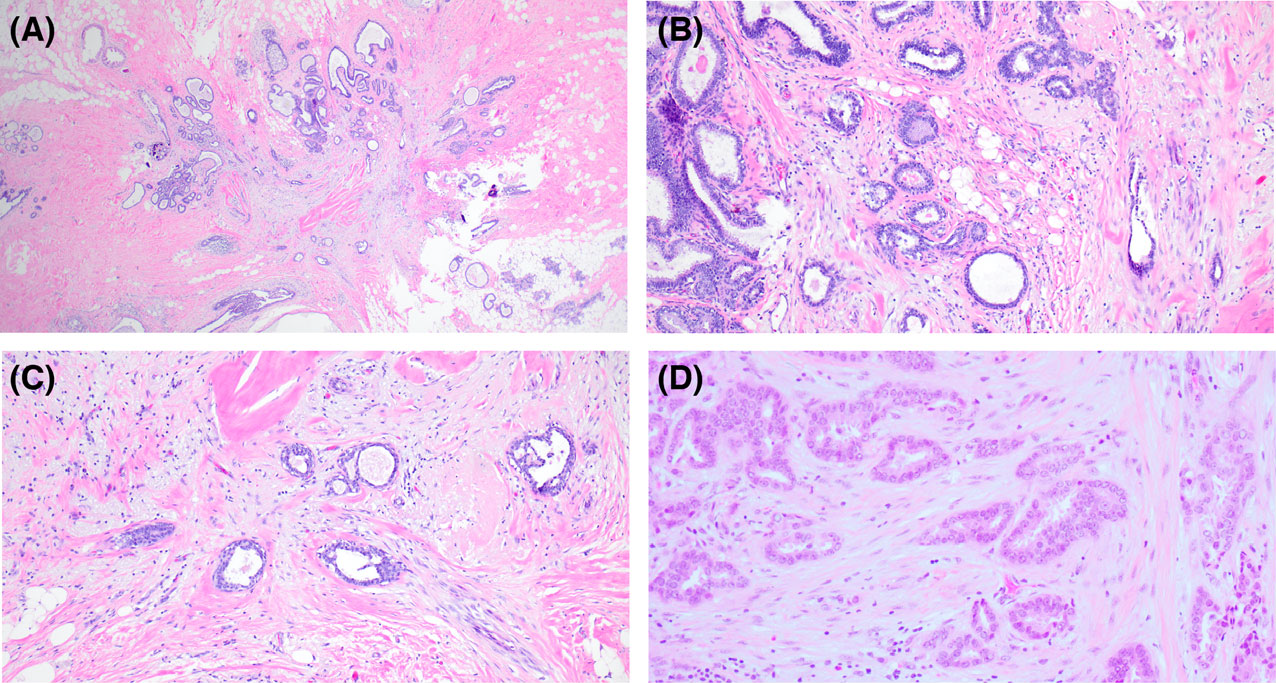 图1.(A)放射状瘢痕,本例为乳房缩小标本中偶见。低倍镜下呈星型表现;(B、C)中央的弹力纤维增生、伴陷入的不规则小管状结构,衬覆细胞为上皮细胞和肌上皮细胞。(D)作为对比,小管癌呈浸润性管状结构,衬覆细胞为单层、有轻度非典型,位于促纤维增生性间质中;且并无中央的弹力纤维增生、伴良性上皮改变、肌上皮细胞。
图1.(A)放射状瘢痕,本例为乳房缩小标本中偶见。低倍镜下呈星型表现;(B、C)中央的弹力纤维增生、伴陷入的不规则小管状结构,衬覆细胞为上皮细胞和肌上皮细胞。(D)作为对比,小管癌呈浸润性管状结构,衬覆细胞为单层、有轻度非典型,位于促纤维增生性间质中;且并无中央的弹力纤维增生、伴良性上皮改变、肌上皮细胞。
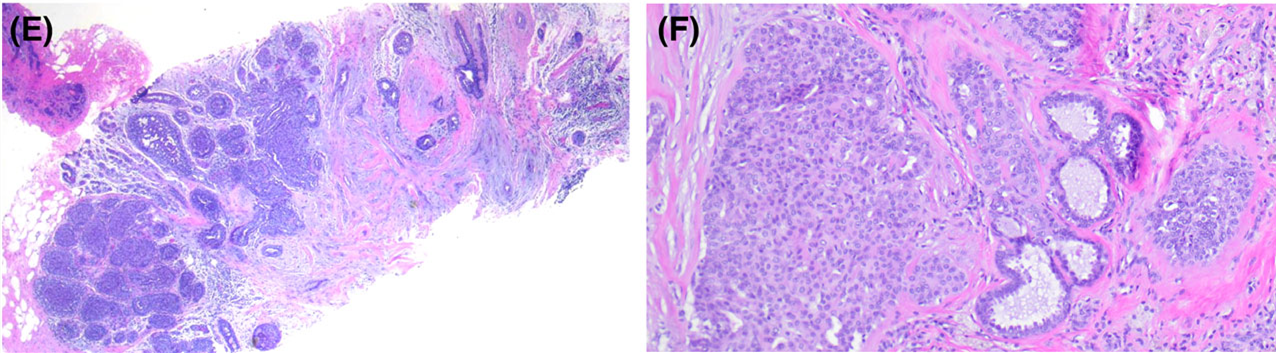 图2.另一例放射性瘢痕,乳腺X线中表现为肿物而行粗针穿刺活检。低倍镜下为星型病灶,中央为弹力纤维增生、伴管状结构陷入,周围有多灶的普通型导管上皮增生(UDH);放大观察,普通型导管上皮增生为杂乱上皮细胞构成,呈流水状结构,且细胞核有重叠。
图2.另一例放射性瘢痕,乳腺X线中表现为肿物而行粗针穿刺活检。低倍镜下为星型病灶,中央为弹力纤维增生、伴管状结构陷入,周围有多灶的普通型导管上皮增生(UDH);放大观察,普通型导管上皮增生为杂乱上皮细胞构成,呈流水状结构,且细胞核有重叠。
放射性瘢痕及复杂性硬化性病变应鉴别浸润性癌。病变中陷入的小管/导管结构可能会类似低级别、非特异性浸润性癌或小管癌,尤其低倍镜下观察。不过,中央存在弹力纤维增生区、周边呈带状结构、伴上皮良性改变、周边呈圆形、小管结构周围有肌上皮细胞、无细胞学非典型、无促纤维增生性间质、不浸润入周围脂肪,这些都倾向于是放射性瘢痕或复杂性硬化性病变。陷入的小管或腺体结构周围的肌上皮细胞可能会不太明显,HE切片和免疫组化中可能都会如此,这可能与肌上皮细胞拉长、细胞核之间距离增大有关。不过,疑难病例中可以加做肌上皮细胞标记,如calponin、p63;且并不是仅仅根据“肌上皮缺失”而做出最终诊断。
放射性瘢痕及复杂性硬化性病变后续发生乳腺癌的风险稍有升高,相对风险为1.45-1.74;这主要和存在导管内增生型病变相关。此外,约30%的病例伴有上皮的非典型病变或恶性病变,具体如平坦型上皮非典型、非典型导管上皮增生、导管原位癌、甚至浸润性癌。因此诊断放射性瘢痕及复杂性硬化性病变的情况下,需仔细形态学评估来排除存在上述病变可能。
此外,粗针穿刺活检中诊断出放射性瘢痕及复杂性硬化性病变也被视为高危病变,因为后续有可能会升级为非典型导管上皮增生、导管原位癌、甚至浸润性癌。不进行影像学和病理相结合的研究中,病变级别升高的几率为0%至40%不等;但影像学与病理相一致的研究中,这一几率似乎低于2%。级别升高几率较高者,与年龄较大(>50岁)、影像学表现、病变大小(0.6cm)、活检针的大小有关。一项较早meta分析发现总体级别升高几率为10.4%,且伴非典型的放射性瘢痕要比不伴非典型的放射性瘢痕级别升高几率更高(26% VS 7.5%)。最近的一项meta分析纳入了49个研究、3163个病例,发现8-11号针真空辅助粗针穿刺的情况下后续病变级别升级几率最低,在2213例无非典型的放射性瘢痕中为1%。
对于筛查检出、粗针穿刺活检诊断的放射性瘢痕后续处理还存在争议。有些专家建议对于病变≥1cm、以及≥11号针检出的≥12条组织的病变要手术切除,但影像学或粗针穿刺活检中精准评估大小可能存在一些问题。如果同时存在更严重病变(如非典型导管上皮增生、导管原位癌、甚至浸润性癌),或影像学与病理结果不一致,应马上手术切除。对于粗针穿刺活检诊断的无非典型放射性瘢痕且影像学与病理一致者,影像学随访可能是合适的。对于偶见的放射性瘢痕、或粗针穿刺完全去除了病变者,也可以随访。
——未完待续——
往期回顾:
乳腺肿瘤性及非肿瘤性硬化性病变(一)















共0条评论