[导读] 编译:张波
摘要:伴有GLI 1基因融合或扩增的软组织肿瘤最近被描述为一种独特的病理实体,具有确定的恶性风险。本文通过研究11例伴有GLI 1改变的头颈部病变的临床病理学和分子学特征来展示此研究结果,其中8例发病部位为舌。这些肿瘤通常累及30多岁的男性(男女比为2.7∶1,范围:1~65)。肿瘤呈多结节状生长,巢状结构被纤细的树枝状血管网隔开,细胞核形态较一致为圆形至卵圆形,细胞质透明,瘤细胞突入血管间隙较为常见。通过荧光原位杂交和/或靶向RNA测序研究其遗传变异。7例肿瘤携带GLI 1与ACTB(n=4)、PTCH 1(n=2)或MALAT 1(n=1)融合。其余4例为GLI 1与CDK 4、MDM 2基因共扩增。肿瘤中S100蛋白和CD 56阳性率较高。CDK 4、MDM 2和STAT 6在GLI 1扩增肿瘤中呈阳性。6例随访患者中有2例(GLI 1扩增和PTCH 1-GLI 1融合各1例)发生远处转移。两种肿瘤均表现出高的核分裂指数和肿瘤坏死。头颈部,尤其是舌部,是GLI 1相关间叶肿瘤的常见部位。尽管形态学上与以前报道的“伴有t(7;12)易位的血管周细胞肿瘤”(常发生于舌)有重叠,但本研究扩展了原来的发现,包括了更多变的免疫表型,晚期远处转移的倾向,以及GLI 1致癌激活的替代机制,如各种GLI 1融合基因或GLI 1与MDM 2和CDK 4基因的共扩增。
GLI家族锌指1(GLI 1)属于GLI基因家族,编码GLI 1转录因子,是hedgehog信号通路下游关键转录效应因子。已在多种肿瘤中观察到hedgehog信号的异常激活,包括基底细胞癌、神经胶质瘤、胰腺癌、结肠直肠癌、前列腺癌、肺癌和乳腺癌。2004年,Dahlen及其同事首次描述了ACTB-GLI 1融合于所谓的“伴有t(7;12)易位”的血管周细胞肿瘤,一种罕见但独特的软组织肿瘤,与良性临床过程相关,根据其平滑肌肌动蛋白(SMA)阳性/S100阴性免疫表型和超微结构特征,推断发生了血管周细胞分化。然而,最近的几项研究表明,在一组软组织中GLI 1基因异常,具有共同形态学特征但免疫特征更多变的肿瘤,通常包括S100阳性和恶性行为倾向,包括区域和/或远处转移。此外,这些肿瘤中遇到的遗传改变不仅包括GLI 1与ACTB基因的融合,还包括与其他基因的融合,如MALAT 1和PTCH 1,以及高水平的GLI 1基因扩增,通常与位于12q13.3-q15区域的邻近基因共扩增,如DDIT 3/CDK 4/MDM 2/STAT 6基因。
有趣的是,头颈部(HN),特别是舌头,是最常见的肿瘤累及部位,最初定义的伴有t(7;12)易位的血管周细胞肿瘤,发生在5个病例中的3个。在本项研究中,研究了一个大的HN间叶肿瘤队列的临床病理结果,这些肿瘤具有各种GLI 1基因异常,并评估了它们与先前定义的具有GLI 1基因异常血管周细胞肿瘤的发病关系。
材料与方法
病例选择和临床病理回顾
本研究获得了机构审查委员会的批准。检索11例携带GLI 1改变的HN间叶肿瘤,收集临床特征和结果,例如年龄、性别、原发肿瘤部位、随访期、复发和远处转移情况。收集以下病理参数:生长模式、结构、细胞学特征、血管模式、血管突出/浸润、有丝分裂指数(每10个HPF,视野直径0.55mm)和肿瘤坏死。记录任何异常的组织学特征。免疫组化染色包括S100蛋白、SOX 10、CD 56、角蛋白AE 1/AE 3、上皮膜抗原、结蛋白、SMA、STAT 6、MDM 2和CDK 4。
GLI1基因异常的检测
通过荧光原位杂交(FISH)(n=10)和/或靶向RNA测序(RNAseq)平台(n=2)研究潜在的GLI 1基因分子改变。
统计学
使用SPSS软件24.0进行所有统计分析。采用适当的统计学检验比较GLI 1扩增和GLI 1易位肿瘤的临床病理特征,即非参数变量采用Fisher精确检验,连续变量采用双尾t检验。P值<0.05被认为具有统计学显著性。
结果
临床特点
本研究纳入了11例GLI 1改变的间叶肿瘤患者。根据对未分类肿瘤的遗传筛查,回顾性确定了3例病例,这些病例是先前首次发表报道的新型实体病例,而其余8例病例是基于其独特的组织学特征前瞻性识别和收集的。中位年龄为38岁(范围:1~65岁)。男性居多,男女比例为2.7:1。2例病例发生在儿童中,均出现在舌部并携带GLI 1-ACTB融合,包括1例先天性病变的男性婴儿和1例14岁男孩。事实上,舌是最常见的发病部位。其他较不常见的受累部位包括下颌下腺、颈部/下颌下腺和颈部软组织(各1例)。
病理学特征和免疫表型
在所有病例中观察到的典型组织学特征包括低倍镜下的多结节或丛状生长模式,具有独特的巢状结构,由丰富的细小分支状血管网分隔。组成细胞具有均一的圆形至卵圆形核和通常透明的细胞质(图1)。除3例(75%)外,所有病例均观察到肿瘤巢突入血管间隙。核分裂活性是可变的,范围从0~11个/10HPF(中位数:4个)。其他少见的镜下表现包括明显的细胞质空泡化,类似于成脂肪细胞/假成脂肪细胞(n=1);明显的梭形和束状生长(n=1);丰富的嗜酸性颗粒细胞质(n=1);假菊形团(n=2),肿瘤坏死(n=2);突出的纤维间隔(n=3);微囊/假肺泡/假腺腔(n=2);肿瘤细胞在突出的粘液样间质内呈索状排列(n=2);间质玻璃样变伴多个透明小球(n=1,图2)。
免疫组化结果肿瘤常呈S100蛋白阳性(6/10,60%),CD 56呈强而弥漫性染色(4/4,100%)。另外SMA、角蛋白AE 1/AE 3和上皮膜抗原的免疫阳性率分别为40%(4/10)、22%(2/9)和20%(1/5)。其他标志物,包括SOX 10、CD 31、CD 34、ERG、嗜铬粒蛋白、突触素、CD 99和结蛋白均为阴性。
分子学发现和临床病理学相关性
使用FISH和/或RNA-seq平台在所有肿瘤中确认GLI 1改变。7例肿瘤携带GLI 1与以下配偶体的融合:ACTB(n=4)、PTCH 1(n=2)或MALAT 1(n=1)。其余4例显示GLI 1与CDK 4和MDM 2基因共扩增(图3)。GLI 1扩增的肿瘤通常表现出CDK 4(3/3,100%),MDM 2(3/3,100%)和STAT 6(3/5,60%)的过表达。本研究中,与GLI1易位肿瘤(中位数:32,范围:1~56,双尾 t检验,P=0.047)相比,GLI1扩增肿瘤(中位数:53,范围:39~65)与明显更大的发病年龄相关。其他临床病理参数(如性别、核分裂指数、坏死和免疫表型)在两个分子组之间没有显著差异。
突出显示远处转移可能性的临床结局
6例患者有临床随访数据,中位随访时间为16.5个月(范围:2~104个月)。2例患者(1例GLI 1扩增,另1例PTCH 1-GLI 1融合)分别在6个月和83个月时发生局部复发和远处转移。转移部位为肺(n=2)、骨(n=1)、软组织(n=1)和脑(n=1)。这两个肿瘤都显示了较高的核分裂指数为6-7个/10HPF和肿瘤坏死。复习1例远处转移的病例显示出典型的组织学特征,以及突出的梭形区域、核分裂指数升高(40个/10 HPF)和肿瘤坏死(图1)。其余4例在末次随访时均无疾病和复发。
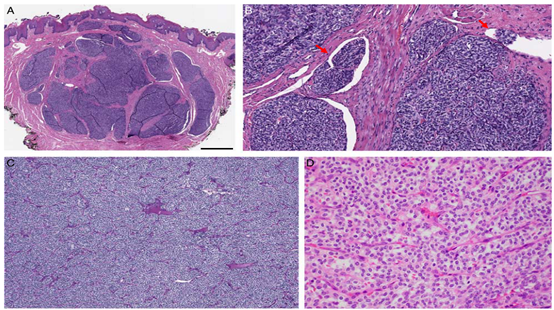
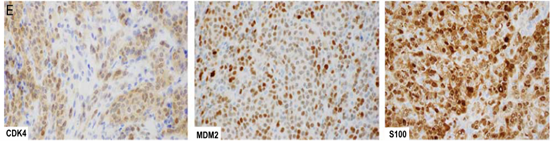
图1.伴有GLI 1基因异常的HN间叶肿瘤:典型的组织学特征A,GLI 1-ACTB融合阳性的舌肿瘤,在低倍镜下显示典型的多小叶/丛状生长模式(比例尺:1cm)。B,瘤巢在血管通道内突出(红色箭头)是常见的组织学表现。实性结构被丰富纤细的血管网分成各种大小细胞巢。高倍镜下,肿瘤细胞核单一,呈圆形或卵圆形,胞浆中等量透明或嗜酸。潜在的分子改变可能不同,包括ACTB-GLI 1融合(A/B)、PTCH 1-GLI 1融合(C)和GLI 1扩增(D)。E,通过免疫组织化学,(D)中所示的GLI 1扩增的肿瘤对CDK 4、MDM 2和S100蛋白呈阳性。
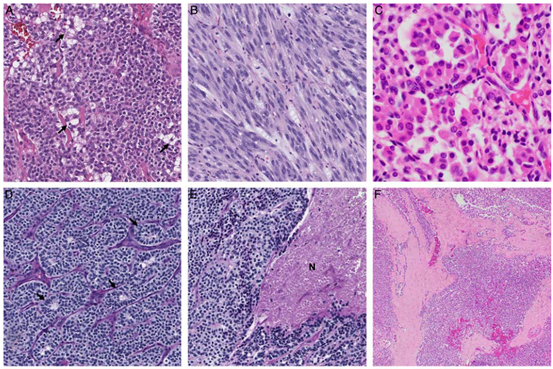
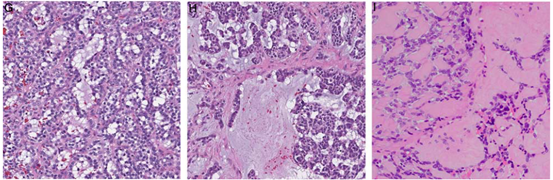
图2.具有GLI 1改变的HN间叶肿瘤的罕见组织学特征。A,假成脂细胞外观,伴有明显的细胞质空泡化(箭头)。B,显著的梭形和束状排列。C,巢状生长呈肺泡状,细胞显示丰富的、密集的嗜酸性细胞质。D,假菊形团(箭头)。E,肿瘤坏死(N)。F,厚纤维间隔。G,微囊/假腺腔。H,突出粘液样基质内的索状排列。I,明显的透明化基质和透明小球。这些特征可能在GLI 1改变的肿瘤中不常见且局灶性存在。
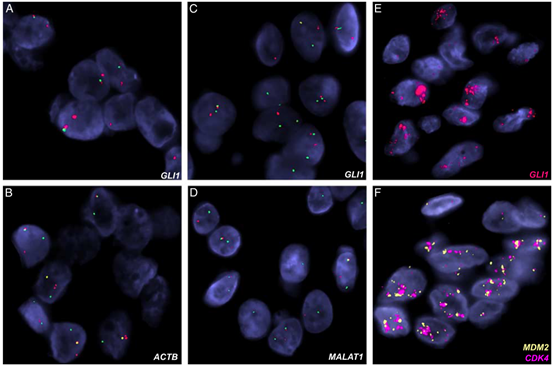
图3.使用FISH证实了GLI 1的改变。具有ACTB-GLI 1融合的肿瘤,显示GLI 1(A)和ACTB(B)断裂分离信号(红色,着丝粒;绿色,端粒)。具有MALAT 1-GLI 1融合的肿瘤,显示GLI 1(C)和(D)MALAT 1基因重排,具有分裂信号(红色,着丝粒;绿色,端粒)。病变包含高水平的GLI 1(红色,E)、MDM 2(橙色,F)和CDK 4(红色,F)基因共扩增。
表1.具有GLI1基因改变的HN和其他部位的肿瘤文献综述
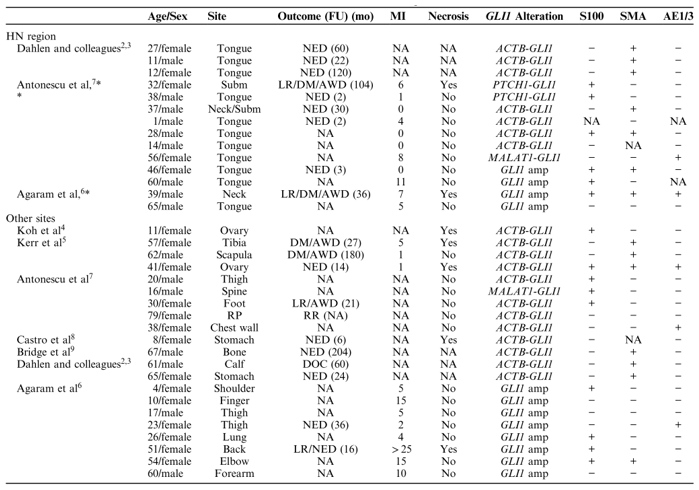
备注:-,阴性;+,阳性; AE 1/3,细胞角蛋白AE 1/AE 3; amp,扩增; AWD,患病存活; DM,远处转移; DOC,死于其他原因; FU,随访; LR,局部复发; MI,核分裂指数(/10 HPF); NA,不可用; NED,无疾病证据; RP,腹膜后; RR,区域复发; subm,颌下腺。
讨论
GLI1基因异常,包括GLI1基因融合和GLI1扩增,最近在一个具有独特上皮样特征的软组织肿瘤亚组中报道显示具有巢状结构和局部区域或远处转移的倾向。尽管GLI 1融合阳性肿瘤通常为S100蛋白阳性,但研究显示GLI 1、MDM 2和CKD 4基因共扩增的肿瘤的免疫谱变化更大,不显示特定的分化谱系。特别有趣的是这组软组织肿瘤和所谓的伴有“t(7;12)易位的血管周细胞肿瘤”之间的发病关系,表现出相似的形态学特征,但这种病变经常发生在舌部,经常表达SMA,并与良性临床过程有关。为了进一步分析,本研究进行了详细的对HN区域携带GLI1基因异常的大量病例进行临床病理和分子分析。
在迄今为止报告的35例GLI 1改变的间叶肿瘤病例中(表1),14例(40%)发生在HN区域。引人注目的是,GLI 1阳性HN肿瘤好发于舌,当前队列中73%的病例和所有报告病例的79%(11/14)发生在该部位。其他罕见的部位包括下颌下腺和颈部软组织。尽管当前队列中男性占优势,但在报告的病例中,所有研究中心的总体性别分布相当均衡。此外,报告的35例患者的就诊年龄范围相当宽(范围:1~79岁),但最常累及30多岁的患者(中位数:37岁)。同样,在HN队列中,诊断时的中位年龄为38岁(范围:1~65岁)。1例离群病例为ACTB-GLI 1易位1岁男性发生的舌肿瘤,该肿瘤自出生时就被诊断出来,是迄今为止报告的唯一先天性/婴儿病例。
GLI1阳性肿瘤,包括起源于HN区域的肿瘤,具有几个共同的组织学特征,如多结节生长模式、由纤细丰富的分支状毛细血管网络分隔的独特巢状结构、具有透明或嗜酸性细胞质和圆形至卵圆形核的单形细胞形态学,以及肿瘤巢经常突出到扩张的血管间隙中。识别这些病理学镜下特征(如图1所示)可以指导病理学家进行适当的诊断和后续的分子检测(如需要)。
在最初报道的伴有t(7; 12)易位的血管周细胞瘤,5例携带ACTB-GLI 1融合体的肿瘤显示出一致的SMA和层粘连蛋白阳性免疫特征,但没有S100蛋白或角蛋白AE 1/AE 3反应性。根据免疫学特征和超微结构的发现,作者推测肿瘤表现为血管周细胞分化。然而,最近发现这些肿瘤的免疫特征变化更大,不能作为确定性细胞系分化的标识。在迄今为止报告的36例病例中,包括同时存在GLI 1融合和扩增的病例,SMA、S100蛋白和角蛋白AE 1/AE 3免疫阳性的累积频率分别为42%(14/33)、44%(15/34)和15%(5/33)(表1)。此外,肿瘤通常呈弥漫性CD 56阳性,但神经内分泌(突触素和嗜铬粒蛋白)、肌上皮(GFAP和h-钙调蛋白)、血管(CD 31和ERG)、SOX 10和肌源性((desmin, myogenin,和myoD 1)标记物呈阴性。此外,S100蛋白表达的普遍存在和角蛋白阳性的偶尔存在似乎反对血管(肌)周细胞起源。此外,真正的血管周肿瘤,如血管球瘤或肌周细胞瘤,对SMA、肌源性特异性肌动蛋白和h-钙调蛋白呈阳性,对角蛋白、S100蛋白和结蛋白呈阴性,具有明显的遗传变异。
鉴别诊断
在HN区域内,由于该肿瘤可能发生在儿童和大唾液腺中,鉴别诊断包括原发性唾液腺上皮肿瘤,特别是涎腺母细胞瘤和肌上皮癌。涎腺母细胞瘤是一种罕见的婴儿期涎腺肿瘤,通常含有原始肿瘤细胞的类器官结构,具有圆形至卵圆形的核仁。然而,它缺乏GLI 1改变的肿瘤的透明胞质特征和纤细血管网络,并且可能显示导管分化和/或腺样囊性癌样模式的区域。涎腺母细胞瘤的分子发病机制仍不清楚。值得注意的是,在通过FISH测试的1例涎腺母细胞瘤病例中未检测到GLI 1基因改变。最近,ACTB-GLI 1融合也被报道在胃母细胞瘤,是一个独特的角蛋白阳性双相分化肿瘤,主要发生在儿童和年轻人的胃。
由具有重叠的多小叶生长、巢状上皮样形态、透明细胞质(图2 H)和S100/角蛋白免疫阳性,其他可能的鉴别诊断还包括肌上皮瘤和肌上皮癌。然而,与本队列的浸润性/多结节生长相比,肌上皮瘤边界清楚/包膜完好。然而,具有GLI 1改变的肿瘤的有价值的诊断线索包括分离巢状结构的丰富血管网、肿瘤膨胀到血管间隙以及缺乏SOX 10、GFAP和钙调蛋白免疫阳性。识别具有GLI1基因改变肿瘤典型特征的区域应继续行分子确认,因为在唾液腺肌上皮癌中尚未报告GLI1基因改变。此外,与多形性腺瘤不同,多形性腺瘤显示出导管和肌上皮分化的双相表型,而本研究所有的GLI1基因改变肿瘤均由单一种细胞类型组成。鉴于巢状生长模式和弥漫性CD56免疫阳性,还需要鉴别HN区的副神经节瘤。免疫组化缺乏突触素和嗜铬粒蛋白的表达可排除此诊断。
外胚间叶软骨粘液样肿瘤是另一种具有GLI 1基因改变肿瘤的鉴别诊断。GLI1基因改变肿瘤是一种罕见的间叶性肿瘤,其特征是明显好发于舌背前部,具有多分叶生长模式,S100、CD56、细胞角蛋白和SMA免疫阳性。然而,外胚间叶性软骨粘液样肿瘤通常表现为梭形细胞形态学,丰富的粘液样基质,缺乏分支状毛细血管网络,并可能表现为S100、CD56、细胞角蛋白和SMA的表达其他肌上皮标志物(例如,钙蛋白和GFAP)。在分子水平上,肿瘤具有特征性的RREB 1-MKL 2融合,因此分子检测可用于鉴别此病例。
如本研究先前所观察到的,GLI 1扩增的肿瘤通常显示附近基因的共扩增,包括STAT 6、CDK 4和/或MDM 2,导致STAT 6、CDK 4和/或MDM 2蛋白过表达,可通过免疫组织化学检测。基于这种免疫组织化学特征,鉴别诊断还包括孤立性纤维性肿瘤和去分化脂肪肉瘤,这是由于STAT 6阳性和MDM 2或CDK 4的FISH过表达/基因扩增分别重叠所致。这两种肿瘤在HN部位亦均有报道。然而,GLI 1阳性肿瘤通常缺乏CD 34阳性或分化良好的脂肪肉瘤区域,并具有其独特的形态学特征。
在伴有“t(7;12)血管周围细胞肿瘤”的原始报道中,患者遵循良性临床过程,没有复发和/或转移。然而,最近的一系列包括GLI 1基因融合或GLI 1扩增的肿瘤,已经记录了这些肿瘤恶性行为的可能性,包括局部复发和转移。在20例有随访资料的病例中,4例(20%)局部复发,1例(5%)区域淋巴结转移,4例(20%)远处转移。4例远处转移中3例核分裂指数≥5个/10HPF和肿瘤坏死。Kerr等报道的第4例肿瘤显示核分裂指数为1/10HPF,无肿瘤坏死,但在初次切除后2年发生肺远处转移。而无远处转移的7例肿瘤中仅1例(14%)核分裂率≥5个/10HPF,无远处转移的10例肿瘤中仅3例(30%)有坏死。这4例远处转移肿瘤的潜在分子改变是不同的,2例ACTB-GLI 1融合,1例PTCH 1-GLI 1融合,第4例GLI 1扩增。
起源于HN区域的肿瘤遵循相似的临床过程:9例报道病例中有2例(22%)发生局部复发和远处转移。这2例病例起源于舌外,1例来自下颌下腺,另1例来自颈部。两个肿瘤都有较高的核分裂指数(6~7个/10 HPF)和肿瘤坏死。一个含有GLI 1扩增,而另一个含有PTCH 1-GLI 1融合。所有6例舌肿瘤患者和可追踪的临床随访在末次访视时均无疾病。虽然目前的证据似乎表明,核分裂活性升高,肿瘤坏死和口腔舌外的解剖位置可能与侵略性行为相关,需要更大的系列与更长的随访时间,以确定是否可根据这些病理特征来确定是否存在具有GLI 1基因改变。
与其他软组织部位相似,HN肿瘤中的GLI1致癌激活可能通过与各种(ACTB、PTCH 1或MALAT1)基因融合或通过染色体12q13.3上的GLI1基因扩增以及附近基因例如STAT 6(12q13.3)、DDIT3(12q13.3)、CDK4(12q14.1)和MDM2(12q.15)的共同扩增而发生。在这项研究中,与GLI融合阳性的肿瘤相比,HN区域发生的GLI 1扩增肿瘤与显著更大的年龄相关。然而,来自35例已发表病例的汇总数据显示,这2个分子组中无显著年龄差异(双尾t检验,P=0.736)。GLI1扩增和GLI1易位肿瘤诊断时的中位年龄(范围)分别为42.5(4~65岁)和32(1~79岁)。此外,其他临床、组织学、免疫表型特征和结局在2个分子组之间没有差异。累积的证据表明,这些肿瘤可归为“具有GLI 1改变的未知谱系肉瘤”。
靶向hedgehog通路的几种抑制剂,包括GLI抑制剂(例如,三氧化二砷、吡非尼酮和咪喹莫特)目前已被美国食品和药物管理局(FDA)批准,或可用于各种临床试验,以治疗白血病、基底细胞癌和其他类型的癌症。因此,在这种独特的肿瘤实体中鉴定GLI 1改变和致癌激活可能允许患者,特别是那些有远处转移的患者,以获得hedgehog或GLI1靶向治疗。
总结 本研究报道了HN区域发生的11例GLI 1基因变异的间叶性肿瘤,这是迄今为止该实体最大的队列。研究表明,在HN区域,舌部是最常见肿瘤发生部位。与其他软组织部位相似,HN GLI 1阳性间叶肿瘤的特征在于独特的组织学特征,包括多结节生长、上皮样细胞的巢状结构(具有透明细胞质和均匀的卵圆形至圆形核)和纤细分支状毛细血管网络。这些肿瘤中GLI 1致癌激活的机制通过与各种基因融合或通过GLI 1基因位点的高水平扩增而发生,通常导致12q13.3-q15区域的其他相邻基因的共扩增。新发现的证据表明,这些病变至少应被视为低度恶性肉瘤,局部复发率为20%,区域和远处转移,特别是与令人担忧的组织学特征相关。这类肿瘤的恶性行为似乎与GLI 1基因改变的类型无关。
点此下载原文献



















共0条评论