1、病例资料:
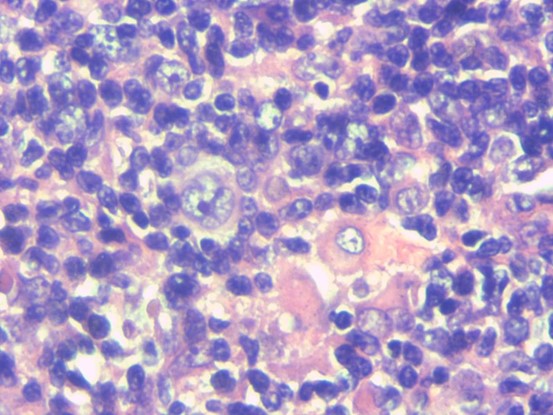
患者男性,66岁。患者2019年确诊HIV,目前口服TDF/3TC/EFV抗病毒治疗,服药依从性好。患者1个月余前无明显诱因出现乏力、纳差,伴间断畏寒、怕冷,大便不成形,约2-3次/天,伴粘液,无脓血,偶咳嗽,无痰、头痛、腹痛、恶心、呕吐,患者未重视,未积极治疗。后患者感乏力、纳差进行性加重,仍有畏寒、寒战,遂来就诊。查体:消瘦,贫血貌,神志清楚,精神极差,全身可见大量散在皮疹,大部分结痂,无破溃及渗血、渗液,左颈部可扪及多个肿大淋巴结,双肺无干湿啰音及哮鸣音,腹部平坦,全腹无压痛及反跳痛,双下肢凹陷性水肿,左下肢明显,病理征阴性。胸部CT提示:双肺散在少量结节状、斑片状不均匀密度增高影,部分边界欠清。双侧锁骨上窝、纵膈内及双侧腋窝内淋巴结增大增多,增强后呈均匀强化。患者患病以来精神、食欲极差,体重下降5kg,患者发热病因不明,全身多发淋巴结肿大,考虑淋巴瘤,行左颈部淋巴结切除活检。病理诊断:
术后予以ABVD方案进行化疗,第二周期化疗已结束,经治疗患者未再发热,精神、食欲好转。
2、讨论:
霍奇金淋巴瘤(HL)是儿童和成人患者中最容易治愈的癌症之一。原发疾病预后良好,估计5年生存率超过98%,然而,由于复发或难治性疾病和治疗方案的后期效应,长期总生存率仍然很低。目前美国癌症协会的统计报告显示,目前所有HL患者的5年相对生存率约为87%。
HL以英国医生Thomas Hodgkin命名,他在1832年首次描述了这种疾病,他指出这种未知疾病的特征是无痛性淋巴结肿大。1856年,Samuel Wilks注意到脾肿大也是该疾病患者的常见症状。最后,两位病理学家(Carl Sternberg和Dorothy Reed)描述了独特的多核细胞,这些细胞现在以他们的名字命名里-斯(Reed - Sternberg [RS]细胞)。他们的发现有助于消除当时医学界普遍持有的观念,即霍奇金淋巴瘤仅仅是结核病的一种形式(因为这两种疾病通常表现为盗汗、体重减轻、发烧和淋巴结病)。
流行病学:
HL有时被错误地归类为主要是成年恶性肿瘤。这可能部分是由于其双峰年龄分布,其中包括青少年和年轻人(15-35岁)的发病率高峰和老年人(55岁以上)的发病率高峰。平均诊断年龄39岁。HL在婴儿、幼儿和青春期前患者中非常罕见,但它仍然是15-19岁年龄组中最常见的儿童癌症。在美国,HL约占儿童癌症总数的7%,占儿童癌症死亡的1%。
风险因素和病因:
HL没有明确的病因,但有许多危险因素可能使个体易患恶性肿瘤。例如,有免疫缺陷的患者,如获得性免疫缺陷综合征(AIDS),以及那些因实体器官或干细胞移植而处于免疫抑制的患者,发生HL的风险更高(尽管免疫缺陷的个体实际上发生非HL的风险高于HL,并且HL不被认为是艾滋病定义的恶性肿瘤)。
EB病毒(EBV)阳性也被确定为HL的一个致病因素。事实上,在一些HL患者的RS细胞中已经检测到EBV遗传物质。EBV影响全球90%至95%的成年人,并与约1%的癌症和三分之一的HL病例相关。然而,只有一小部分感染EBV的患者最终发展为淋巴瘤。因此,除病毒本身外,其他生物学或流行病学决定因素很可能在该病的发展中起作用。家族史似乎也是HL发病的一个决定因素。一项研究发现,HL家族史是儿童HL发病的独立危险因素,HL患者的一级亲属患HL的总体终生累积风险是一般人群的3倍。
临床表现和症状:
无痛性淋巴结病是HL最常见的初始表现,约80%的儿科患者可见。HL伴发的淋巴结通常坚硬且呈橡胶状,最常见于颈椎、锁骨上和/或腋窝区域,偶尔也出现在腹股沟区域。除淋巴结病变外,近75%被诊断为HL的儿童还会出现纵隔肿块。纵隔肿块可以出现在任何年龄,但在12岁以上的儿童中更为常见。纵隔肿块患者可能伴有呼吸困难或吞咽困难。这些患者有快速呼吸衰竭和/或失代偿的风险,也有上腔静脉综合征的风险。
B症状是HL患者的另一个常见症状。这些症状包括疲劳、发热、盗汗、厌食和/或体重减轻(诊断前6个月内体重减轻≥10%)。虽然这些症状通常与HL相关,但它们并不是恶性肿瘤的典型症状,因为它们可以出现在许多其他疾病的患者中。
HL的病理生理学和分子生物学:
HL是一种复杂的多因素淋巴源性恶性肿瘤,约占所有淋巴瘤诊断的15%,主要涉及B细胞(尽管1-2%的病例涉及T细胞)。这些淋巴细胞起源于淋巴结的生发中心,该疾病的特征是存在独特的、单核的霍奇金细胞和巨大的、多核的RS细胞(统称为HRS细胞),在广泛和复杂的炎症背景中很少见。虽然霍奇金细胞和RS细胞都是异常淋巴细胞,但它们的形态外观不同,并且都对HL具有高度特异性。RS细胞通过不完全的细胞分裂和再融合从霍奇金细胞不断发育而来。尽管HRS细胞是CHL的标志,其特征是不能表达B细胞特异性基因,尤其是免疫球蛋白(Ig)重链基因,因此不能产生抗体。多种机制(如EBV感染)激活抗凋亡核因子κB(NF-κB)转录因子信号通路,激活该通路可防止缺陷淋巴细胞凋亡,促进RS细胞增殖。
CHL的HRS细胞表现出不同类型造血细胞标记物的复杂共表达,包括B细胞转录因子PAX5的表达。遗传分析研究证实,HRS细胞是转化的B细胞,因为它们具有B细胞特有的Ig重链和轻链V基因重排,以及与生发中心(GC)经历的B细胞相关的体细胞突变。此外,IgV基因破坏性突变的检测表明HRS细胞来源于凋亡前的GCB细胞。值得注意的是,一小部分CHL病例可能归因于T细胞起源。HRS细胞表达CD30标记物,并表现出与正常CD30+ B细胞相似的关键特征,包括突变的IgV基因、类别转换和MYC的表达。虽然凋亡前GCB细胞向HRS细胞的转化过程尚不清楚,但逃避程序性细胞死亡似乎是一个至关重要的早期事件。有趣的是,突变削弱BCR表达的病例通常与EBV感染有关。此外,EBV感染的HRS细胞表现出较低的突变负荷,表明病毒基因表达替代了癌基因和抑癌基因突变,支持EBV在EBV+CHL中的致病作用。HRS细胞中B细胞程序的下调涉及多种因素,包括转录因子失调、免疫逃避和表观遗传沉默。值得注意的是,CHL缺乏明确的遗传病变,遗传改变的组合可能导致这种疾病的独特性。HRS细胞依赖于几种信号通路的异常组成活性,包括NF-κB、JAK/STAT和PI3K/AKT, NF-κB通路的高组成活性对HRS细胞存活至关重要。CHL病例中最常见的突变涉及这些信号通路的调节因子,包括NF-κB因子REL、TNFAIP3、SOCS1和STAT6。多种受体,如CD30和CD40,通过NF-κB传递促生存和促增殖信号,这表明它们可能参与HRS细胞信号传导。
HL的分类:
世界卫生组织根据形态学和免疫组织化学特征将HL分为CHL和NLPHL两大类。
CHL是更常见的类型(占HL病例的90-95%),通常表现为急性、侵袭性疾病。恶性HRS细胞的存在是CHL的标志,肿瘤细胞表达CD15、CD30,不表达CD45。根据结构、细胞表面标记物、霍奇金细胞和RS细胞的百分比或密度以及背景炎症浸润的数量,将CHL进一步分为4个组织学亚型,包括结节硬化型HL、混合细胞型HL、淋巴细胞丰富型HL和淋巴细胞消减型HL。
混合细胞型CHL(MCCHL)发病率占所有CHL的20-25%,中间发病年龄为38岁,70%为男性。常见部位为外周淋巴结,结外如脾脏也可累及,但一般不侵犯纵隔。肿瘤呈弥漫生长模式,正常淋巴结结构通常完全消失,但有时也可见只累及滤泡间区(可能属于早期病变),间质轻度纤维化,但无包膜增厚,无胶原纤维束形成。典型的HRS细胞散在分布于大量炎性背景细胞中,包括小淋巴细胞、嗜酸性粒细胞、中性粒细胞、组织细胞和浆细胞。有时上皮样组织细胞显著增生、聚集,类似肉芽肿。
肿瘤细胞丰富的MCCHL较罕见,仅占所有CHL的3.1%,肿瘤细胞数量多,即肿瘤细胞数量大于病变细胞总数的10%。肿瘤细胞形态可包括各种形态的HRS细胞及间变细胞样大细胞,病变背景及免疫表型与普通MCCHL相同。值得强调的是,复发的CHL有时可表现出形态学的进展,尤其是在先前治疗的部分,可出现肿瘤细胞数量和多形性增加,需与肿瘤细胞丰富的MCCHL进行鉴别。肿瘤细胞丰富的MCCHL临床特征(如性别、发病年龄、B症状、皮肤瘙痒及浅表淋巴结受累状况)与普通MCCHL无明显差异,但纵隔淋巴结受累、脾脏受累、结外侵犯(非淋巴器官)及临床分期Ⅲ~Ⅳ期比例均高于MCCHL。
鉴别诊断:
(1)间变性大细胞淋巴瘤(ALCL):瘤细胞与MCCHL在形态学上有重叠,都可能找到间变细胞性大细胞及RS细胞样细胞,且二者免疫组织化学都表达CD30。MCCHL肿瘤细胞弱表达PAX5,不表达颗粒酶B、EMA、LCA、ALK及T细胞标志物,而ALCL则相反。此外,EB病毒阳性也支持MCCHL的诊断。(2)特征介于弥漫大B细胞淋巴瘤与CHL之间不能分类型B细胞淋巴瘤:该瘤组织形态和MCCHL有时很难鉴别,但该瘤常见弥漫纤维性间质,肿瘤的不同区域表现出不一样的细胞形态,如有的区域类似于CHL,有的区域类似弥漫大B细胞淋巴瘤,坏死易见,免疫表型该肿瘤LCA强阳性,CD20、CD79a常阳性,且三者常同时阳性,这些都是MCCHL所没有的特征。MCCHL罕见表达LCA。(3)原发纵隔大B细胞淋巴瘤(PMBL):极少数情况下PMBL形态学可呈多形性或RS细胞样表现,此时需与MCCHL鉴别。MCCHL常累及纵隔,二者均多见于青年人,PMBL免疫组织化学弥漫表达CD20、CD79a和LCA,且常同时阳性,而在MCCHL中未见三者同时阳性,少数病例CD20仅局部阳性或弱阳性,罕见表达LCA,CD79a全部阴性。EB病毒阳性支持MCCHL。(4)免疫缺陷相关的B细胞淋巴组织增殖性疾病:极少数情况下,它可能与MCCHL形态相似,甚至有相同的免疫表型。所以,当肿瘤细胞EB病毒阳性时,临床免疫缺陷病史是这二者鉴别的关键。(5)外周T细胞淋巴瘤,非特指型:肿瘤细胞呈弥漫增生,常混有炎性背景细胞,有时可见很多HRS样细胞,且表达CD30,但肿瘤细胞大小呈一谱系,同时表达CD3等T细胞抗原,一般不表达CD15,PAX-5阴性,分子检测有克隆性TCR基因重组。(6)传染性单核细胞增多症:好发于15-25岁,淋巴结结构部分消失,常有坏死,可见残留反应性滤泡,增生的副皮质区或滤泡间区由大小不等的反应性细胞组成,常有浆细胞分化,有时可见大量免疫母细胞,或有局部散在HRS样细胞。HRS样细胞可弱表达CD30,但CD15阴性。EBER检测可见大量阳性细胞,多为小细胞或大小不等细胞,血清学检测可证实新近EBV感染。
病例图片:
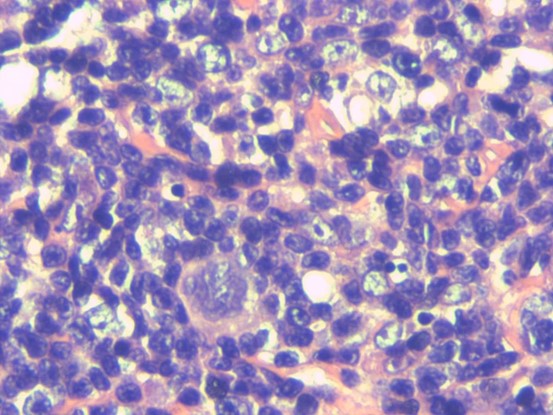
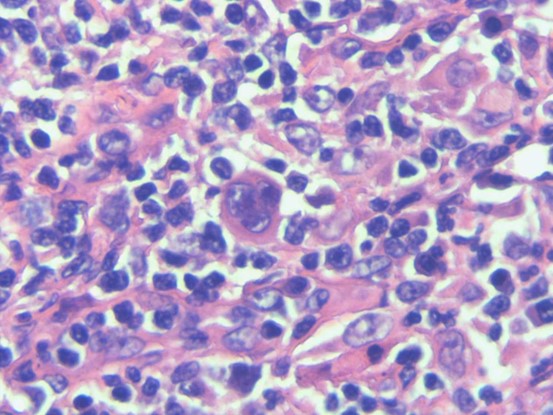
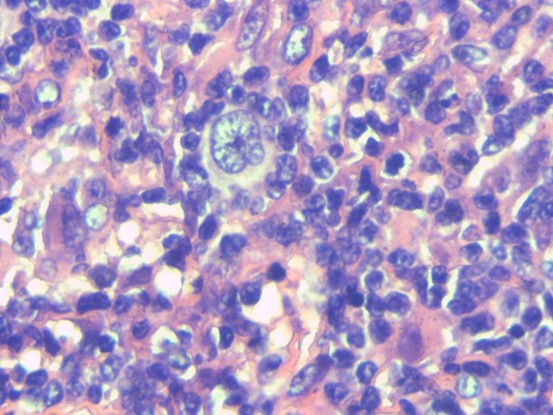
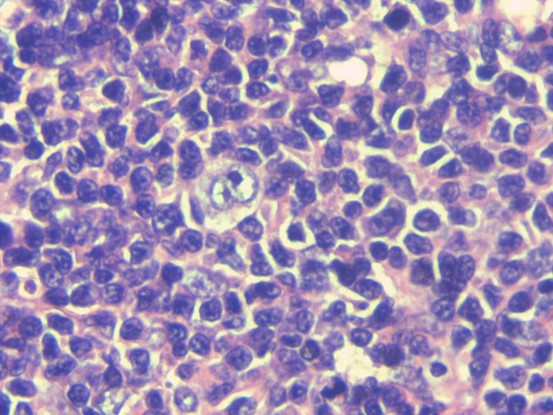
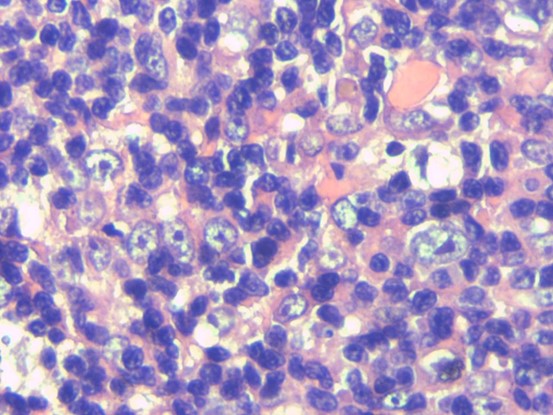
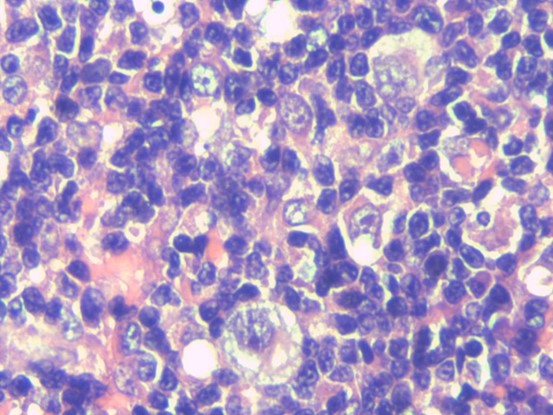
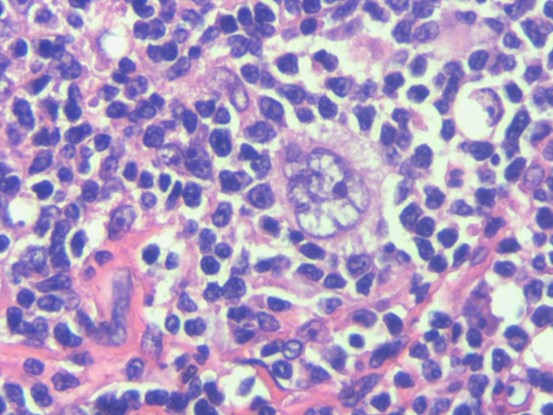
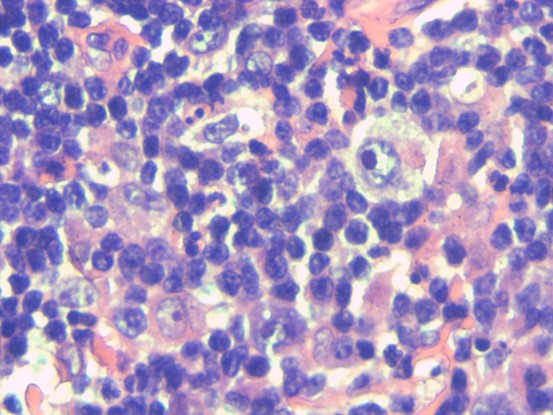
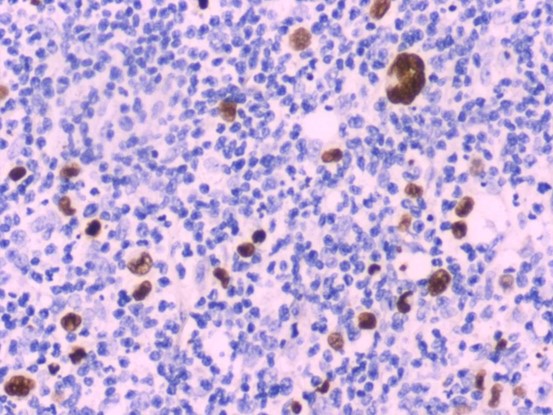
EBER(+)
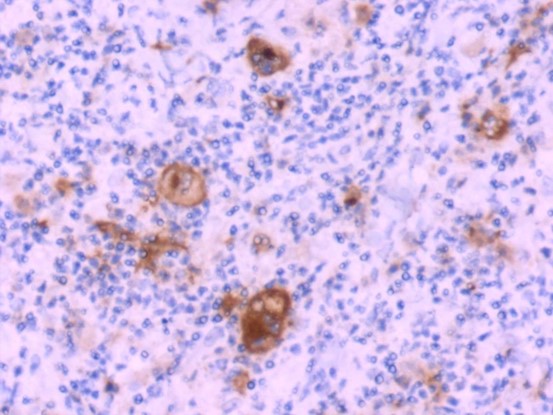
CD30(+)
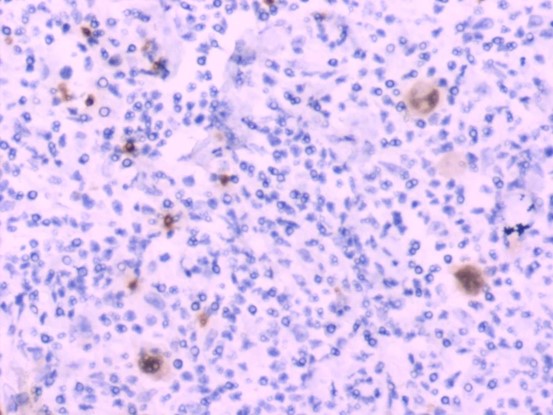
PAX-5(弱+)
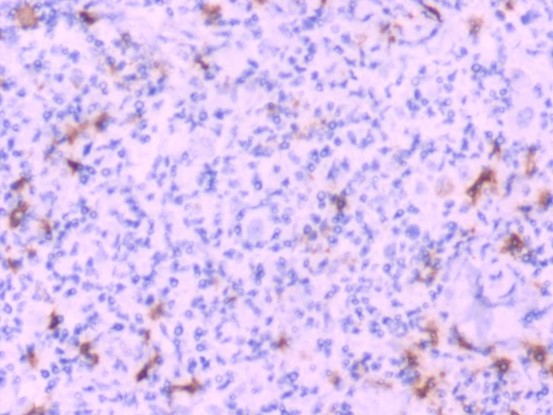
CD20(-)


























共0条评论