[导读] 作者:游乐园
1、临床资料
患者男性,51岁。因咽部疼痛不适,来我院行健康体检时发现右侧甲状腺结节,甲状腺超声显示右侧叶见一无回声结节,大小约2.5x2cm。血甲状腺功能检查无异常,血肿瘤标志物未见异常。为明确结节性质行甲状腺肿物切除术并送病理检查。病理诊断:(右侧甲状腺肿物)具有乳头状核特征的非浸润性甲状腺滤泡性肿瘤。
2、讨论
具有乳头状核特征的非浸润性甲状腺滤泡性肿瘤(NIFTP)是一种起源于滤泡上皮细胞的具有包裹性或边界清楚的非浸润性滤泡性肿瘤,伴滤泡性生长模式和乳头状核特征,无完整的乳头状结构和砂粒体,无任何甲状腺乳头状癌侵袭性亚型的征象及低分化癌表现。通常认为NIFTP是“恶变前”的病变,属于交界性肿瘤范畴,2017年前被称为非浸润性包裹性滤泡型甲状腺乳头状癌(NI-EFVPTC)。在欧美国家,NIFTP占所有甲状腺乳头状癌(PTC)的9.0%-37.9%,50%以上的滤泡型甲状腺乳头状癌(FVPTC)均属于此种类型。术后组织石蜡切片病理学检查是确诊NIFTP的金标准,术前检查及术中冰冻切片均无法明确诊断。
甲状腺滤泡上皮细胞的乳头状核特征一直被认为是诊断FVPTC最可靠的指标,但随着近年来甲状腺癌病理亚型研究的深入,FVPTC是否具有包膜以及包膜是否被浸润在其诊断及预后的评估中越来越受到重视。早在20世纪80年代中期就发现了包裹性FVPTC(EFVPTC),但由于经典型乳头状癌也具有包膜,且病理学检查中肿瘤侵犯包膜或脉管极易被漏诊,因此EFVPTC被归类为PTC而非滤泡性腺瘤。21世纪初,随着甲状腺相关病理诊断逐渐标准化,切尔诺贝利病理学工作组建议将具有乳头状核特征的非浸润性包裹性甲状腺肿瘤列入“恶性潜能未定的高分化肿瘤”,同时其他专家也质疑此类肿瘤是否应判定为恶性。2006年,纪念Sloan-Kattering癌症中心根据FVPTC有无包膜将其分为非包裹性FVPTC(IFVPTC)和EFVPTC,EFVPTC又可分为浸润性EFVPTC(I-EFVPTC)和NI-EFVPTC,发现其中IFVPTC淋巴结转移率为65%,而EFVPTC仅5%,约11年的随访中NI-EFVPTC无1例复发。随后该研究组从分子水平验证了基因突变对甲状腺滤泡上皮肿瘤生物学行为的影响,认为EFVPTC的分子特征不同于其他类型FVPTC,与滤泡性腺瘤或滤泡癌更相似。国际多学科工作组根据该争论热点,重点评估了210例EFVPTC患者,其中NI-EFVPTC患者109例。尽管半数以上的NI-EFVPTC患者仅行单纯腺叶切除术,且所有NI-EFVPTC患者均未行131I治疗,但术后随访10-26年所有患者均无复发或转移。因此,该工作组提出用NIFTP替代NI-EFVPTC,以示该亚型与癌的区别,并推荐对此类患者行甲状腺腺叶切除术。这项研究成果在2015年美国和加拿大病理学会(USCAP)年会上首次提出,2016年发表在JAMA Oncology杂志上,获得甲状腺肿瘤领域研究人员的极大关注。2017年世界卫生组织第4版内分泌肿瘤分类把这一组织亚型独立出来,划入甲状腺交界性肿瘤范畴。
SEER数据库的数据显示,美国甲状腺癌的发病率在过去30年间增加了2倍,但死亡率并未增加,这主要是因为甲状腺癌发病率的增加归因于PTC病例的增加,且大多新诊断的PTC是惰性的。2017年之前,这些惰性的PTC往往按传统PTC进行治疗管理,NIFTP命名的提出是减少惰性甲状腺癌过度治疗的重大举措。在NIFTP这一术语提出之前,已有多篇文献报道NI-EFVPTC患者即使仅行甲状腺腺叶切除术,术后预后也很好。且2015年美国甲状腺协会也推荐对这一类患者仅行甲状腺腺叶切除术,术后无需放射性碘治疗。删除名称中的“癌”字既减轻了患者及其家属的心理压力,也减轻了患者的经济负担,同时患者随访次数减少也节约了医疗资源。FVPTC不同的形态与转归常引起临床上诊断和管理的争议,IFVPTC常转移至颈部淋巴结,而EFVPTC相对惰性。将NIFTP从EFVPTC中分离出来后,FVPTC淋巴结的转移风险升高,病理诊断对预后的判断将更加准确。由于NIFTP曾属于低危性分化型甲状腺癌,NIFTP被剔除后低危性分化型甲状腺癌及FVPTC复发和转移风险的相应数据会升高。尽管这一术语的更改在甲状腺肿瘤领域具有重要意义,但在亚洲地区NIFTP的发生率远低于欧美国家(6.3%vs37.9%)。Bychkov等报道亚洲地区NIFTP仅约占PTC的0.3%,对分化型甲状腺癌的诊疗影响较小。
NIFTP可以通过体格检查或影像学检查发现,但术前诊断敏感性不高,超声检查也没有特异性表现。Yang等认为IFVPTC常表现为低回声、边界不清、微钙化或纵横比>1,且大多无血流信号,而NIFTP常伴有低回声晕圈且边界清楚,无侵袭性甲状腺癌的相关征象(如淋巴结转移、腺外侵犯、微钙化、纵横比>1、毛刺状、微小分叶状等),两者不易混淆。但I-EFVPTC与NIFTP表现相似,均具有丰富血流信号,难以鉴别。目前,甲状腺影像报告和数据系统、ATA超声分类等均难以区分NIFTP与I-EFVPTC。超声特征直方图参数分析有助于区分NIFTP与IFVPTC,但对NIFTP与I-EFVPTC的鉴别无明显作用。
甲状腺细针穿刺细胞学(FNAC)检查中NIFTP的主要特征为微滤泡结构及乳头状核特征,包括核大、核拥挤、轮廓不规则和核染色质明显等。因为其缺乏完整的乳头状结构和砂粒体,核内包涵体也少见,一定程度上能与CPTC的细胞进行区分。如果形态上难以区分CPTC和NIFTP,也可从分子水平加以鉴别。但由于肿瘤细胞浸润需术后石蜡病理切片观察才能判定,所以FNAC检查中NIFTP与I-EFVPTC的表现相似,即使结合18F-脱氧葡萄糖正电子发射断层显像也无法进行区分。尽管超声表现结合细胞学检查结果对提高NIFTP术前诊断率作用并不明显,但命名的更改影响了甲状腺细胞病理学分级系统(TBSRTC)中各级别的恶性风险。Bongiovanni等对15项研究中的915例NIFTP进行meta分析,发现NIFTP的FNAC检查结果主要为III级(意义不明确的非典型性病变/滤泡性病变)、IV级(滤泡性肿瘤/可疑滤泡性肿瘤)和V级(可疑恶性肿瘤),分别占比30%、21%和24%。这也使得TBSRTCIII/IV/V级的肿瘤恶性风险分别下降19.1%-45.0%、11.4%-46.0%和20.5%-41.5%,进而降低了用于预测细胞学结果为III/IV级的肿瘤良恶性的相关商品化产品如ThyroSeq V2、ThyGenX/ThyraMIR等的诊断价值。
乳头状结构的特征为纤细的纤维血管轴心周围富含乳头状核特征的甲状腺滤泡上皮细胞,至少1个纤维血管轴心两侧各有不少于3个的具有乳头状核特征的滤泡上皮细胞才能定义为乳头状结构。Nikiforov等于2016年的诊断标准中定义NIFTP的滤泡性生长模式指“<1%乳头状结构,无砂砾体,<30%实性、小梁状或岛状生长模式”。2017年我国病理学专家刘志艳建议采用“不含乳头状结构”的标准,并推荐实际病理工作中对于非浸润性包裹性甲状腺滤泡性病变首先可评估甲状腺乳头状癌细胞核特点,如确定则诊断为NIFTP,如不确定则参考NIFTP细胞核评分系统进行评估,评分0-1分诊断为滤泡性腺瘤,2-3分诊断为NIFTP。多项研究也报道了<1%乳头状结构的NIFTP具有一定的淋巴结微转移倾向。为进一步完善NIFTP的诊断,2018年Nikiforov等将“<1%乳头状结构”更改为“无完整的乳头状结构”。
多数研究表明NIFTP患者为BRAF基因野生型,但也有少数研究报道7%-29%的NIFTP患者存在BRAF V600E基因突变,但进一步分析后发现这些突变型患者具有乳头状结构或包膜浸润。乳头状结构与BRAF V600E基因突变、淋巴结转移甚至是远处转移相关,且随着乳头状结构占比增加,BRAF V600E突变率亦增加。2018年,Nikiforov等增加了BRAF V600E突变相关的NIFTP诊断次要标准,同时作者提出对于乳头状核特征评分达3分的患者,应注意仔细评估肿瘤边界及乳头状结构以减少误诊。NIFTP最常见的基因突变类型为RAS突变,占30%-54%,PAX8/PPARG融合也较为常见,但NIFTP通常无PTC原癌基因RET(RET/PTC)重排或端粒酶反转录酶(TERT)启动子突变。
Hung等认为由于难以评估最大径<5mm结节的乳头状结构,不建议诊断此类微小结节为NIFTP。嗜酸细胞性NI-EFVPTC同样属于FVPTC。Xu等通过对61例嗜酸细胞性NI-EFVPTC进行随访发现均无转移和复发,认为也可划入NIFTP以减少嗜酸细胞性NI-EFVPTC的过度治疗。也有报道称miRNA可以作为NIFTP的有效分子标志物,但仍有待更深入的研究。尽管NIFTP被纳入了WHO内分泌肿瘤分类,但我国多数医疗机构仍未将此甲状腺癌病理亚型分类标准应用于临床,亚洲地区也未普及NIFTP的诊断。
2015年ATA指南推荐对NI-EFVPTC患者行甲状腺腺叶切除术,术后无需131I清甲治疗,促甲状腺激素(TSH)控制在0.5-2.0mU/L。命名更改后ATA工作小组认为由于缺少前瞻性研究的相关证据,NIFTP的治疗方式与原先一致,但可以减少术后血清甲状腺球蛋白及颈部超声的监测频率。2018年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐对NIFTP患者行患侧甲状腺腺叶切除+峡部切除术,术后每6-12周行血清甲状腺球蛋白及抗甲状腺球蛋白抗体检测,TSH水平可控制于低水平或正常范围。我国2012年的《甲状腺结节与分化型甲状腺癌诊治指南》认为,原发灶≤4cm的NI-EFVPTC属于甲状腺腺叶+峡部切除术的相对适应证,在有效保留甲状旁腺和喉返神经的情况下,推荐行同侧中央区淋巴结清扫术。目前我国尚无NIFTP治疗指南推荐,采取何种手术方式及是否应行预防性中央区淋巴结清扫将成为争议的热点。由于术前无法确诊NIFTP,Lindeman等提出可使用FNAC的细胞学病理结果来确定手术方案,FNAC提示III-IV级的患者选择行甲状腺腺叶切除术,恶性风险更高的V-VI级患者更倾向于首选甲状腺全部切除术。Cho等和Parente等推荐按低危PTC的标准进行NIFTP术后患者的随访。如果遵照此建议,那么按照我国2012年的指南,患者术后1年内TSH应控制在0.1-0.5mU/L,若无明显的TSH抑制治疗不良反应,1年后可调整至0.5-2.0mU/L。然而,Rosario等认为用PTC的模式来管理NIFTP不太合理,不仅增加了检查成本还可能存在大量假阳性的结果导致不必要的治疗,由于NIFTP诊断标准严格且预后良好,如果超声未检测到甲状腺残余结节,建议按滤泡性腺瘤进行随访。Nikiforov等的多中心回顾性研究发现,相比于IFVPTC约4.95%的远处转移率以及约12%的复发率,NIFTP患者均无复发或转移,在儿童和青少年患者中也未发现转移。2016年至今的研究中,仅约2%的NIFTP患者发生颈部淋巴结转移,且均位于颈部中央区,大多是单一淋巴结受累的微转移(<2mm),几乎无远处转移和复发风险。肿瘤的大小被认为与NIFTP的诊断和预后无关,但Parente等报道了1例结节大小为6.4cm的NIFTP发生了肺转移。该研究的纳入标准为无乳头状结构的NIFTP,作者认为因病理石蜡切片本身具有一定厚度,未发现肿瘤浸润并不意味着肿瘤具有惰性行为。
由于目前超声分辨率无法检测到NIFTP患者残余甲状腺的超微癌(<3mm),而PTC超微癌也可发生转移,从而可能会导致NIFTP患者中央区淋巴结转移的假阳性结果。回顾性研究的肿瘤样本质量会存在一定差异,如果标本取材部位代表性不足则可能将PTC误诊为NIFTP,同样可导致NIFTP转移的假阳性结果。所以Rosario等认为现有的研究并不能完全说明NIFTP的转移能力,未被发现的PTC微癌和被误诊为NIFTP的PTC均可使NIFTP报道的转移复发风险高于其实际水平。
惰性甲状腺癌的识别对甲状腺的治疗与管理具有重要影响,如果超声发现甲状腺相关恶性征象可排除NIFTP。FNAC检查结果为TBSRTCIII/IV/V级,基因检测为RAS突变型而无BRAF V600E突变、RET/PTC基因重排、TERT启动子突变等高危突变,则可考虑NIFTP的诊断,但仍须术后石蜡切片病理学检查才能确诊。虽然超声、细胞学检查和基因检测在一定程度上有助于NIFTP的诊断,但易与I-EFVPTC混淆,还需进一步寻找更为有效的诊断方式。因为NIFTP术前诊断敏感性不佳,命名更改前后治疗管理模式并无重大改变,但手术方式更为保守,术后TSH抑制治疗的标准降低,不良反应减少,同时患者的随访次数减少,心理负担有所减轻。
病例图片:

图片1
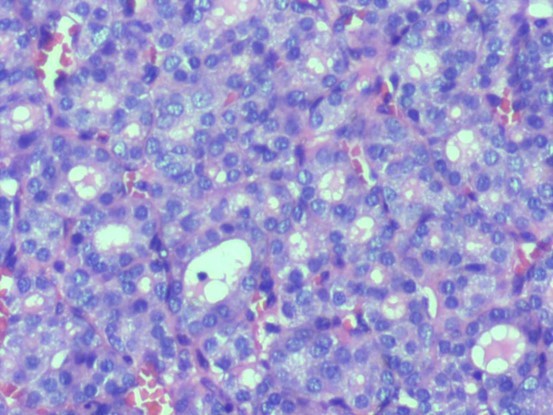
图片2
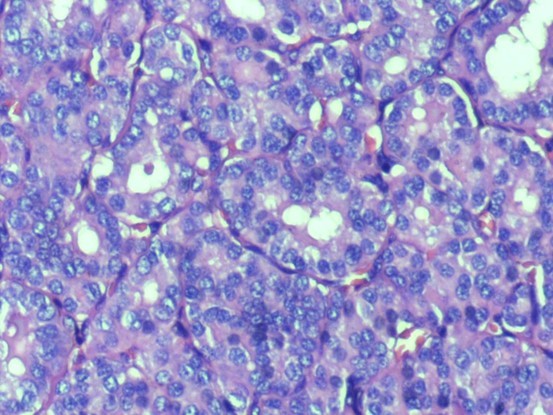
图片3
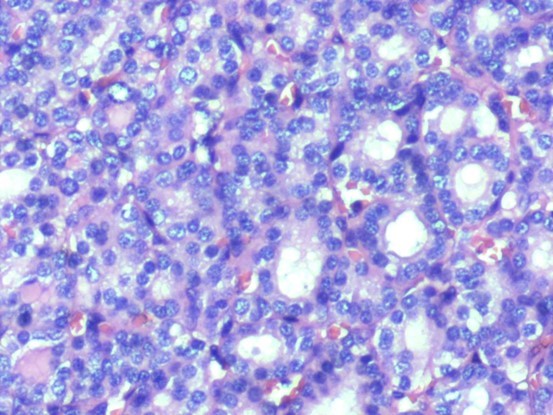
图片4
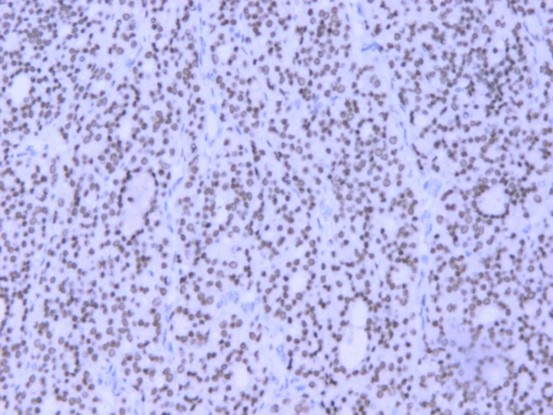
图片5.免疫组化TTF-1(+)
图片6.免疫组化CK19(+)
图片7.免疫组化MC(+)




















共0条评论