[导读] 作者:游乐园
1、临床资料
患者男性,37岁。因发现右颈部包块1个月来我院就诊。患者HIV抗体阳性,既往有冶游史。体格检查:于右颈部可扪及一大小约4x2cm的肿块,质硬,固定,无压痛,无发热、盗汗等。超声检查:右颈部血管鞘外侧可见3.5x2cm的低回声团块,边界清,有包膜回声,形态欠规则,团块内以不均质低回声为主,并见带状稍强回声,无液化及钙化,提示占位性病变,遂行超声引导下经皮穿刺活检术。病理诊断:(右颈部)浆母细胞性淋巴瘤。免疫组化:CD38、CD138、CD79α、MUM-1、EMA阳性,CK、CD20、CD3、ALK、PAX-5、Kappa、Lambda、CD30、HHV8、CD56阴性,Ki-67阳性约70%,EBER原位杂交阳性。
2、讨论
浆母细胞性淋巴瘤(PBL)是一种罕见的高度侵袭性弥漫性大B细胞淋巴瘤,在人类免疫缺陷病毒感染患者中发病率较高(2%-12%)。1997年Delecluse等人首次描述了16例原发于口腔伴有特殊免疫表型的弥漫性大B细胞淋巴瘤病例,其中15例为HIV感染者,这些肿瘤细胞表达CD38、CDl38和CD79a,但白细胞抗原及CD20表达缺失,根据肿瘤细胞的形态和免疫组织学特征,将其命名为浆母细胞性淋巴瘤。在很长一段时间内,认为PBL仅发病于HIV感染者的口腔。近些年,浆母细胞性淋巴瘤报道的病例数逐渐增多,研究显示PBL也可见于HIV阴性、免疫功能低下(如移植后、全身感染、免疫系统疾病等)及其他血液系统疾病转化的患者,免疫功能正常者较为少见。有研究结果显示,HIV阳性与HIV阴性PBL的流行病学特点及预后不同。HIV阳性的PBL中位发病年龄为9-42岁,男女发病率之比为1.5:1;HIV阴性PBL中位发病年龄55-58岁,男女发病率之比为2.29:1。肿瘤好发于口腔,但口腔外也可以发生,包括淋巴结、肝、肠道、皮肤、气管等部位。
PBL的发生机制目前并不明确,可能与病毒感染及基因突变相关。HIV感染患者,由HIV所致的持续严重免疫缺陷、抗原长期刺激诱导B细胞增殖或耗竭、对肿瘤源性的EBV病毒免疫监控缺失、免疫重建不完全等状态可能诱发PBL。EB病毒与PBL发病关系密切,被认为是EB病毒破坏了T细胞介导的细胞免疫,不能有效抑制被EB 病毒感染的B细胞的克隆性增殖,最终形成肿瘤。其他研究报道HHV8感染、c-MYC基因重组、p53、BCL-6基因突变可能促进PBL的发生发展。2008年WHO将其划归为弥漫性大B细胞淋巴瘤的一种罕见亚型,PBL起源于后生发中心,肿瘤细胞保留了部分免疫母细胞的形态学特征,镜下见呈弥漫性增生,为圆形或卵圆形,细胞核大、偏心,可有1个或多个核仁,胞浆呈嗜碱性,肿瘤细胞通常表达浆细胞标志物,如:CDl38、MUMl、CD38、CD79a等,在某些病例中也表达 T细胞标志物,如:CD3和CD5。但肿瘤细胞缺乏典型的B细胞标记物表达,如CDl9、CD20、PAX-5及Bcl-6。EBV可能参与PBL的发生发展,并提示可能与疾病的预后、进展有相关性。在EBV及HIV感染的PBL患者中,较易发现MYC基因重组。部分临床研究报道,近50%的HIV阳性患者出现这种易位,并与预后不良相关。
PBL免疫组化缺乏独特的表型,根据临床表现、形态学、分子生物学很难做出正确的诊断,尤其免疫功能正常、起病于口腔外的患者在诊断方面更具有挑战性。临床上,诊断PBL时尤其需与多发性骨髓瘤(Multiple myeloma,MM)鉴别。MM以浆细胞肿瘤性增殖及产生单克隆蛋白为特征。浆细胞在骨髓内增殖,常导致广泛的溶骨性骨破坏、病理性骨折。大多数患者起病过程中会表现出浆细胞浸润骨 或其他器官的体征或症状,如肿瘤细胞在骨髓内增殖可引起贫血和骨痛,侵犯肾脏时查血肌酐升高,在部分患者肾衰竭可能是首发表现,血清电泳发现单克隆免疫球蛋白,尿液含本-周氏蛋白,但无免疫抑制病史。MM产生过量的单克隆免疫球蛋白轻链并同时抑制另一种轻链的生成,从而使Kappa与Lambda的比值失去平衡,是区分MM与PBL的重要指标。骨髓瘤细胞与正常浆细胞均表达CD79a、VS38c、CDl38和CD38,但很少表达CDl9,大约70%的骨髓瘤细胞会表达CD56,但EBER阴性,通常采用CD38、CD45、CD56、CDl9、Kappa、Lambda、EBER与PBL鉴别。相关研究显示,免疫球蛋白游离轻链不仅可以协助诊断淋巴瘤,还是预测预后的的标记物的预测价值。其次还需与免疫母细胞型弥漫大B淋巴瘤进行鉴别,二者在形态学上有重叠,但免疫表型不同,通常CD20、CD45、PAX-5阳性,EBER阴性。
PBL目前尚无标准的治疗方案,NCCN指南建议参考高度侵袭性淋巴瘤的治疗,推荐强化化疗方案。如:DA-EPOCH、HyperCVAD(大剂量环磷酰胺、表阿霉素、 长春新碱、泼尼松)、CODOX-M(环磷酰胺、多柔比星、长春新碱、甲氨蝶呤),化疗周期为6-8个疗程。尽管初始治疗反应较好,但随后患者会很快复发或发生疾病进展,且强化的治疗方案使患者产生严重的免疫抑制及感染,故有相关研究报道,对于老年、免疫抑制患者,可能不能从强化治疗中获益。基于PBL与MM在免疫组化方面的相似性,2015年Castillo首次报道了3例硼替佐米联合EPOCH治疗PBL,3例患者均维持较长时间的CR状态,生存时间分别为24个月、18个月和12个月。随后开始陆续报道使用硼替佐米联合或不联合化疗治疗PBL,随着报道病例增多,目前认为硼替佐米联合化疗是一种安全有效的治疗方式,因为联合硼替佐米并未增加化疗相关不良反应,化疗后毒性反应仍主要是发热伴中性粒细胞减少、神经病变、感染。对于HIV阳性和阴性患者,均有相关报道提示硼替佐米联合EPOCH或CHOP可延长生存率。有个案报道使用沙利度胺联合地塞米松诱导治疗达CR后行自体造血干细胞移植,随访10年后仍持续达到CR。尽管缺乏充分的研究,基于近些年个案报道,对于初治或难治复发的患者,将硼替佐米、来那度胺、沙利度胺等单独应用或联合其他治疗对维持CR可能有很大的益处。对于HIV感染及非感染者,诸多研究报道提示两者可能存在不同的临床病程和生存期,大部分报道HIV感染者CR率及OS均优于未感染者,这可能和HIV阳性患者进行高效抗逆转录病毒治疗后对机体进行免疫重建,从而使HIV感染患者对化疗有更好的应答率。然而,在HIV阴性患者常合并其他基础疾病可能导致OS更短,如HIV阴性患者多合并高龄、多器官衰竭、移植后排斥反应、免疫抑制引起的感染等,上述共存因素可能使患者化疗中和/或化疗后面临严重的免疫抑制状态、感染、因不能耐受化疗而停药等严峻情况,从而影响预后。
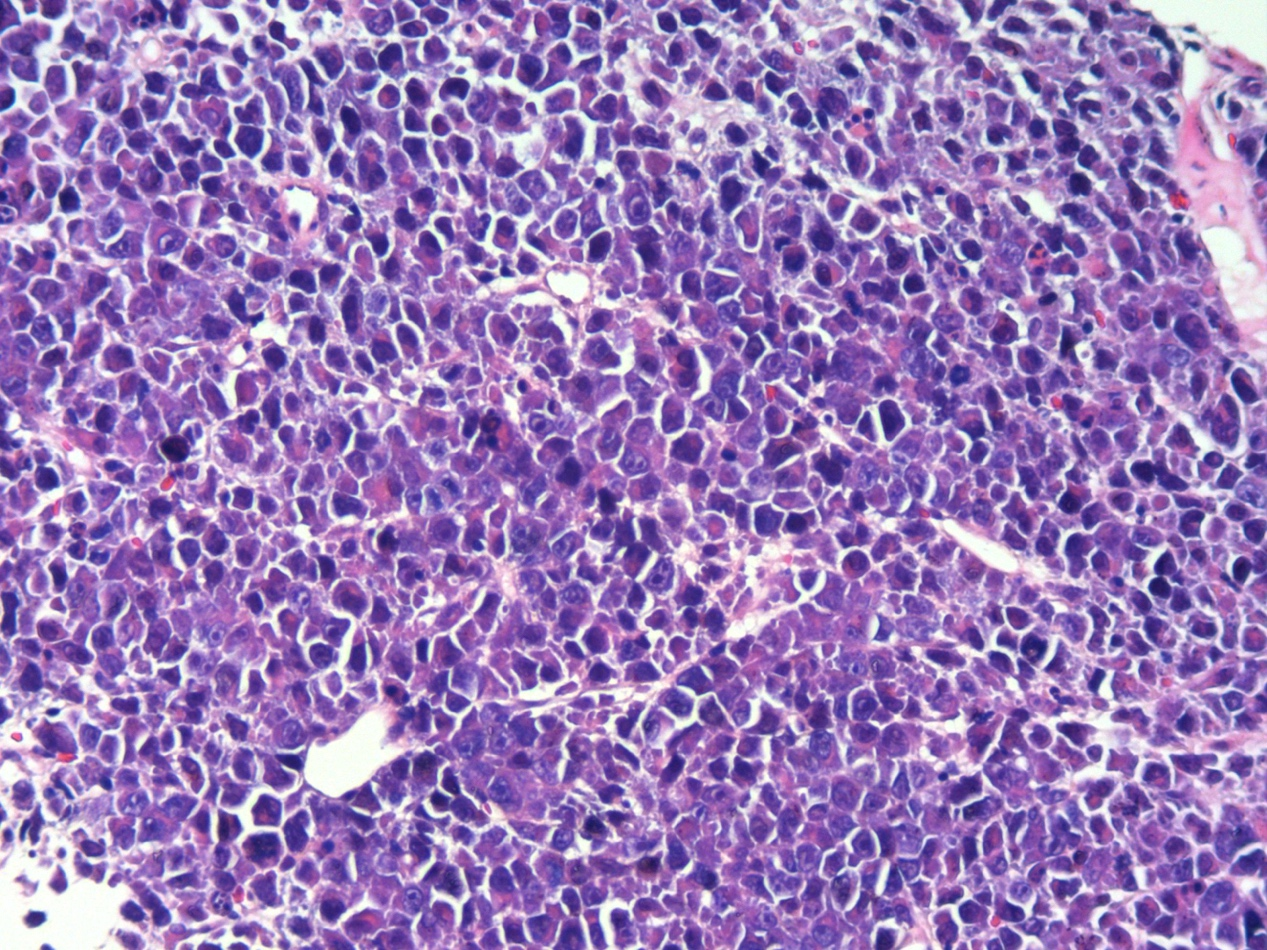 图1.中等偏大的免疫母细胞样肿瘤细胞弥漫性分布
图1.中等偏大的免疫母细胞样肿瘤细胞弥漫性分布
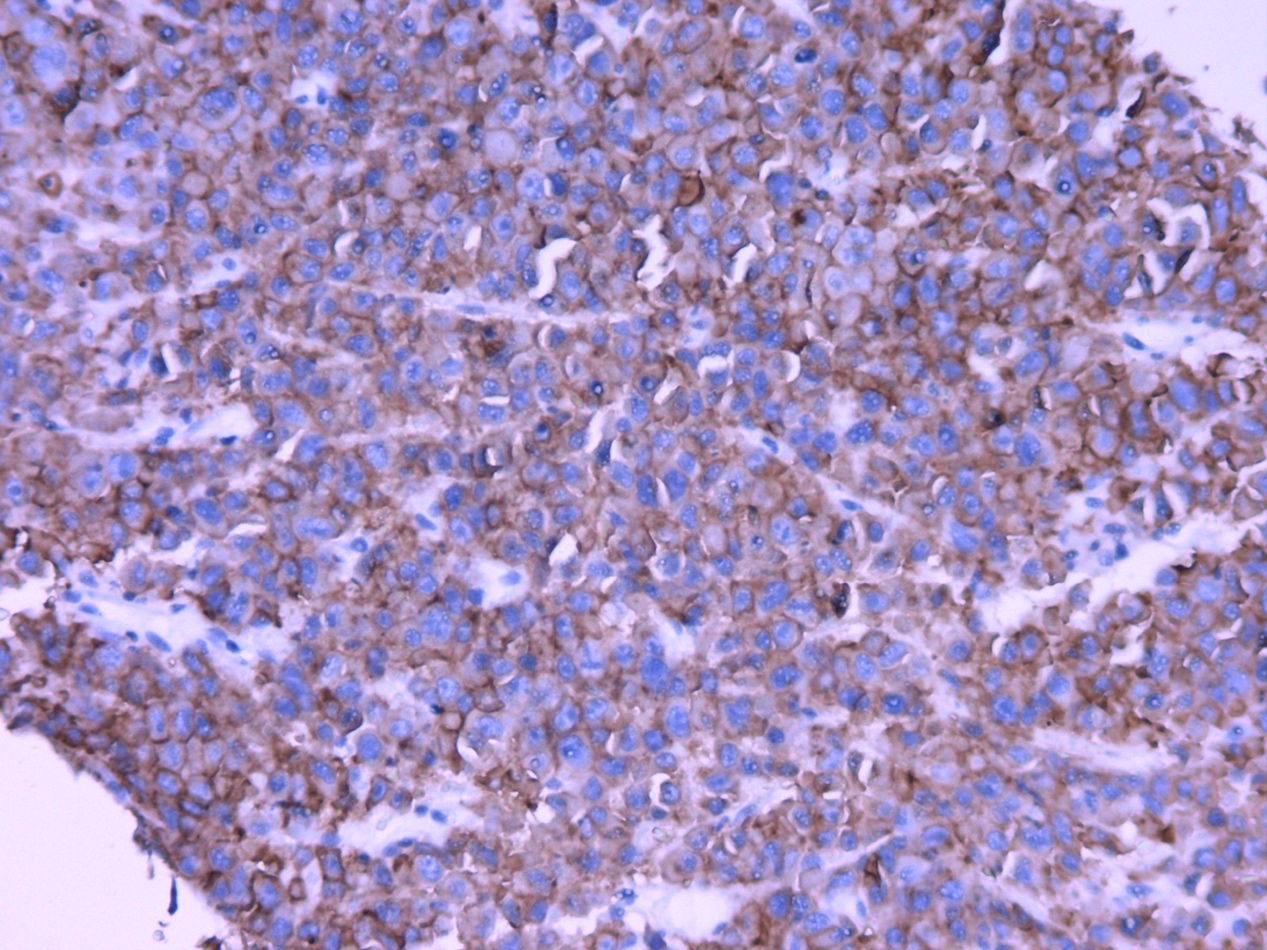 图2.CD138(+)
图2.CD138(+)
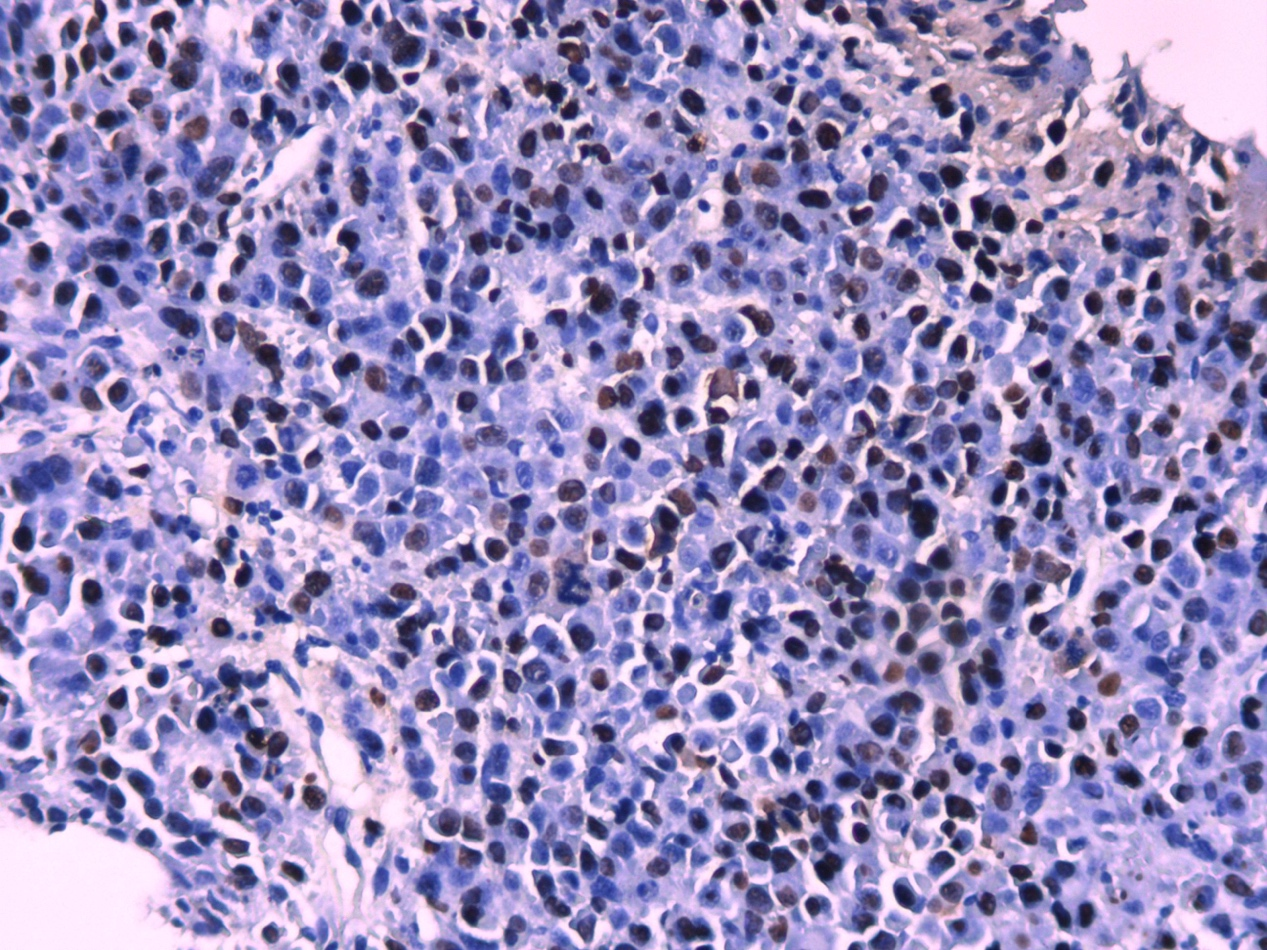 图3.EBER(+)
图3.EBER(+)
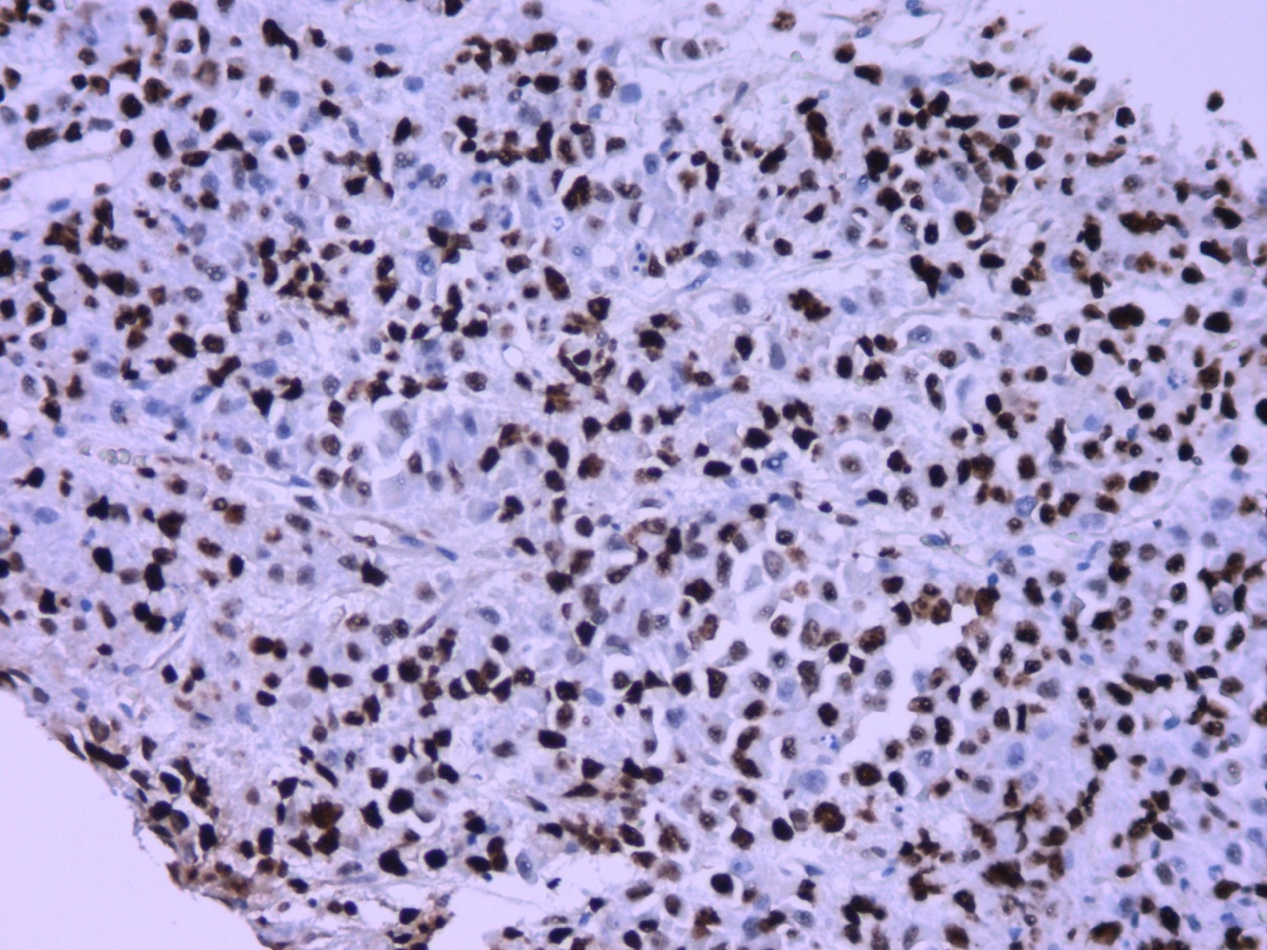 图4.Ki-67约60%+
图4.Ki-67约60%+

















共0条评论