[导读] 译者:张波
摘要 人乳头瘤病毒(HPV)感染粘膜或皮肤表皮。HPV有5个属,200多种类型,每种类型都有特定的亲嗜性和毒力。HPV感染通常是无症状的或导致良性肿瘤,在罕见的情况下可能会扩散或持续存在,少数致癌HPV可导致癌症。本文综述了皮肤和粘膜HPV感染过程中个体间临床变异的人类遗传学和免疫学基础。典型的疣状表皮发育不良(EV)的特征是在具有EVER 1-EVER 2CIB 1依赖性皮肤内在免疫先天性缺陷的患者中发生β-HPV驱动的扁平疣样和糠疹样皮肤病变以及非黑色素瘤皮肤癌。在先天性T细胞缺陷患者中,非典型EV与其他感染性疾病相关。严重的皮肤或肛门生殖器疣,包括肛门生殖器癌,也是由某些α-、γ-、μ或ν-HPV在具有先天性T淋巴细胞和抗原呈递细胞缺陷的患者中驱动的。其他粘膜部位HPV疾病的遗传基础,如口腔多灶性上皮增生或青少年复发性呼吸道乳头状瘤病(JRRP),仍然知之甚少。HPV驱动病变的人类遗传剖析将阐明HPV保护性免疫的分子和细胞基础,从而为患者提供新的诊断、预防和治疗方法。
1.前言
乳头瘤病毒(PV)是一种小型无包膜病毒,具有双链环状DNA基因组。它们具有高度宿主特异性,对皮肤或粘膜上皮细胞表现出严格的亲嗜性,靶向受感染上皮中的干细胞。病毒的生命周期是嗜性依赖的,并与宿主细胞生物学密切相关。PV感染在具有完整内在免疫、先天免疫和适应性免疫的个体中广泛存在,通常无症状或良性和自愈。由国际人乳头瘤病毒参考中心(Papillomavirus Episteme,PaVE)识别出人类PVs(HPV)可分为五个属,超过200种基因型; HPV是普遍存在的,在成人人群中,60-95%的个体对检测的约35种HPV中的至少一种呈血清阳性。
α-HPV显示粘膜和皮肤亲嗜性,它们与皮肤疣(例如HPV 2)、良性粘膜疾病(例如HPV 6和HPV 13)或生殖器和口咽癌(例如HPV 16和HPV 18)相关。相比之下,β-、γ-、μ-和ν-HPV显示严格的皮肤亲嗜性。γ-、μ-和ν-HPV引起良性皮肤寻常疣和足底疣,而β-HPV通常引起无症状感染,但在罕见的疣状表皮发育不良(EV)患者中引起扁平疣样病变。持续HPV感染可导致良性肿瘤,在某些情况下,恶性转化和进展为浸润性癌症。在极少数情况下,γ-和ν-HPV可在皮肤癌病变中发现。α-和β-HPV都含有与癌症低风险和高风险相关的基因型:α-HPV主要是粘膜癌,β-HPV主要是皮肤癌。在一般人群中,高危β-HPV基因型导致宫颈癌,而在EV患者中,高危β-HPV基因型导致非黑色素瘤皮肤癌(NMSC)。不同亚组的α-HPV编码E5早期病毒蛋白,可能导致某些类型α-HPV相关感染的严重程度(皮肤型:E5β;低风险型:E5γ、E5δ;高风险型:E5α)。在获得性T细胞免疫缺陷患者中,无论是由于HIV感染还是免疫抑制治疗,重度HPV感染都很常见,这表明适应性T细胞免疫在控制HPV感染中具有重要作用。与这些发现一致,在人类和动物模型中的研究表明,消退疣的特征在于抗原呈递细胞(APC)和淋巴细胞的浸润,特别是包括CD 4+T细胞,并且在较小程度上包括CD 8+T细胞。我们这里回顾的先天性免疫缺陷与易感性HPV感染的患者没有获得性免疫缺陷。
2.典型和非典型疣状表皮发育不良
在人类遗传学方面研究得最好的HPV疾病无疑是EV。EV于1922年首次描述,是一种皮肤病,特征为β-HPV引起的持续性播散性扁平疣样和花斑癣样病变。EV是一种罕见疾病,2017年全球约有500例患者报告,但在20%-65%的人群中报告了β-HPV血清阳性。典型的EV在没有其他感染的情况下孤立发生,通常遵循常染色体隐性(AR)传播模式。EV通常在婴儿期开始,约30%-40%的EV患者在2-3年后发展为NMSC。在EV病变中至少确定了25种不同的β-HPV。EV患者通常感染多种HPV毒株,但HPV-5在EV病变中最常见,它也是EV患者NMSC病例中最常见的HPV类型,反映了其强大的致癌潜力。
自2002年以来,在58例典型EV患者(26例家族患者)中报告了分别编码EVER 1、EVER 2和CIB 1的TMC 6、TMC 8和CIB 1的双等位基因无定形突变(表1)。已证明EVER和CIB 1蛋白可形成复合物,但对其功能仍知之甚少。这些基因在全身(包括白细胞)广泛表达,但患者的循环白细胞未出现一致异常。典型EV患者具有正常的体液免疫和抗体应答,以及正常的NK细胞活性。在典型EV患者中观察到的持续和严重的β-HPV感染,尽管这些患者的免疫系统基本上完好无损,但表明这些患者未能对β-HPV产生有效的适应性免疫应答。有趣的是,在小鼠和人类中,T细胞活化后,EVER 1和EVER 2受到严格调控,并且EVER 1/EVER 2/CIB 1复合物在APC包括朗格汉斯细胞(LC)中的作用尚未被排除。退化疣中浸润有LC,EV病变中的LC远少于健康皮肤。这一观察结果可能反映了LC迁移到淋巴结,或病毒逃逸机制。迄今为止,仅在因AK 2缺乏导致网状细胞发育不全的患者中报告了人朗格汉斯细胞缺乏症。不幸的是,网状细胞发育不全也会导致多发性血细胞减少症,并且在暴露于HPV之前的最初几周内需要造血干细胞移植(HSCT),因此很难得出关于LC在抗HPV免疫中的作用的任何确切结论。因此,我们不能排除TMC 6、TMC 8或CIB 1的缺陷导致微妙的、尚未表征的T细胞内在或APC内在缺陷的可能性。然而,一个孤立的T细胞的细微损伤是不可能解释典型的EV表型。事实上,在EVER和CIB 1缺陷的患者中,典型EV表型的临床表现在10岁时完全消失,而大多数接受医源性免疫抑制或先天性T细胞缺陷的患者即使在综合征形式中也不会发展EV。因此,EV患者更可能由于角质形成细胞内在或APC内在缺陷导致缺乏适当的适应性T细胞应答而允许β-HPV感染和复制。
由于与锌转运蛋白ZnT 1的相互作用和增强的增殖活性,EVER缺陷型角质形成细胞显示出改变的锌稳态。在CIB 1缺陷患者中未观察到这些特征,表明EVER 1或EVER 2缺陷诱导的锌稳态异常与EV无关。已经表明EVER/CIB 1复合物直接作为HPV的病毒限制因子。与β-HPV不同,α-、γ-、κ-、μ-HPV均表达E5或E8,结构相似的病毒疏水跨膜蛋白体外转化活性较弱。缺乏功能性E8基因的突变型CRPV基因组不会引起家兔病变。因此,E5和E8被认为是人类乳头状瘤形成和α-、γ-或μ-HPV感染的临床表现所必需的。有趣的是,E5(来自HPV 16)和E8(来自HPV-4和CRPV)已显示靶向EVER/CIB 1复合物,并抑制EVER蛋白的锌调节功能。与感染α-、γ-或μ-HPV的个体相比,由于缺乏E5/E8而缺乏对EVER/CIB 1复合物的抑制可能解释了感染这些病毒的健康个体中β-HPV的限制和乳头状瘤形成的缺乏。EVER/CIB 1复合物限制HPV复制的确切机制仍然未知。CIB 1还显示与HPV-5(β-HPV)的E1和HPV 16(α-HPV)的E2相互作用。E1和E2是HPV复制所需的两种主要早期病毒蛋白。研究EVER/CIB 1复合物是否通过与这些蛋白质的相互作用直接限制HPV在角质形成细胞中的复制将是有趣的。尽管β-HPV的患病率非常高,但在病毒生命周期早期通过E1抑制进行的病毒限制与一般人群中一般不存在EV病变形成一致。
EV也可作为综合征的一部分与其他感染一起发生。这种表现被称为非典型EV,在获得性免疫缺陷、医源性免疫抑制或由于严重的T细胞缺陷而患有原发性免疫缺陷的患者中已有报道。在16例STK 4双等位基因突变的患者中,有22例报告了非典型EV、RHOH、CORO 1A、TPP 2、DCLRE 1C、LCK、RASGRP 1、ITK、SMARCAL 1、IL 7或DOCK 8(表1)。1例IKBKG(R254 G)X连锁(XL)亚型突变患者被诊断为EV,而另1例患者患有扁平疣(E331 del 3)。除了它们在免疫细胞中的作用,特别是在T细胞中,这些基因中的一些也在皮肤中表达(表2),并且可能在皮肤内在HPV限制中发挥作用。对典型和非典型EV的遗传病因学的研究表明,有效控制β-HPV感染需要皮肤内在的病毒限制和功能性T细胞适应性免疫应答。
表1.与HPV感染易感性相关的免疫缺陷
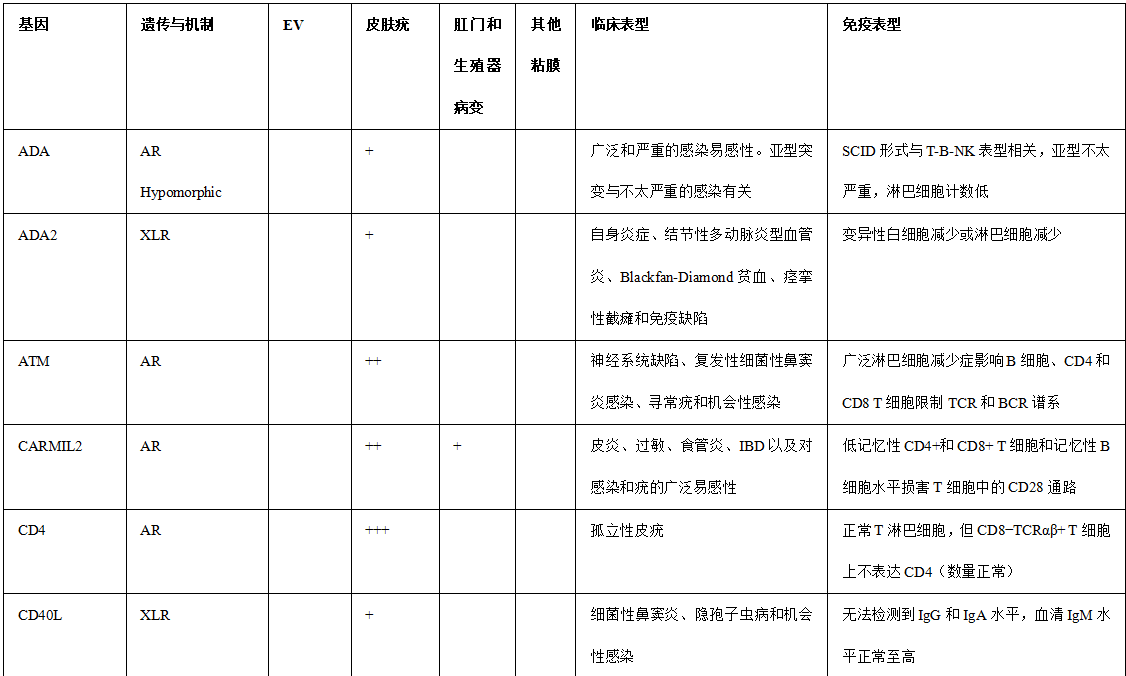
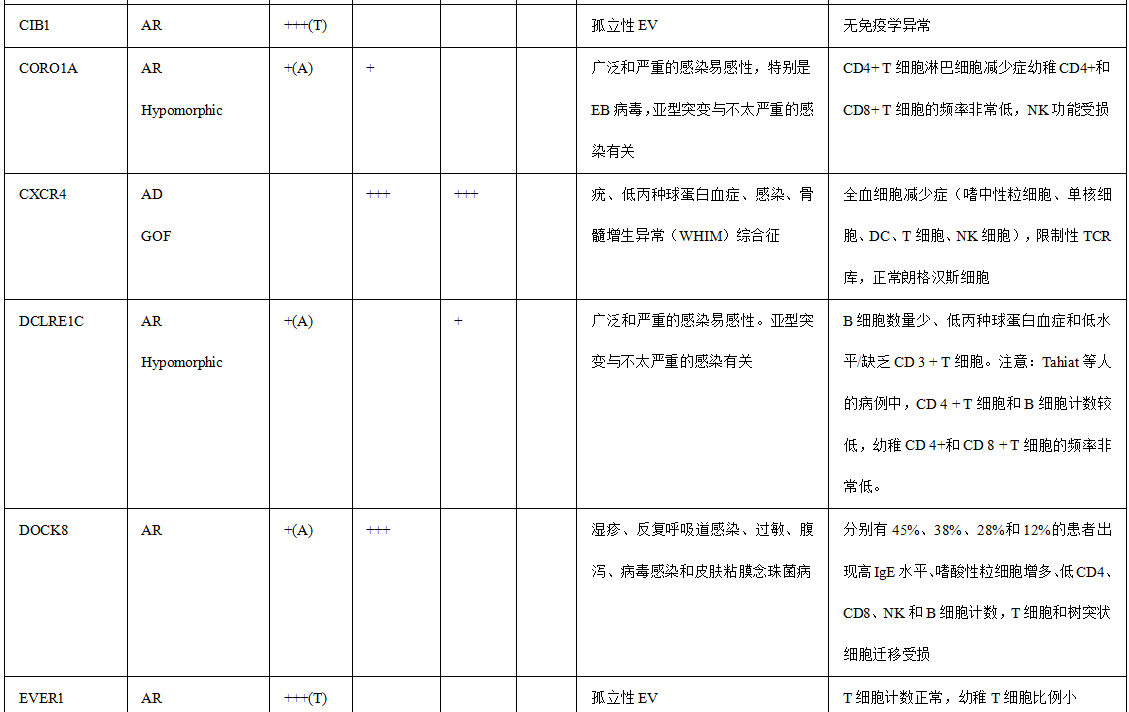
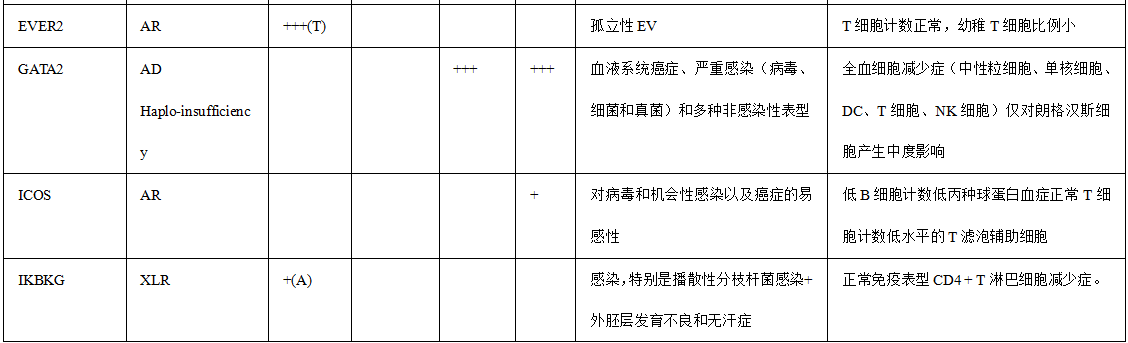
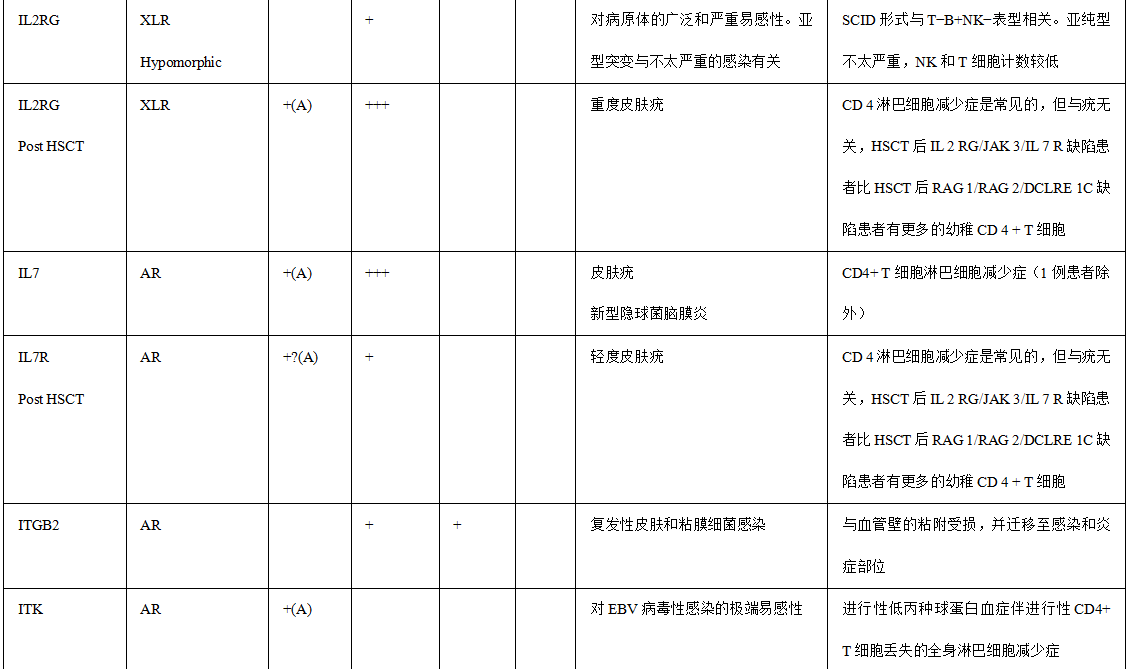
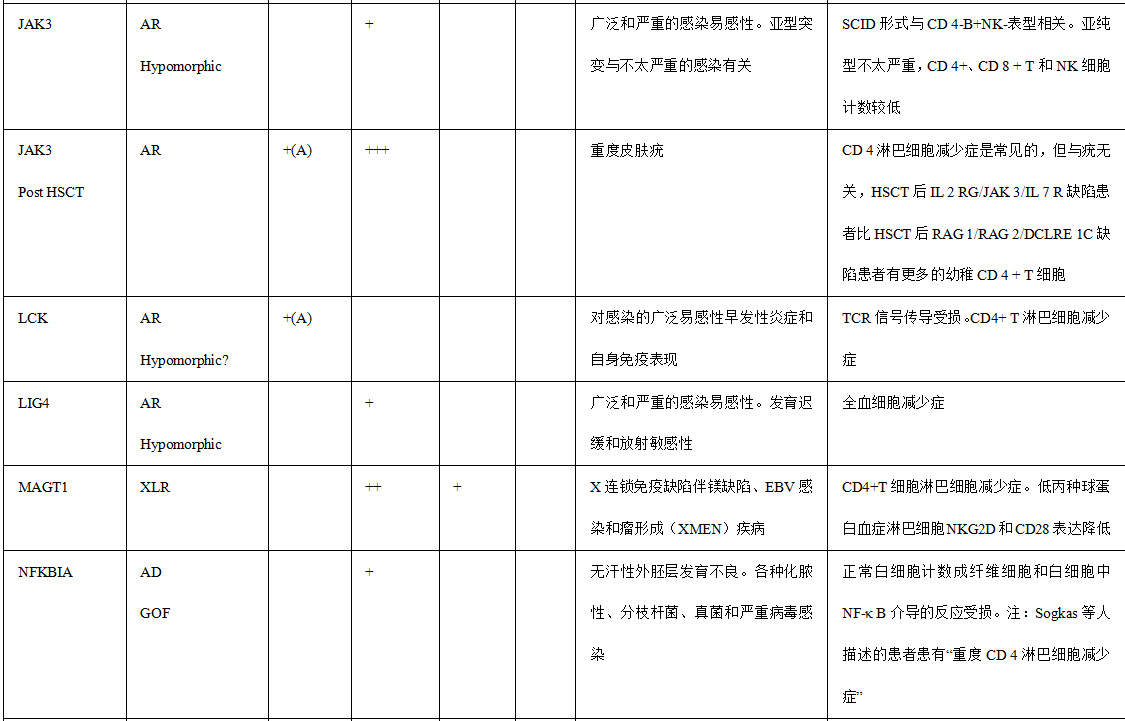
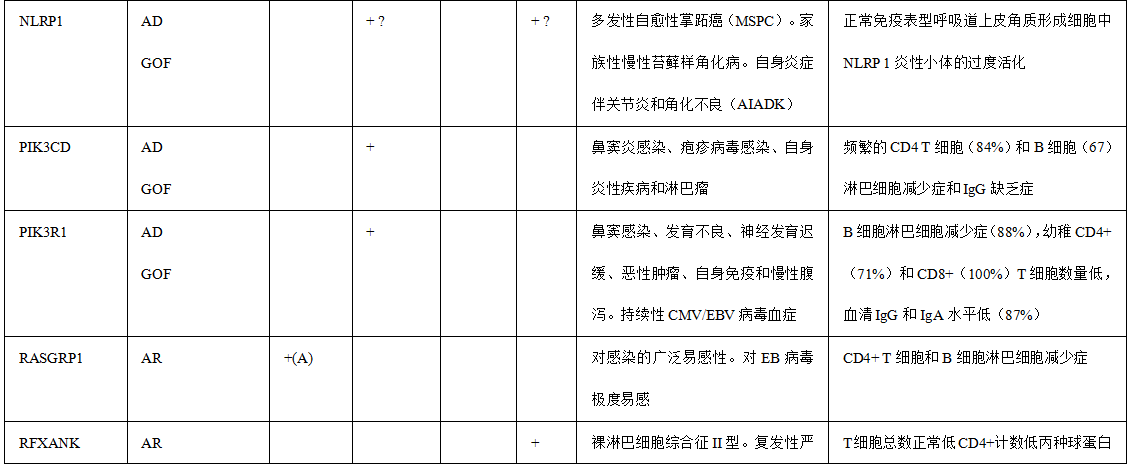
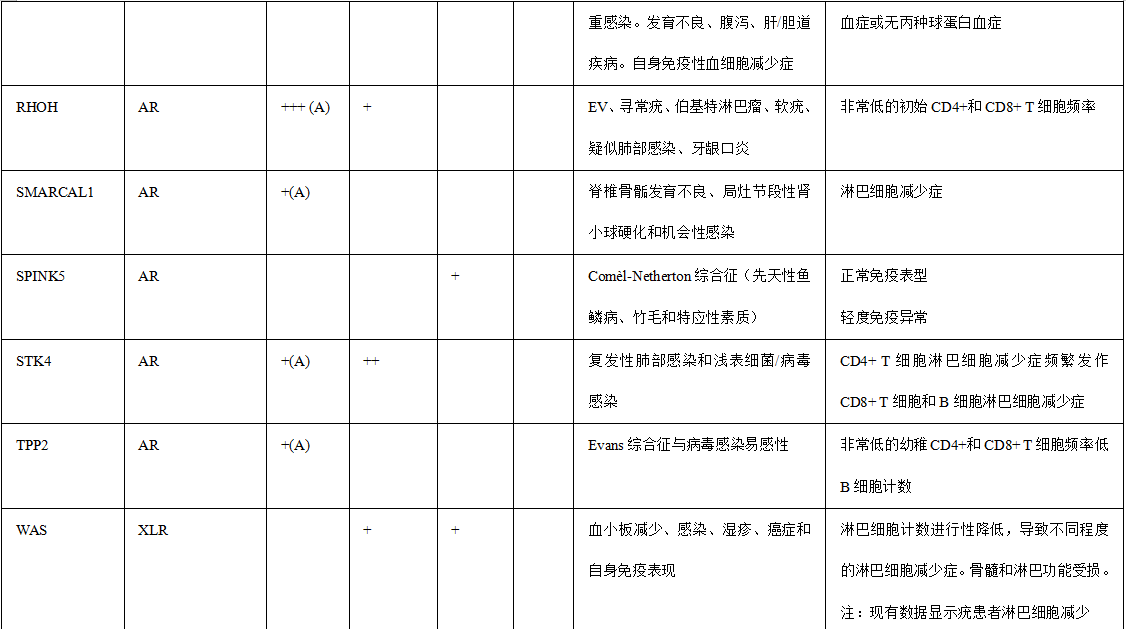
 备注:+ 、+ +和+++对应于HPV疾病在每种遗传缺陷中的相对检出率。+ :低; + +:中等; +:高或完全。值得注意的是,一些遗传性疾病的报告病例很少,并且随着新患者的发现,观察到的遗传性疾病可能会在未来发生变化。AR常染色体隐性,AD常染色体显性,XLR X连锁隐性,GOF功能获得,(A)非典型EV,(T)典型的EV,IBD炎症性肠病,NLRP 1标记有“?”因为HPV DNA在病变中没有被正式鉴定。
备注:+ 、+ +和+++对应于HPV疾病在每种遗传缺陷中的相对检出率。+ :低; + +:中等; +:高或完全。值得注意的是,一些遗传性疾病的报告病例很少,并且随着新患者的发现,观察到的遗传性疾病可能会在未来发生变化。AR常染色体隐性,AD常染色体显性,XLR X连锁隐性,GOF功能获得,(A)非典型EV,(T)典型的EV,IBD炎症性肠病,NLRP 1标记有“?”因为HPV DNA在病变中没有被正式鉴定。
表2.各种原发性和肿瘤组织或细胞中HPV相关基因的mRNA水平

备注:所有值均提取自人类蛋白质图谱(https://www.prote inatl as.org/)。粗体字的基因名称对应于对HPV易感性具有中等或更高突变率的基因。这些值是从人类蛋白质图谱数据库中提取的标准化值。DC树突状细胞、A431皮肤鳞状细胞癌、Hacat自发永生化角质形成细胞、HL-60急性髓性白血病、THP-1前单核细胞白血病、U937组织细胞淋巴瘤、MOLT 4急性淋巴细胞白血病(T)、REH急性淋巴细胞白血病(非T;非B)。颜色代码:白色= 0;红色=最大值。对于原代细胞系和肿瘤细胞系,独立地设定每个基因的最大值
患有严重联合免疫缺陷(SCID)和IL2RG或JAK3缺陷的患者发生严重皮肤HPV感染的风险约为50%,包括EV(44%的HPV病变患者)在成功的HSCT后(表1)。据报告,2例IL 7 RA缺乏的移植患者存在轻度HPV感染。因其他缺陷(如RAG 1、RAG 2和DCLRE 1C)而接受移植的SCID患者没有发生严重疣的风险。这强烈表明,除了T细胞缺陷之外,IL 2 RG或JAK 3缺陷的患者还具有皮肤内在缺陷。角质形成细胞内在缺陷是一种可能性,如角质形成细胞中JAK 3和IL-2 R γ表达的报告所示。最近的一项研究表明,IL 2 RG缺陷型角质形成细胞表现出异常的趋化因子分泌和招募免疫细胞的能力受损。然而,根据人类蛋白质图谱,当对来自皮肤或Hacat细胞(一种自发转化的角质形成细胞系)的总mRNA进行测序时,几乎检测不到编码IL-2 R γ和JAK 3的mRNA(如果有的话)(表2)。此外,在原代角质形成细胞的蛋白质印迹中未检测到IL-2 R γ和JAK 3。然而,HPV感染仍然可能增加角质形成细胞中这两种分子的水平。
或者,表达IL-2 R γ和JAK 3的皮肤和外周受体APC可能无法实现完全供体嵌合,并成为IL 2 RG或JAK 3缺陷患者HSCT后HPV易感性的基础。LC可能就是这种情况,其分化不受IL 2 RG或JAK 3缺陷的影响。这一假设是合理的,因为移植受者在移植前只接受弱条件反射,或根本不接受条件反射,这是由于SCID中排斥反应的风险低。与这一假设相一致,(1)尽管没有明确的证据表明人LC产生IL-2 R γ蛋白,但已显示DC、巨噬细胞和单核细胞表达IL-2 R γ或对IL-2 R γ依赖性细胞因子应答(表2);(2)低强度条件反射不会导致LC的显著消耗;(3)在大多数情况下,接受移植的SCID患者的所有髓系细胞都是受体来源(59%)或受体/供体混合来源(41%);(4)LC具有自我更新的潜力,并且在肢体移植后,该群体存在供体来源的残留物;以及(5)如果小鼠LC未被同种异体T细胞清除,尽管外周血淋巴细胞主要是供体骨髓细胞来源,但在HSCT后,它们不会被替换。最后的观察结果很重要,因为它表明,即使是完全的外周供体嵌合体也不一定反映皮肤中完全的供体LC嵌合体。一项人体研究报告了在接受HSCT治疗白血病的成人患者中长期存在混合LC嵌合体。另一项成人研究报告了癌症HSCT后1年所有受者均出现完全供体LC嵌合体,但接受低强度预处理的患者中完全供体嵌合体的发生时间晚于接受全强度预处理的患者。在最后一项研究中,HSCT后1年100%的患者实现了髓室的完全供体嵌合体,反映了相对于SCID患者的预处理程序的重要差异。
LC于1868年首次描述,但其在免疫中的确切作用尚不清楚。它们的战略定位表明在皮肤抗病毒免疫中发挥重要作用,几项研究表明HPV已经形成了逃避LC的机制。IL-2 R γ在LC中的确切功能知之甚少。该分子在骨髓细胞中的主要作用已在其他地方进行了综述。特别是,IL-15(一种IL-2 R γ依赖性细胞因子)在体外促进人单核细胞分化为LC样细胞,最近的一项研究表明,IL-2 R γ表达是小鼠中DC将IL-15转表达至CD 4 +T细胞所必需的。成熟后,人LC已显示上调IL-2 R α(CD 25)和IL-2 R β,表明这些细胞可能在特定条件下对IL-2刺激产生应答。对JAK 3/IL 2 RG SCID患者在HSCT后有或无疣的其他研究可能为T细胞非依赖性皮肤内在抗HPV免疫提供重要观点。
3.皮肤疣
皮肤疣是由HPV诱导的皮肤病变,包括寻常疣、扁平疣和足底疣。不同类型的皮肤疣具有不同的临床和组织学特征。寻常疣、扁平疣和足底疣通常与来自α属的HPV-2、3、10、27和57,来自γ属的HPV-4、60和65以及来自μ属的HPV-1和63相关。病变通常是良性的,在一般人群中可在2年内自愈。疣可以出现在任何年龄,但他们在幼儿期是罕见的,其患病率随着时间的推移增加,学龄儿童高峰期约10-15岁。引起皮肤疣的HPV的累积暴露量非常高,据回顾范围内的研究显示,成人中的血清阳性率范围从百分之几到>40(例如HPV 1=5-45%; HPV 2=5-10%; HPV 3=5-20%; HPV-4=20-45%)。有些人发展为播散性寻常疣,通常难以治疗。像EV一样,播散性寻常疣可能是孤立的或综合征性的,与许多其他感染一起发生。
综合征型寻常疣患者通常有影响多个白细胞区室中细胞数量或功能的基因突变(表1)。GATA 2单倍不足导致对复发性疣(约50%的患者)、分枝杆菌和真菌感染的易感性,以及骨髓增生异常综合征、急性髓性白血病、水肿和肺泡蛋白沉积症的高风险。GATA 2是一种转录因子,调节许多生物过程,包括造血干细胞的维持。GATA 2缺陷患者的感染易感性可归因于进行性多发性血细胞减少症,影响单核细胞、DC、中性粒细胞、B细胞、NK细胞和CD 4 +T细胞。
具有单等位基因CXCR 4功能获得(GOF)突变的患者患有WHIM综合征(疣、低丙种球蛋白血症、感染和骨髓病)。绝大多数患者(约80%)会出现寻常疣,大多数发生在青少年时期。GOF CXCR 4突变由于中性粒细胞从骨髓的流出受损而导致中性粒细胞减少症。患者的树突状细胞、记忆B细胞和幼稚CD 4+和CD 8 +T细胞计数也较低,效应记忆CD 4+和CD 8 +T细胞蓄积,与T细胞库受限相关。在骨髓腔室中自发丢失WHIM等位基因的患者中观察到疣完全缓解,表明骨髓细胞在WHIM患者对HPV易感性中的主要作用。
共济失调性毛细血管扩张症(AT)是一种由ATM双等位基因突变引起的多系统疾病,其特征为小脑变性、毛细血管扩张、免疫缺陷和癌症易感性。ATM在双链DNA断裂的修复中起重要作用,例如在TCR和BCR的V(D)J重组期间发生的那些断裂人。AT患者存在严重的免疫缺陷,易受细菌和病毒感染,约20%的患者发生常见HPV疣。AT患者有正常的骨髓室,但B细胞和幼稚CD4+和CD8+T细胞计数低,TCR和BCR谱系异常。
在重度过敏、慢性感染和早发性癌症患者中发现了AR胞质分裂贡献因子8(DOCK 8)缺陷。在这些患者中观察到的感染谱包括复发性细菌性呼吸道感染、粘膜皮肤念珠菌病和慢性皮肤病毒感染,包括在40%的患者中观察到的由HPV引起的寻常疣。DOCK 8主要在造血细胞中表达,患者的免疫表型包括高血清IgE水平、嗜酸性粒细胞增多症以及T细胞和NK细胞淋巴细胞减少症。患者对皮肤病毒感染的易感性可以通过DC和T细胞迁移的缺陷来解释。
据报道,其他基因的突变以广泛的方式影响免疫系统,偶尔报告广泛的疣,包括ITGB 2(n=3; < 1%的患者),WAS(约4%的患者),ADA 2(n=5; 1-5%的患者)和NFKBIA(n=1;约6%的患者)。在WASP、ITGB 2、ADA 2和NFKBIA缺乏的患者中HPV易感性的罕见性可归因于在未移植的儿童早期存活的患者中蛋白的残留活性。
SCID基因的完全功能丧失突变从未与疾病发作时的疣相关。然而,SCID基因亚型突变的患者已经显示,IL 2 RG、LIG 4、ADA、JAK 3和ZAP 70等基因的表达与复发性寻常疣和足底疣有关,伴或不伴其他感染(表1)。此外,如EV章节中详细讨论的,IL-2 R γ和JAK 3缺乏的SCID患者在HSCT后经常发生播散性和复发性寻常疣。所有复发疣的患者(100%)都有寻常疣,44%也有EV样病变。HPV 2、HPV 3或HPV 57在三分之二的患者中被鉴定出来。在这些接受移植的患者中存在疣,表明他们的HPV易感性可能是由于皮肤内在缺陷,可能影响角质形成细胞或LC,而不是如上所述的原发性T细胞缺陷。
然而,与T细胞在抗HPV免疫中发挥的主要作用一致,主要影响T细胞数量或功能的PID与HPV感染引起的严重寻常疣相关(表1)。据报告,5例AR IL 7缺乏症患者患有寻常疣和扁平疣,其中2例患者还患有隐球菌脑膜炎。IL 7通过由IL-7 R α和IL-2 R γ组成的异二聚体受体发出信号,该受体由与人类中的T −B+ SCID相关的两个基因编码。4例IL 7缺乏患者有严重的CD 4淋巴细胞减少症,3例有CD 8淋巴细胞减少症。不幸的是,没有对剩余的淋巴细胞进行表型表征,包括具有正常CD 4 + T细胞计数的患者。在IL 7缺乏患者中观察到的T细胞淋巴细胞减少症的严重程度低于在缺乏其单个辅助受体的患者中观察到的T细胞淋巴细胞减少症,这表明完整的T细胞分化对于HPV引起的寻常疣的免疫至关重要。在IL 7缺乏患者中观察到的强烈淋巴细胞减少表明,随着发现其他患者,这些患者的感染易感性谱可能会扩大。
最近描述了一例AR完全CD 4缺乏症患者。该患者是一名45岁的女性,从10岁开始,她的手和脚上有孤立的毁容疣。CD 4是人类白细胞抗原(HLA)-II的T细胞表面辅助受体。结合后,CD 4增加胸腺中阳性选择的可能性,并增强小鼠中CD 4 +T细胞的抗原应答。在CD 4缺陷患者中观察到CD 4 −TCRγδ−TCRαβ+细胞,其表型和数量与正常CD 4+T细胞相似,证明了人类CD 4蛋白对于CD 4 +T细胞发育的冗余性。CD 4也在骨髓细胞中表达,但其在这些细胞中的作用仍不清楚。这个单一的病例研究表明,CD 4 +T细胞,也许CD 4+骨髓细胞(单核细胞,DCs,LCs),在控制常见的皮肤疣中发挥关键作用。
STK 4缺陷是一种与复发性细菌和病毒感染相关的AR疾病,包括EB病毒(EBV)诱导的淋巴细胞增殖和淋巴瘤。STK 4缺乏导致CD 4 +T细胞减少、CD 8+T细胞减少和B细胞淋巴细胞减少。迄今为止报道的16例STK 4完全缺乏症患者中有4例(25%)患有播散性寻常疣,2例患有非典型EV(见EV部分)。
完全镁转运蛋白1(MAGT 1)缺乏症(也称为XMEN)是一种影响半合子男性携带者的X连锁联合免疫缺陷。MAGT 1参与了镁调节和蛋白质糖基化。患者对EBV感染和EBV驱动的癌症、耳和鼻的复发性感染以及皮肤的病毒感染包括传染性软疣和皮肤疣(30%的患者)高度易感。这些患者的NK和CD 8 +T细胞表面NKG 2D表达水平低(100%)、IgG水平低(~ 75%)和CD 4淋巴细胞减少症(~ 40%),可能分别导致对EBV感染、耳鼻感染和皮肤病毒感染的易感性。糖基化缺陷可能通过特异性损害T淋巴细胞上几种免疫受体(包括CD 28和CD 70)的细胞表面表达,导致这些患者对感染的易感性。
AR CARMIL 2缺乏症患者具有广泛的临床表型,包括常见的皮肤疣(约30%的患者)和传染性软疣、细菌和真菌感染、皮炎、炎症性肠病、食管嗜酸性粒细胞增多症和EBV诱导的平滑肌肿瘤。CARMIL 2在免疫系统中广泛表达,在所有淋巴细胞和一些骨髓细胞中。CARMIL 2缺陷分别损害T和B细胞中CD 28和BCR下游的NF-κB活化。CARMIL 2缺陷患者的T细胞数量正常,但调节性T细胞、中枢记忆性CD 4和CD 8 T细胞以及记忆性B细胞计数较低。由于BTK缺陷而缺乏B细胞的患者并不具有HPV感染的特异性风险,这表明T细胞中缺陷的CD 28信号传导是CARMIL 2缺陷患者对HPV疣易感性的主要驱动因素。不幸的是,目前还没有CD 28缺陷患者的报道,因此目前还不能证实或排除这一假设。此外,CARMIL 2在树突状细胞(也表达该分子)中可能的内在作用仍有待探索。
最后,其他基因的突变主要影响淋巴细胞,但偶尔有广泛的疣的情况下,已报告包括RHOH(n=1; 50%的患者),PIK 3CD(n=4;约8%的患者),PIK 3R 1(n=1;约3%的患者),ICOS(n=1;约8%的患者),CD 40 L(n=3; < 1%的患者)和CORO 1A(n=1;约12%的患者)。
总的来说,对复发性寻常疣和足底疣的遗传病因学的研究表明,CD 4+T细胞在控制感染中起着重要作用。因此,令人惊讶的是,除了少数报道的例外情况,HLA-II缺陷通常与疣易感性无关。这可能反映了在没有骨髓移植的情况下患者的预期寿命非常短。细胞毒性淋巴细胞也可能对感染细胞的清除至关重要,如在消退疣中观察到的CD8+ T细胞浸润所示。然而,由于缺乏导致完全分离的CD8 T细胞或NK细胞缺陷的先天性缺陷,因此无法得出关于这些亚群对抗HPV免疫的确切贡献的确切结论。HLA-I和CD 8A缺陷特异性损害但不会消除CD 8和/或NK细胞功能,不会导致对HPV的易感性。同样,导致NK细胞数量大幅减少的MCM 4和GINS 1缺陷与疣无关。最后,在2例报告的双等位基因IRF 8缺陷患者中的1例中发现了一些疣,该患者表现为限制性树突状细胞缺陷,这表明如果这些患者不在年轻时接受移植,则可能易患重度HPV感染。因此,在GATA 2和CXCR 4缺陷的患者中HPV感染的非常高的感染率可能是由于APC和T细胞缺陷的协同作用。GATA 2、IRF 8和CXCR 4缺陷均与正常或略低水平的朗格汉斯细胞相关,因此无法得出关于皮肤表皮APCs这一主要亚群的结论。
4.肛门生殖器HPV病变
HPV也会引起肛门生殖器病变。低危型HPV 6和HPV 11是肛门生殖器湿疣的最常见原因,这是一种非常常见的性传播疾病,全球患病率为0.2%-5.1%。在极少数情况下,可能会观察到尖锐湿疣的极端表现,如Buschke-Lowenstein瘤。高危型HPV 16和HPV 18与绝大多数宫颈癌和肛门生殖器癌有关。每年,HPV导致超过500,000例宫颈癌和超过30,000例肛门癌。宫颈癌是2018年全球女性第四大常见癌症。在成年人群中,据报道5%-40%的个体对HPV 6呈血清阳性,2%-20%对HPV 11呈血清阳性,10%-40%对HPV 16呈血清阳性,5%-10%对HPV 18呈血清阳性。参与免疫反应的几个基因,其中一些也与寻常疣的易感性有关,偶尔或经常被证明与肛门生殖器HPV感染有关(表1)。
CXCR 4或GATA 2缺陷患者特别容易发生肛门生殖器疣和HPV诱导的肛门生殖器发育不良。已经发表了几例罕见的原发性免疫缺陷和肛门生殖器HPV表现的病例报告,涉及ICOS缺陷患者的HPV诱导的外阴癌(一种T细胞共刺激分子),2例ITGB 2缺乏患者的广泛性肛门生殖器疣,1例成人WAS患者的广泛性生殖器疣,ZAP 70缺陷患者的生殖器病变,1例亚型DCLRE 1C缺乏症患者发生广泛HPV相关肛门生殖器疾病、MAGT 1缺陷患者中的巨大会阴湿疣和2例CARMIL 2缺陷患者中的复发性湿疣。已经发表了几份SPINK 5缺陷和重度肛门生殖器HPV感染的病例报告,包括1例广泛性肛门生殖器乳头状瘤病(HPV 51+和α-HPV)和2例Buschke-Lowenstein肿瘤。SPINK 5缺乏导致先天性鱼鳞病、内陷性毛发畸形(“竹毛”)和严重的特应性表现。75%的SPINK5缺陷患者发生复发性皮肤感染,但这些患者的HPV感染数据非常有限,值得进行专门研究。总的来说,这些患者的可用数据,如对HPV引起的寻常疣的易感性,表明T细胞和APC在控制肛门生殖器HPV病变中起着至关重要的作用。
5.其他粘膜部位的HPV病变
5.1幼年型复发性呼吸道乳头状瘤病(JRRP)
复发性呼吸道乳头状瘤病(RRP)是一种罕见疾病,估计患病率约为1-4/100,000名儿童,主要由HPV 6和HPV 11引起。这两种密切相关的α-HPV通常与良性生殖器疣有关(见上文)。JRRP患者对其他类型的感染因子(包括病毒)没有特别的易感性,并且在其他身体部位对HPV感染没有更大的易感性。它们具有可检测的抗HPV抗体,并且仅报道了免疫系统的微小改变,包括Th2极化、CD4和CD8 T细胞中受限的Vβ TCR库以及自然杀伤细胞功能障碍。
最近在3例患有JRRP和轻度皮肤异常(包括一些寻常疣)的患者中发现了双等位基因GOF NLRP 1突变(表1)。NLRP 1是一种存在于大多数组织中的蛋白质,可作为先天免疫复合物(称为炎性小体)的传感器。炎性小体是形成先天免疫系统的一部分的蛋白质寡聚体。据报告,人类常染色体显性遗传(AD)和AR NLRP 1-GOF缺陷导致三种孟德尔疾病,具有重叠但不同的表型,所有这些疾病均包括良性至癌性过度增殖性皮肤病变。3名NLRP 1-GOF突变患者的JRRP机制尚不清楚。尽管组织学强有力地支持感染性病因,但尚未确定驱动病变的HPV毒株,并且尚未排除NLRP 1-GOF突变本身导致上呼吸道过度增殖性病变的可能性。仅在7%(3/43)的NLRP 1-GOF突变患者中发现JRRP,这与大多数儿童出生时没有HPV 6/11暴露或不完全感染一致。进一步的研究将需要澄清这种疾病的病理生理机制。
5.2其他粘膜病变
HPV还可诱导其他粘膜部位的病变,如口腔、口咽和眼粘膜。2012年,HPV,特别是高危型HPV 16,与全球约29,000例口咽癌和9000例口腔癌和喉癌有关。低危型HPV 6和HPV 11与结膜乳头状瘤、鳞状细胞乳头状瘤和口腔湿疣密切相关。HPV 13和HPV 32可导致多灶性上皮增生(MEH; Heck病),这是一种通常为良性的疾病,通常表现为口腔粘膜、牙龈、舌和嘴唇上的多发性外生性丘疹或结节。MEH很罕见,但在某些种族群体中除外,如爱斯基摩人和Waimiri Atroari印第安人,据报告,这两个种族的儿童患病率分别高达40%和21%。结合家族性病例的报告,这强烈表明MEH具有很强的宿主遗传成分。在墨西哥混血人群中,发现人类白细胞抗原HLA-DR 4与MEH风险增加3.9倍相关。迄今为止,据我所知,仅报告了3例口腔HPV病变和确定的遗传病因的患者:2例口腔HPV 6感染的兄弟姐妹中的RFXANK缺乏症和1例ZAP 70缺乏症患者中的重度复发性口腔HPV病变。连同获得性免疫缺陷患者对头颈部HPV感染和癌症的高度易感性,这些病例报告表明,先天性T细胞免疫缺陷可能是口腔、口咽和眼粘膜对重度HPV感染易感性的基础。
6.结论
近几十年来,人类原发性免疫缺陷的分子特征为HPV特异性免疫提供了新的见解。在吞噬作用(例如CYBA、NCF 1或NCF 4缺陷)或补体缺陷(例如C3缺陷)患者中不存在明显的HPV感染,表明免疫的这两个重要分支在HPV免疫中不起重要作用。此外,在许多严重免疫球蛋白缺陷(例如CD 40 L和BTK缺陷)患者中,包括存活至成年期的患者,很少报告重度HPV感染。因此,尽管HPV疫苗接种具有明显的预防作用,并且有病例报告显示皮下免疫球蛋白治疗后疣消退,但B细胞似乎在HPV易感性中不起关键作用。与非典型EV、寻常疣和肛门生殖器HPV相关的所有原发性免疫缺陷的共同特征是T淋巴细胞受损,有时与APC一起受损。细胞毒性淋巴细胞(CD8 T细胞和NK细胞)的作用仍不清楚,因为这些细胞在人体中缺乏特异性免疫缺陷。与在消退疣中观察到的大量浸润一致,CD4+ T细胞明显起着关键作用,如CD4+ T细胞淋巴细胞减少症患者对疣的高易感性所示,无论是遗传性还是获得性,以及最近报告的首例缺乏CD4表达的患者。APC缺陷,可能与T细胞缺陷相结合,似乎也在GATA 2和CXCR 4缺陷中观察到的极端HPV易感性中起主要作用。最后,EVER1、EVER2或CIB 1缺陷患者对EV的易感性表明角质形成细胞内源性免疫控制β-HPV感染。许多与HPV易感性相关的基因不仅在免疫细胞中表达,而且在皮肤中表达(例如STK 4;表2),因此可能导致皮肤固有的免疫缺陷,不仅对β-HPV,而且对其他HPV类型(α,γ,μ和ν)。最近在JRRP患者中发现的NLRP 1- GOF突变与这一假设一致。
总之,尽管从人类原发性免疫缺陷的研究中获得了大量关于HPV免疫的知识,但仍存在许多未回答的问题。首先,皮肤和粘膜中不同淋巴细胞和APC亚群对HPV免疫的确切贡献尚不清楚。其次,疣消退过程中的分子机制仍然未知。最后,角质形成细胞对β-HPV以及对α、γ、μ和ν HPV的内在免疫的机制仍然知之甚少。正在进行的和未来的皮肤或粘膜对HPV易感性的细胞基础的遗传学研究无疑将回答许多这些问题。这些研究应该提高我们对HPV正常免疫的理解,我们希望,在目前全球HPV疾病负担的背景下,提供急需的新的预防、诊断和治疗工具。
点击此处可下载原文献






















共0条评论