[导读] 编译整理:张仁亚,王强
病理诊断,并非简单的“看图说话”,而是要结合临床信息、病变部位等所有相关信息才能做出最为精准的诊断。具体来说,相同形态的病变、发生于不同部位,可能其病理诊断及治疗和预后都是显著不同的,比如大家较为熟悉的子宫平滑肌瘤和软组织平滑肌肿瘤之间就有类似体现。
乳腺病理中,也存在上述问题,比如乳腺乳头处:一方面该部位解剖学结构有独特之处,另一方面少数特殊病种仅见于这一部位。美国病理专家Brogi和Scatena曾在《Adv Anat Pathol》杂志发表综述,详尽介绍了乳腺乳头处病变的临床、病理及免疫组化特征,并讨论了最常见的某些诊断难点、和/或鉴别诊断问题。为帮助大家更好的了解相关知识点并应用于临床实践,我们将该文要点编译介绍如下。
乳头简介
乳腺是来源于大汗腺的特殊皮肤附属器。胚胎发育过程中,腹侧外胚层沿着“乳线”的位置增厚,且在双侧前后肢芽(limb buds)的位置伸展。根据哺乳动物类型的不同,后续在乳头部位形成乳芽(mammary buds),其余的乳线则退化消失。对人类来说,除了胸部两侧各有一处乳芽外,其余部分一般都完全退化消失。后续经过内陷、成腔(cavitation)、导管分支而发育成乳腺。个别情况下,如果乳线未完全退化,则在沿着乳线的位置会出现副乳头(supernumerary nipple)及异位乳腺组织。对于女性来说,乳腺小叶的进一步生长及发育发生在青春期和妊娠期,产后乳汁分泌达到顶峰,从而实现泌乳,这也是乳腺的主要功能。男性也有乳头及未充分发育(rudimentary)的乳腺,后者仅为纤维性间质中的少许导管,一般并无终末导管小叶单位。
乳头是乳房顶端、乳晕中央的小突起,输乳管由此开口于皮肤,从而起到泌乳时乳汁由此流出的功能。鉴于其独特组织构成,因此该处可发生诸多皮肤病变及乳腺病变,具体从炎症性病变、到良性肿瘤、恶性肿瘤均可。乳头的大部分炎症性病变及功能相关改变一般都是见于女性,但肿瘤性病变男女均可发生,且可能发生于乳线残余的部位。
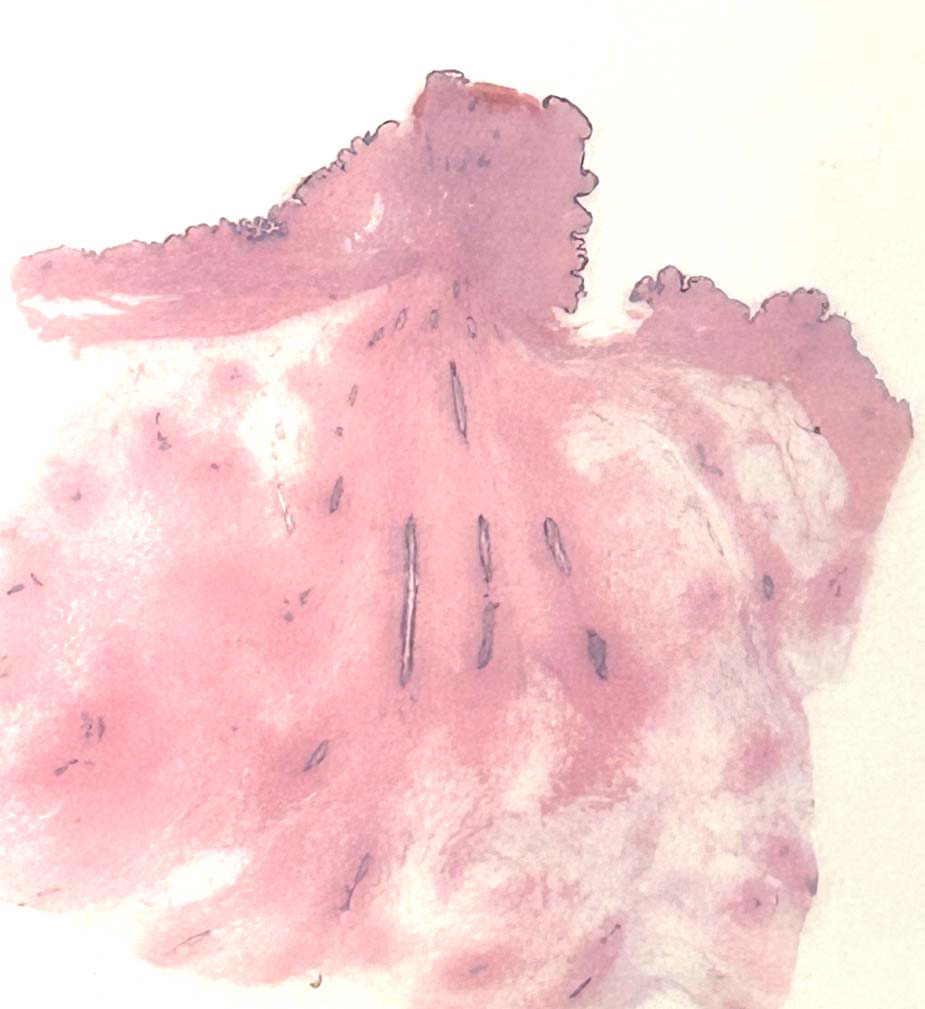 图1.乳头-乳晕复合体的解剖。
图1.乳头-乳晕复合体的解剖。
风险降低性乳腺切除标本中,对无病理异常的乳头进行连续切片及三维数字重建研究,结果发现集中于乳头中央的乳管数量中位数为23条。乳管在乳头和复旧腺泡(retroareolar)乳腺组织分界处变窄;超过此分界后,泌乳管轻度扩张为泌乳窦。在乳头顶端,输乳管通过不明显的开口而引流。有三维重建研究发现,一个乳头中有15个开口、引流29条导管。
乳头位于乳晕的中央,周边有一圈薄层、有色素的皮肤,这些结构一般总体称为乳头-乳晕复合体(nopple-areola complex,NAC)。乳头-乳晕复合体处并无毛囊,一般在乳晕周围散在毛囊皮脂腺单位(pilosebaceous unit);乳头-乳晕复合体处富于皮脂腺。乳晕处的皮肤一般有小的凸起(1-2mm),是显著皮脂腺(Montgomery腺)导管的开口,又称为Morgagni结节。乳头的皮脂腺在妊娠期及泌乳过程中会变得更加显著,因为可以有助于哺乳时润滑乳晕。乳头处未见小汗腺。
乳头-乳晕复合体处的复层鳞状上皮延伸至乳头大导管的终末部分、达1-4mm。广泛鳞状上皮化生会导致角蛋白在导管内积聚及导管栓塞。乳头-乳晕复合体处的真皮富于平滑肌纤维,且有感觉神经末梢。乳头深部则富于淋巴管网,又称Sappey丛。
乳头顶端的表皮中,10-20%的病例可见散在形态温和的腺细胞,即Toker细胞。本系列文章后续的Paget病部分或有详细叙述。
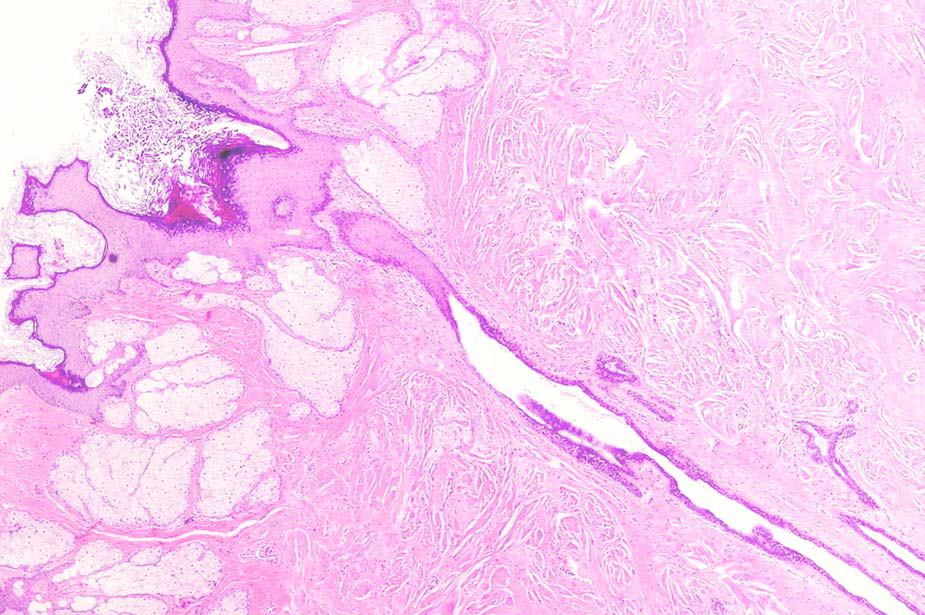 图2.乳头处复层鳞状上皮移行至乳头大导管的腺上皮。
图2.乳头处复层鳞状上皮移行至乳头大导管的腺上皮。
输乳管鳞状化生
输乳管鳞状化生(squamous metaplasia of the lactiferous duct,SMOLD)属于乳腺的少见疾病。文献中对此还有其他名称,尤其进展期表现的时候,具体如:Zuska病,复发性乳晕下脓肿,导管周围乳腺炎。
吸烟是发生SMOLD的主要危险因素,尤其卷烟。具体原因可能在于吸烟促进了输乳管的鳞状上皮化生从而导致相应导管扩张、角质栓形成,后续导管破裂、角质外渗至导管周围间质从而促进了急性和慢性的导管周围炎症、并有脓肿形成。此外,SMOLD也可能是乳头内陷或乳钉的并发症,因此机械性损伤也可能是发病原因。
SMOLD一般发生于女性,但罕见情况下也可发生于男性,患者年龄分布宽泛。一般来说患者为吸烟人士,且曾有类似的多次反复发作。临床一般表现为乳头-乳晕复合体处的红色、疼痛性结节。常见化脓性乳头溢液。部分病例中脓液是通过乳晕处的窦道流出的。临床上,需要注意鉴别导管内乳头状瘤、哺乳相关的脓肿、乳腺恶性肿瘤。乳腺X线上,SMOLD一般表现为乳晕后不对称性致密灶,且为境界清楚的低回声灶、伴血管密度增高。
大部分情况下,仅抗生素治疗不足以治愈SMOLD,且只有手术切除、加戒烟才能根除,戒烟还可以降低复发的风险。文献中有SMOLD背景下发生鳞状细胞癌的罕见病例报道,但这种情况并未排除延迟确诊的癌。
组织学上,SMOLD表现为淋巴细胞、浆细胞、中性粒细胞构成的混杂性炎症,散在巨细胞,并混有角质碎屑。免疫组化高分子量CK(CK5/6、CK14)会显示出炎症背景及巨细胞中的角质碎屑。一定的临床背景下,这些形态学强烈提示SMOLD的诊断。小而定位欠佳的活检标本中可能很难确定鳞状化生,但切除标本中一般较为明显。SMOLD中,表皮内的Toker细胞增生最近也有描述:作者提出,可能是炎症触发了Toker细胞的增生,但具体尚需进一步研究。
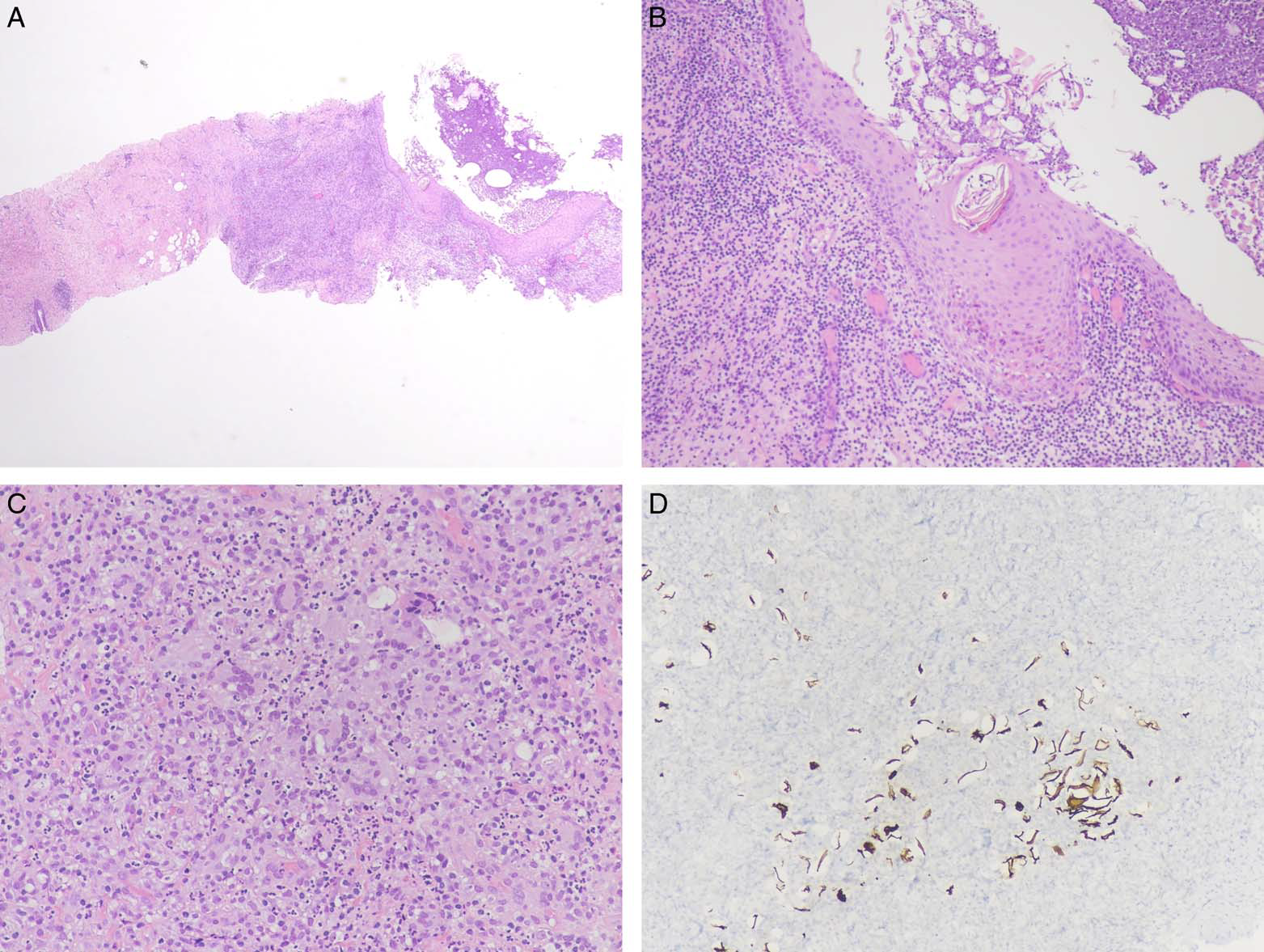 图3.SMOLD,本例小活检标本中可见鳞状化生(A、B),周围有显著的炎症细胞浸润,具体为淋巴细胞、浆细胞、中性粒细胞及巨细胞(C),并有角质碎屑(D,免疫组化CK5/6)。
图3.SMOLD,本例小活检标本中可见鳞状化生(A、B),周围有显著的炎症细胞浸润,具体为淋巴细胞、浆细胞、中性粒细胞及巨细胞(C),并有角质碎屑(D,免疫组化CK5/6)。
SMOLD需鉴别表皮包涵囊肿、乳腺导管扩张。虽然表皮包涵囊肿一般发生于真皮,但SMOLD紧贴乳头下方、且与输乳管有延续。乳腺导管扩张并不伴鳞状上皮化生,也并无炎症反应背景中的角质碎屑。
乳腺导管扩张
乳腺导管扩张此前也称为浆细胞性乳腺炎或粉刺性乳腺炎,是输乳管周围弹性管腔弹力减弱及中断所致,进而出现导管内分泌物积聚、导管壁破裂。浓缩的分泌物泄入间质,会导致炎症反应及导管周围纤维化。
乳腺导管扩张一般发生于多次妊娠的围绝经期至绝经后女性,且不会发生于男性。文献中曾有儿童的罕见病例报道,但机制仍未确定。临床上,乳腺导管扩张表现为乳晕下可触及肿物,常伴稠厚的乳头分泌物,血性分泌物的情况罕见。乳头回缩及皮肤破坏可能会类似恶性病变。由于可能是多个导管受累,因此导管扩张在临床和大体可表现为质实、界不清区域。超声可能会发现导管扩张、脓液积聚、或囊实性混合的肿物。
组织学上,输乳管扩张,内有大量无定型颗粒状分泌物,周围有混合性炎症细胞,具体如淋巴细胞、浆细胞、中性粒细胞。囊腔内及受累导管的囊壁中常见泡沫状组织细胞。也有多核巨细胞,但明确的肉芽肿并非该病变的特征。导管周围纤维化可能非常显著,且终末期可能会导致导管闭塞,即所谓的闭塞性乳腺炎。部分病例中,可能会出现导管的部分再通,即周边出现小的、衬覆上皮的管腔,又称为Garland征。

图4.乳腺导管扩张。输乳管内充满泡沫样组织细胞(A),周围有淋巴细胞、浆细胞、中性粒细胞构成的混合性炎症(B),且终末期病变中会有显著的导管周围纤维化(C)。
乳腺导管扩张需鉴别SMOLD、乳腺脓肿。SMOLD的主要特征是急慢性炎症、伴角质碎屑;乳腺脓肿的特点则是化脓性炎症,临床主要见于哺乳时、或继发于SMOLD。
乳腺导管扩张在临床及组织学都有其特殊性,因此这一诊断名词不要用于特殊临床背景之外的扩张导管,比如新辅助化疗后的乳腺切除标本中如果查见含泡沫样组织细胞的扩张导管,就不能诊断为乳腺导管扩张。
——未完待续——
点此下载原文献
参考文献
[1]Brogi E, Scatena C. Nipple Lesions of the Breast: An Update on Morphologic Features, Immunohistochemical Findings and Differential Diagnosis. Adv Anat Pathol. 2023;30(6):397-414.
doi:10.1097/PAP.0000000000000413

















共0条评论