[导读] 作者:游乐园
1、临床资料
患者女性,35岁,一个月前无明显诱因出现咳嗽,偶感发热,无消瘦、恶心呕吐、腹痛腹胀、头昏头痛等不适。胸部CT提示前上纵隔多发结节,增强扫描部分病灶环形强化,实性病变轻度均匀强化,考虑肿瘤性病变。遂行胸腔镜下纵隔肿物切除术。组织病理学镜下表现:异型淋巴细胞弥漫性浸润,肿瘤细胞被硬化的纤维束分割成巢状,肿瘤细胞中等大小,胞质丰富透亮,胞核圆形或卵圆形或不规则形,染色质颗粒状,可见核仁、核分裂象。免疫组化:CD20、PAX5、LCA、CD10、BCL6、MUM1、BCL2、CD30阳性,CD3、CD5、CD21、EBER、CD15、CK阴性,Ki-67增殖指数约80%+。病理诊断:原发性纵隔(胸腺)大B细胞淋巴瘤。
2、讨论
原发性纵隔(胸腺)大B细胞性淋巴瘤(primary mediastinal large B—cell lymphoma,PMBL)是弥漫性大B细胞性淋巴瘤的一种亚型,是一种临床少见的非霍奇金淋巴瘤(NHL),起源于成熟胸腺髓质B淋巴细胞,1980年Lichtenstein等对其进行了首次报道。PMBL占非霍奇金淋巴瘤的2%-4%,多见于年轻女性,男女之比为 1:2,中位发病年龄为35岁,临床症状通常表现为前上纵隔巨型肿块压迫邻近器官导致呼吸困难、干咳、胸痛胸闷、声嘶、上腔静脉综合征( superior vena cava syndrome,SVCS),部分患者伴有不同程度血沉加快、乳酸脱氢酶升高及β2-微球蛋白升高,其能反映肿瘤增殖活性及肿瘤负荷,有助于临床分期判断、疗效监测及预后评估等。PMBL通常表现为纵隔肿块,可局部侵犯肺、胸壁、胸膜、心包等周围组织器官,也可转移至锁骨上或颈部淋巴结,晚期或复发病例可转移至肾、肾上腺、肝、脾、胰腺和中枢神经系统,但通常不累及骨髓。
组织病理学要表现为硬化性纤维间质背景下大量的异型淋巴样细胞增生,多见硬化的间质将肿瘤细胞分割成巢状。肿瘤细胞中等偏大,胞质丰富透亮,胞核圆或卵圆形,部分可见多形性或多叶状核的大细胞。本瘤形态学表现多种多样,可呈中心母细胞、免疫母细胞、间变、未分类或者有时RS细胞样形态,光镜下易误诊,结合免疫组化有助于提高诊断的准确性。肿瘤细胞表达B细胞抗原如CDl9、CD20、CD22、CD79a,肿瘤细胞不同程度表达CD30、 MUMl、CD23、bcl-6和 bcl-2,CD5、CDl0、CDl5及CD21通常阴性,缺乏免疫球蛋白(Ig)的表达。遗传学特征:PMBL具有特异的基因表达谱,表现为Ig克隆性基因重排、伴超体细胞突变、无进行性突变活性。扩增的代表基因有PMLBCL(JAK2)、PD-L1、PD-L2(9p)、 REL、BCL11A(2p)、MAL。PMBL有独特的与CHL共享的转录标记,持续性激活NF-kB和JAK-STAT信号通路可抑制SOCS1突变。
鉴别诊断:(1)原发纵隔霍奇金淋巴瘤(结节硬化型):PMBL与结节硬化型HL在发病年龄、性别及组织所见上均相似,结节硬化型HL特征性的 陷窝细胞常常与PMBL的瘤细胞相似。但结节硬化型HL的HRS细胞及陷窝细胞的背景包括大量小淋巴细胞、嗜酸性粒细胞等细胞,且免疫组化CD30、CDl5阳性,CD20-/+,PAX-5、CD79a弱阳。(2)特征介于弥漫大B细胞性淋巴瘤(DLBCL)和经典型霍奇金淋巴瘤(CHL)之间的未分类B细胞淋巴瘤(纵隔灰区淋巴瘤):兼有DLBCL和CHL的混合特征,形态学为典型的DLBCL,但免疫组化表型符合CHL,或者形态学类似CHL,但免疫组化表型提示为DLBCL。(3)T淋巴母细胞性淋巴瘤:常见于儿童和年轻患者,男性多见,表现为巨大纵隔肿块,常有外周血和骨髓累及。肿瘤弥漫生长,为中小细胞,有星空现象,但T淋巴母细胞性淋巴瘤间质纤维化少见,且免疫组化染色末端脱氧核苷酸转移酶阳性,遗传学检测表现为T细胞受体基因重排。(4)弥漫大B细胞性淋巴瘤(DLBCL,NOS):除纵隔肿块外,还累及纵隔外淋巴结,但是,如果肿瘤只发生在纵隔淋巴结,则常难以鉴别,特别是取材较小时,需综合形态、免疫组化和分子检测等多方面检查结果判断。目前诊断PMBL,肿瘤发病部位和病人的年龄性别作为重要依据,不能除外有的纵隔DLBCL,NOS被误诊为PMBL。(5)原发性纵隔精原细胞瘤:是最常见的恶性纵隔胚细胞肿瘤,主要见于年轻男性,也可表现为纤维间质分隔,肿瘤细胞胞质丰富透亮。原发性纵隔精原细胞瘤患者均有淋巴细胞浸润,且可出现上皮样肉芽肿、生发中心、大量的细胞质糖原、胞膜卷曲、核多角形,染色质细颗粒状,具有一个或多个大核仁,核分裂象多少不等。免疫组化表达PLAP、CDll7、OCT3/4、SALL4、SOX17、D2-40(弥漫膜阳性),约30%的病例灶状表达CK。免疫荧光检测12p染色体异常有助于纵隔精原细胞瘤的诊断。(6)胸腺瘤/癌:表现为前纵隔肿块,有时活检样本小,需注意鉴别,肿瘤细胞表达CK,不表达B细胞抗原,背景是胸腺不成熟T细胞。
PMBL的治疗首选化疗,但尚难确定最佳的一线化疗方案。北美国家主张用传统的CHOP方案,欧洲推荐MACOP-B方案,文献报道后者结合放疗,疗效较CHOP方案为优,进一步提出MACOP-B方案加放疗和造血干细胞移植可获得良好疗效,完全缓解率达80%,5年生存率达60%。PMBL是弥漫性大B细胞性淋巴瘤的一个亚型,肿瘤细胞表达B细胞标志物,为美罗华的应用提供了理论基础,研究发现:美罗华联合CHOP方案治疗进展期DLBCL的有效率可达95%,2年生存率接近90%,同时具有良好的安全性,而单用CHOP方案治疗,有效率为63%,2年总生存率57%,提示美罗华联合CHOP方案治疗DLBCL的疗效明显优于单用CHOP方案治疗的效果。随着肿瘤靶向治疗的飞速发展,PMBL治疗方案由传统的放化疗转向程序性死亡[蛋白]-1(programmed death-1,PD-1)抑制剂治疗,疗效显著。与生发中心B细胞和活化B细胞亚型DLBCL相比,PMBL与更有利的生存相关,成人和儿童治愈率高,PMBL患者平均5年生存率约85%,年龄超过40岁的患者生存率明显降低,扩散至胸腔出现胸腔积液或心包积液,伴机体状态差者预后不良,因此临床肿瘤周期治疗的方案选择和联合用药对提高患者生存率至关重要。
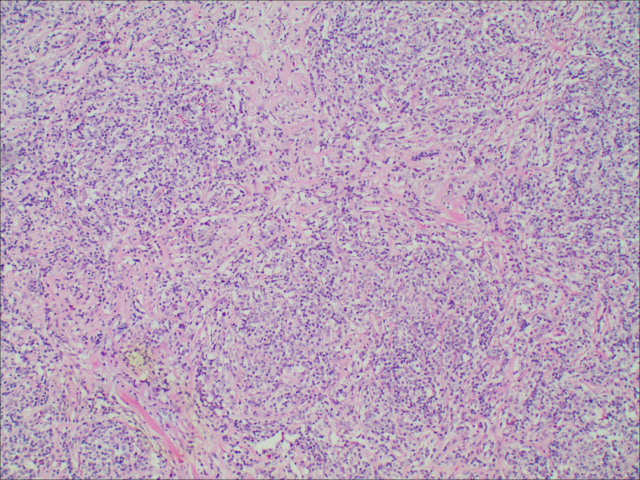
图1.肿瘤细胞被硬化的纤维束分割呈巢状
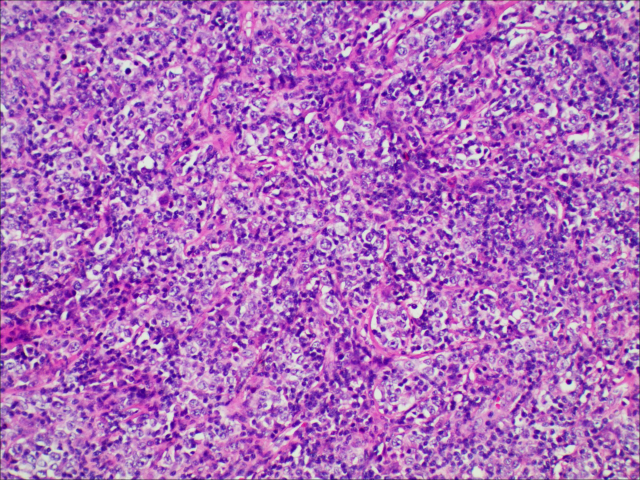
图2.肿瘤细胞呈巢状
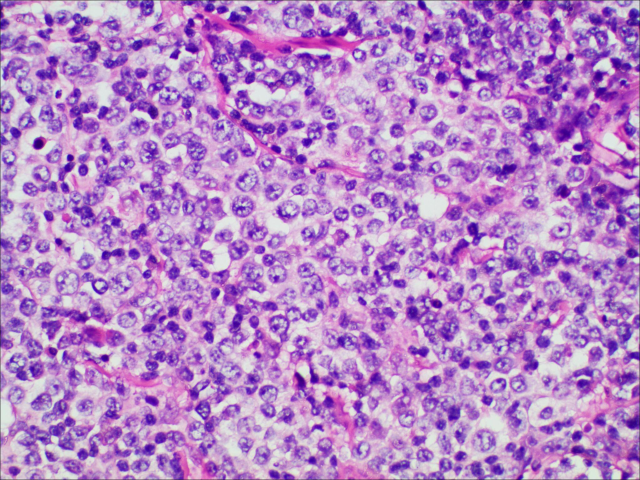
图3.肿瘤细胞胞质透亮,核仁易见
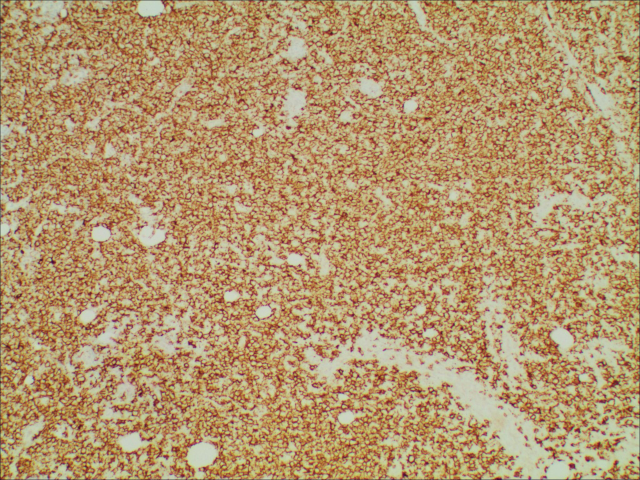
图4.肿瘤细胞CD20阳性,免疫组化
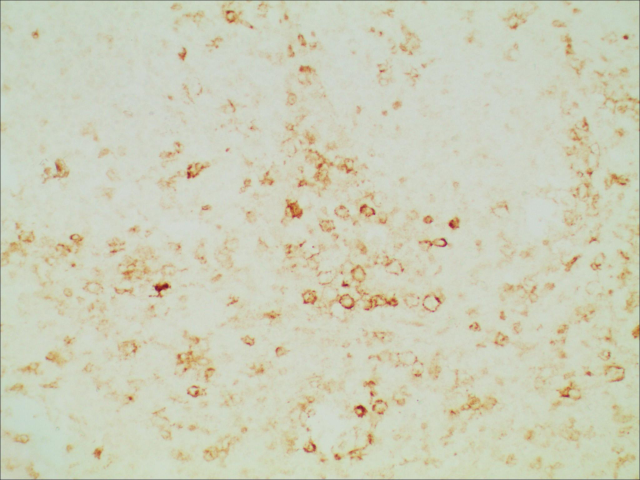
图5.肿瘤细胞CD30阳性,免疫组化


















共0条评论