[导读] 作者:游乐园
1.临床资料
患者女性,31岁,无明显诱因出现额部持续性隐痛1个月,伴视物模糊、纳差、恶心、呕吐,2天前出现发热,自感乏力、阵性咳嗽,自服消炎药,发热无缓解,患者既往患有HIV感染,未予重视,未进行规范HAART治疗,为求明确诊断,遂入院行进一步诊治。入院后头部增强MRI:右侧枕叶可见多量环形、结节状异常信号影,截面约5.4x3.3cm,考虑肿瘤性病变。查体:恶病质,重度贫血貌。血常规:淋巴细胞数0.32(109/L) ↓,血红蛋白87.00(g/L) ↓ ,白细胞2.78(109/L) ↓ ,中性粒细胞比率78.70(%)↑ ,红细胞3.25(1012/L)。病原微生物检测:巨细胞病毒(64.55%),EB病毒(35.45%),抗酸杆菌染色阳性(2+)。CD4绝对值6个/uL,现处于艾滋病晚期,机体免疫力低下,合并多种机会性感染,包括结核杆菌、巨细胞病毒等。完善相关检查后遂行手术治疗。术中见肿瘤位于右侧枕叶,大小约6x5x5cm,略偏黄色,与周围界限不清,质地韧,故行右侧枕叶占位病变切除术+脑脊液漏修补术。病理检查:肿瘤由小-中等大小的圆形或椭圆形细胞组成,弥漫或片状生长伴广泛坏死,胞质丰富淡染,核质细腻,可见核仁,核膜清晰,核分裂易见。病理诊断:(右侧枕叶)HIV相关性原发性中枢神经系统弥漫大B细胞淋巴瘤。免疫表型:CD21(-)、CD23(-)、CD20(+)、PAX-5(+)、CD19(+)、CD10(-)、Bcl-6(-)、MUM-1(+)、C-myc(+,约10%)、Bcl-2(+,约80%)、CD30(+)、P53(+)、CD3(-)、CD5(-)、CyclinD1(-)、CK(-)、CD56(-)、Ki-67(+,约90%)。
治疗:术后予以大剂量甲氨蝶呤+阿糖胞苷/替莫唑胺,并启动抗病毒治疗(绥美凯/艾博韦泰+多替拉韦方案),同时抗痨治疗及营养支持治疗。术后第4个月患者出现意识丧失、呼之不应、对光反射迟钝、压眶反射消失、双肺呼吸音粗,考虑中枢神经系统淋巴瘤导致呼吸抑制、意识丧失,予以盐酸肾上腺素注射液1mg静脉注射强心,阿托品注射液0.5mg静脉注射抗休克,尼可刹米注射液0.375mg、洛贝林注射液3mg静脉注射兴奋呼吸,并予无创呼吸机辅助呼吸、心电监测血养饱和度,经抢救,患者病情无改善,后建议进行心肺复苏及气管插管等抢救,患者家属表示放弃抢救。
2.讨论
HIV-PCNS DLBCL(HIV-associated primary central nervous system of diffuse large B cell lymphoma,HIV相关性原发性中枢神经系统弥漫大B细胞淋巴瘤)属于免疫缺陷相关性淋巴组织增殖性疾病,是一种罕见的局限于中枢神经系统的非霍奇金淋巴瘤。近年随着HAART的广泛临床应用,发生率有所降低。病理分型上以B细胞来源的淋巴瘤为主,占90%以上,主要包括弥漫大B细胞淋巴瘤(DLBCL),伯基特淋巴瘤(BL),浆母细胞淋巴瘤(PBL)和原发性渗出性淋巴瘤(PEL)等非霍奇金淋巴瘤,其中又以DLBCL为最主要的类型(80%-90%),极少数为T淋巴细胞型。该病发病机制复杂,多与免疫缺陷有关,HIV利用宿主CD4T淋巴细胞趋化因子受体进入宿主细胞,在宿主细胞基因组中进行自我整合及自我复制,CD4T细胞数量急剧降低,宿主免疫反应出现异常,同时它对树突细胞、单核细胞及其他淋巴细胞具有趋向性,从而导致HIV相关淋巴组织增殖性疾病的风险显著增加。B淋巴细胞个体发生的染色体易位和突变也可能促进DLBCL的发生。BCL-2、BCL-6、MYC是DLBCL中常见的易位目标,多与免疫球蛋白重链相关,使原癌基因片段转移到免疫球蛋白基因下游的位点,而不是原始调控区域,导致基因表达及蛋白质表达增加,影响细胞周期及存活,其抗凋亡作用有利于转化细胞的存活,有助于致癌作用。MYC、PAX5、BCL2、BCL6、CARD11、CDKN2A等靶点的突变、拷贝数增加或丢失,与淋巴细胞激活相关,有利于细胞周期的存活。HIV刺激淋巴细胞释放IL-6、IL-10、TNFα、IFNα,这些细胞因子的过度表达有助于B细胞的激活、分化。Epstein-Barr病毒是一种普遍存在的双链DNAγ-1疱疹病毒,是第一个发现miRNA(微RNA)病毒,其内包含线性DNA分子,可编码大约100个基因,长度约为172 kb,包括EBV-1和EBV-2两个亚型,对B淋巴细胞具有亲嗜性,EBV的糖蛋白gp 350、gp 42渗透、包裹B淋巴母细胞表面受体,形成免疫球蛋白—EBV 复合物。AIDS患者免疫受限制,对病原体的免疫监视下降,免疫系统不能完全清除病毒,部分被感染的B细胞分化为记忆B细胞,进入潜伏期。尽管大多数人携带病毒后并没有临床症状,但EBV的长潜伏期和再激活会导致各种淋巴组织增生性病变。好发于男性,发病年龄普遍<60岁,侵袭性强,临床分期晚,进展快,患者生存率低于普通NHL患者。大部分患者在首次接受抗HIV治疗后的18个月内发生淋巴瘤,临床表现复杂多样且病情进展快,5年生存率为15-30%。常以颅内压增高为首发症状,多伴有认知障碍、性格改变、精神活动迟缓,少数患者可表现为脑干和小脑体征、颅神经功能障碍或癫痫发作。本文患者以头痛、视物模糊、记忆力、反应力下降、癫痫多次发作为主要表现,腰穿脑脊液检测,常规基本正常。
HIV-PCNS DLBCL早期诊断比较困难,影像学检查缺乏特异性,难以与胶质瘤、转移性肿瘤等疾病鉴别。开颅活检是获得组织标本及明确诊断的重要方式。近年来立体定向活检技术因并发症发生率低且几乎无死亡率,获得了广泛普及。但因部分患者活检前使用了地塞米松,肿瘤细胞对激素高度敏感,可抑制肿瘤生长,甚至使其消退,导致立体定向活检的准确性受到了一定影响,部分患者需反复多次活检方能明确诊断。HIV-PCNS DLBCL肿瘤细胞表现为弥漫浸润性生长,浸润脑组织小血管并聚集,形成血管周围的袖套样结构,但并不引起血管内皮增生,肿瘤内部含有丰富的网状纤维,肿瘤细胞浸润皮质或神经束,周围可见反应性星型胶质细胞。肿瘤细胞主要由中心母细胞和免疫母细胞组成,可伴有浆细胞分化。表达B细胞相关免疫标记,包括CD20、CD19、Bcl-6、MUM-1、CD10、PAX-5等抗体。
目前针对HIV-PCNS DLBCL的治疗方式存在争议,由于存在血脑屏障且HIV患者的免疫抑制状态使得治疗的选择很困难,常常因感染而复杂化,且随着患者病程延长,合并症的发生率及其导致的病死率不断增加,目前尚没有最佳治疗方案,多采用综合治疗:手术、化疗、HAART联合治疗、放疗。治疗方案首选高强度化疗及HAART联合治疗方案,后者能有效提高患者CD4+T细胞计数和化疗耐受性,并采取预防性措施减少机会性感染的发生。研究表明,联合HAARRT和规范化化疗的患者,1年生存率可达66%,5年生存率可达55%,显著高于单纯化疗人群。对于单发巨大肿瘤、肿瘤周围水肿严重的病例手术效果明显,一项纳入167例PCNSL患者的单中心研究结果表明,手术可使患者获益,完全切除的获益更明显。单纯的全脑放疗的疗效并不理想,仅延长了患者的无进展生存时间,对总生存期无影响。靶向治疗、免疫治疗、嵌合抗原受体T细胞治疗等也表现出很好的应用前景,但仍需进一步研究。标准的化疗方案R-CHOP因不能透过血脑屏障,疗效差,故建议予以大剂量甲氨蝶呤+阿糖胞苷或替莫唑胺,并联合HAART治疗。本例患者HIV确诊后未进行HAART治疗,导致机体免疫功能低下,全身情况差,病情发展迅速,虽经积极的手术及化疗,总体预后仍不理想。
综上所述,HIV-PCNS DLBCL是一种高度侵袭性肿瘤,临床表现复杂,诊断依赖病理检查,病理分型以弥漫大B细胞淋巴瘤为主。目前尚无最佳治疗方案,推荐联合治疗方案,但缓解后肿瘤易复发,病死率高,预后差,有待感染科、神经外科、肿瘤科及放疗科等多学科合作,共同改善患者的生存和预后。
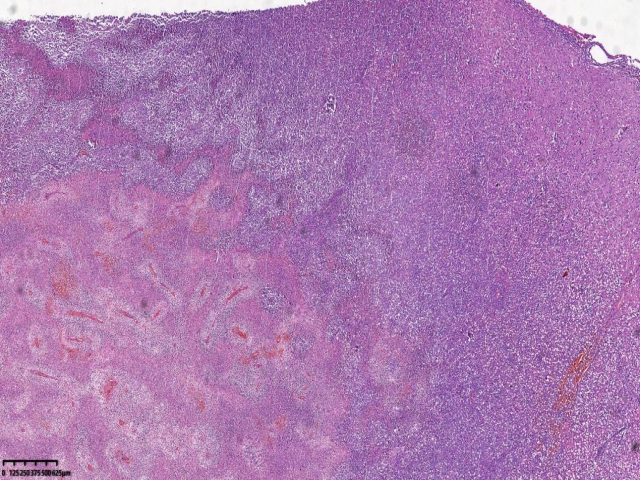
图1.中等大小的淋巴细胞弥漫浸润(HE:100x,右侧枕叶)
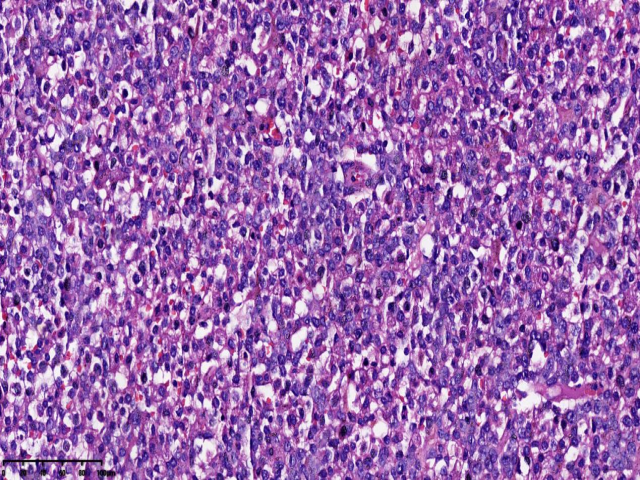
图2.图1相同区域的更高倍率视图(HE:400x,右侧枕叶)
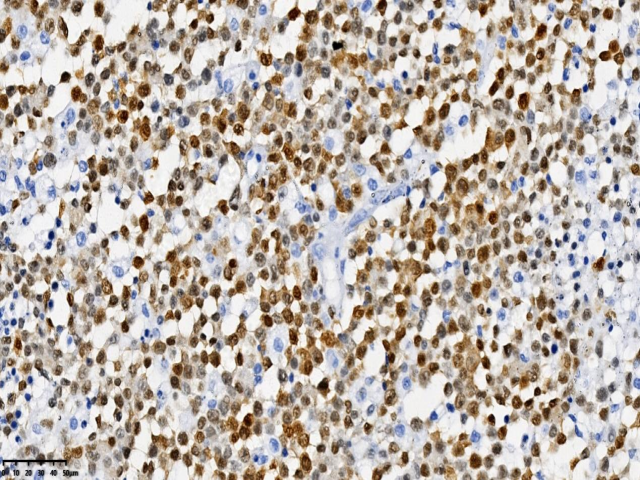
图3.肿瘤细胞MUM-1(+)(EnVision两步法:400x,右侧枕叶)
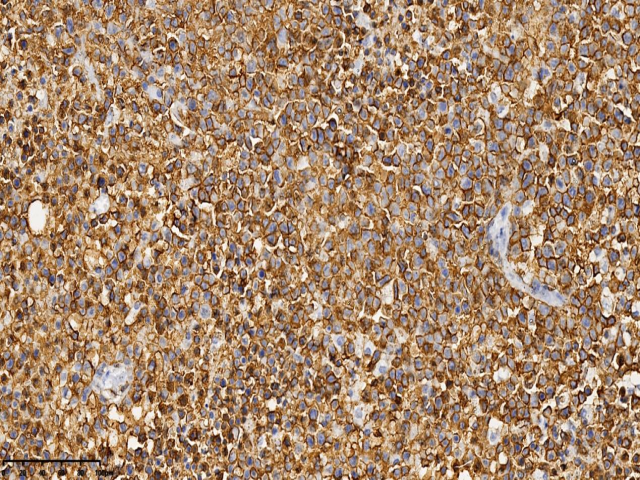
图4.肿瘤细胞CD20(+) (EnVision两步法:400x,右侧枕叶)
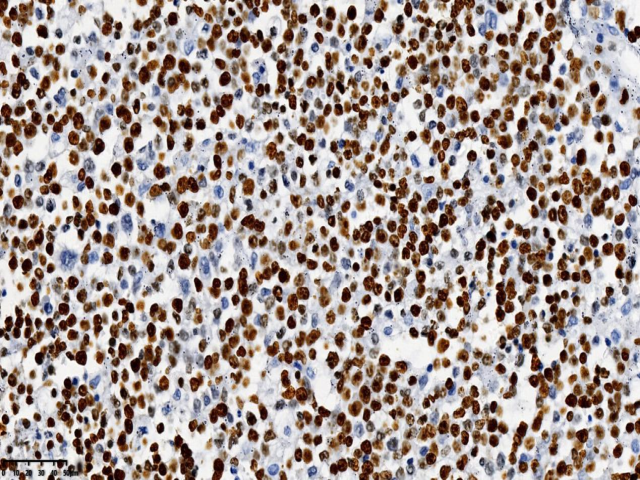
图5.ki-67增殖指数约90% (EnVision两步法:400x,右侧枕叶)


















共0条评论