[导读] 编译整理:强子
硬化性血管瘤样结节性转化
鉴别诊断
SANT需鉴别多种其他血管病变,如硬化性血管瘤、Littoral细胞血管瘤、血管肉瘤、甚至脾脏错构瘤;不过,还需鉴别间质性病变,如炎性假瘤、IgG4相关病变。鉴别诊断范围如此宽泛,也说明我们对SANT的发生机制并不了解。
血管瘤是脾脏最常见的血管性肿瘤,免疫组化表达血管标记,如VIII因子、CD8、CD31、CD34。血管瘤一般为单发病变,但也可为多灶性,仍为良性病变。硬化性血管瘤为混杂有硬化表现的血管结构,此时与SANT中的纤维性硬化、血管瘤样结节即使不是无法区分、也是区分非常困难的。甚至有人质疑:硬化性血管瘤是否真的不同于SANT。
血管肉瘤为恶性血管性肿瘤,具体表现为脾脏内多个出血性结节。组织学上为相互沟通的血管,内皮细胞高度非典型,常伴非典型核分裂和坏死。内皮细胞一般表达CD31和CD34,但不表达CD8。SANT并无血管肉瘤中的非典型或坏死,因此容易鉴别。Littoral细胞血管瘤为脾脏的多结节性囊性病变,具体为大小不等的血管结构,常伴肥胖的、高起的内皮细胞,有时呈乳头状凸起或脱落至囊腔内。Littoral细胞血管瘤中衬覆的细胞免疫组化表达VIII因子、CD31、CD68及langerin,但不表达CD8、CD34。SANT与Littoral细胞血管瘤的不同,在于前者并不表现为伴内皮细胞突向管腔的囊性肿瘤。脾脏错构瘤为单发的结节状病变,具体为包括血窦和红髓索(cords of Billroth)的无序红髓成分构成。脾脏错构瘤中并无SANT时较大的纤维硬化性条带和血管瘤样结节。
炎性假瘤为小淋巴细胞、浆细胞、肌纤维母细胞、组织细胞形成的肿物样病变。这种间质成分类似于SANT中的间质,但极少出现纤维性硬化。需要注意的是,SANT和炎性假瘤可能是相同病变的谱系性表现,其中SANT是有血管瘤样结节、显著纤维性硬化、间质散在炎症性成分的情况,而炎性假瘤则有更多的炎症成分且形成肿物样病变而纤维硬化表现更轻微。文献中偶有介于炎性假瘤和SANT之间的病变,且也有同时具有炎性假瘤和SANT的罕见病例报道。SANT可能是起自炎性假瘤、伴纤维性成分的终末期肿物样病变。
IgG4相关病变也需注意鉴别,且SANT可能是诸多IgG4相关病变中的一种。多项研究表明,SANT中间质的浆细胞为IgG4阳性。SANT中可有大量浆细胞、且IgG4:IgG的比值可升高;但血清IgG4水平仅偶见升高。
小结
SANT在脾脏并不少见,但其发生机制还不明确、且有某些争议。尽管典型情况下的自然病史为良性颈管,脾脏切除后无复发或转移,但该病变可能与诸多其他肿瘤相关,且具有CTNNB1基因3号外显子的缺失。一般认为这是一种良性血管性病变,而不是真正的肿瘤;不过也也存在特征性的间质成分、部分病例中可能无法和炎性假瘤或硬化性血管瘤鉴别开。SANT、炎性假瘤、硬化性血管瘤是不同的病种?或者是相同病变的不同表现?SANT是否为有红髓陷入而看上去像血管瘤样结节的增生性间质性病变?这些问题都有待进一步探讨。
脾脏创伤常导致出血、最终形成类似SANT中的纤维硬化性病变。这种纤维硬化性表现中也可有陷入的正常脾脏红髓成分、看上去类似SANT中的血管瘤样结节。因此,SANT可能是始自脾脏不同情况损伤(如创伤、出血、梗死、肿瘤、其他炎性病变)后愈合过程中涉及硬化性和血管反应的一部分。
总之,SANT的发生机制还有争议,且并不确定,但CTNNB1中3号外显子的缺失及Wnt通路的下游激活是其特征性表现,可能在其发生中有一定作用
硬化性血管瘤样结节性转化Tips
SANT一般被视为良性血管性病变;
SANT可伴其他病变、也包括肿瘤性病变;
SANT可能是脾脏出血、炎症或肿瘤情况下的愈合/修复性过程;
部分病例中存在IgG4阳性浆细胞和纤维化,提示与IgG4相关病变有重叠;
SANT中存在某些分子改变,说明这可能是一种肿瘤前或肿瘤性病变。
EB病毒阳性炎性滤泡树突状细胞肉瘤
简介
EB病毒阳性炎性滤泡树突状细胞肉瘤是组织形态学和免疫表型与经典的滤泡树突状细胞肉瘤有重叠的肿瘤。以往曾经将该肿瘤视为滤泡树突状细胞肉瘤的亚型,但二者在发病部位、性别差异、EB病毒相关性方面的差异都对此分类提出了质疑。
EB病毒阳性炎性滤泡树突状细胞肉瘤主要累及脾脏或肝脏,而滤泡树突状细胞肉瘤最常见于头颈部淋巴结和多个软组织部位。文献中报道的主要发生于脾脏的滤泡树突状细胞肉瘤极为少见,且可能是继发性累及或误分类。此外,EB病毒阳性炎性滤泡树突状细胞肉瘤中的EB病毒阳性、女性多见、临床更为惰性,都和滤泡树突状细胞肉瘤不同。有限的分子证据也支持二者不同:滤泡树突状细胞肉瘤为复杂核型,而EB病毒阳性炎性滤泡树突状细胞肉瘤并无常见的遗传学异常。
病理特征
EB病毒阳性炎性滤泡树突状细胞肉瘤为梭形肿瘤细胞构成,并伴显著的淋巴浆细胞浸润。梭形细胞染色质空泡状,且有小而显著的核仁。尽管一般大部分细胞都为温和表现,但偶有细胞的细胞核增大、褶皱、深染,部分细胞类似R-S细胞。常见出血、坏死,可伴有肉芽组织或组织细胞增生。小血管的管壁可见纤维素沉积。瘤细胞可被嗜酸性粒细胞或上皮样肉芽肿性炎所掩盖。该肿瘤免疫表型为滤泡树突细胞表现,如CD35、CD21、clusterin、CAN.42、D2-40和CD23为程度不等的阳性。无滤泡树突细胞标记阳性的区域,瘤细胞可表达SMA,因此可能需要鉴别纤维母细胞性网状细胞分化。与滤泡树突细胞肉瘤相似,组织细胞标记CD68和CD163偶见分布不一的表达。EB病毒为单克隆附加型(monoclonal episomal form)。如果考虑到某些病例可能为分类错误,那么脾脏EB病毒阳性的炎性滤泡树突状细胞肉瘤中EB病毒检出率约为100%。
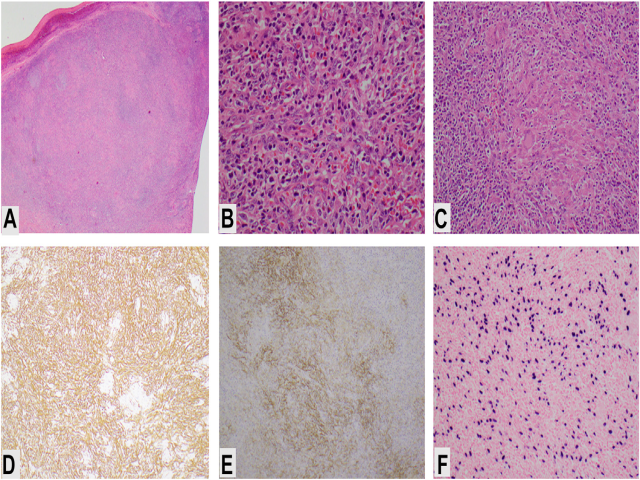
图4.EB病毒阳性的炎性滤泡树突状细胞肉瘤。(A)低倍镜和(B)高倍镜,可见混合性炎症细胞浸润;(C)中倍镜下可见肉芽肿。(D)免疫组化SMA阳性,CD35局灶阳性(E);EB病毒编码的小RNA原位杂交检测在梭形细胞区域为阳性(F)。
鉴别诊断
尽管EB病毒阳性炎性滤泡树突状细胞肉瘤的形态学鉴别诊断范围宽泛,但仅有滤泡树突状细胞肉瘤会有滤泡树突状细胞表型。如前所述,滤泡树突状细胞肉瘤并无EB病毒阳性,且一般不会主要累及脾脏。
脾脏炎性假瘤为非肿瘤性、EB病毒阴性,且并无滤泡树突状细胞表型的细胞。
经典型霍奇金淋巴瘤、尤其淋巴细胞消减型,为B细胞的淋巴瘤,并无滤泡树突细胞免疫表型,免疫组化可EB病毒阳性。肿瘤性的霍奇金性R-S细胞总是表达CD30和PAX5(弱阳性),伴或不伴CD15的表达。EB病毒阳性炎性滤泡树突状细胞肉瘤中类似的大细胞不会有这一染色特征。弥漫大B细胞淋巴瘤为B细胞的恶性肿瘤,表达B细胞标记而不表达滤泡树突状细胞标记。EB病毒偶为阳性,尤其是活化B细胞表型者。
SANT为EB病毒阴性,且并无滤泡树突状细胞表型。
炎性肌纤维母细胞瘤详见炎性假瘤部分,这一病种也无EB病毒阳性,且不会有滤泡树突状细胞免疫表型;部分病例ALK阳性。
小结
EB病毒阳性的炎性滤泡树突状细胞肉瘤为脾脏及肝脏的低级别恶性肿瘤,伴滤泡树突状细胞分化和炎性背景。其组织形态学和免疫表型与滤泡树突状细胞肉瘤之间有所重叠,但临床病理特征不同。
EB病毒阳性炎性滤泡树突状细胞肉瘤Tips
脾脏和/或肝脏的低级别恶性肿瘤,临床病程为惰性;
滤泡树突状细胞免疫表型,且有显著的炎性成分;
EB病毒相关;
女性多见。
——未完待续——
往期回顾:
读文献,学病理-脾脏部分病种学习(一)
读文献,学病理-脾脏部分病种学习(二)














共0条评论