[导读] 编译整理:魏建国,王强
病种拾遗及图例赏析
一.非角化型鳞状细胞癌
该肿瘤中,最近描述了一种分子亚型,即DEK::AFF2融合的癌,约占所有HPV无关非角化型鳞状细胞癌的半数。该亚型形态学为非角化鳞状上皮形成内翻的、相互吻合的分叶状,推挤间质形成外生性(乳头状)生长,有周边栅栏状表现、棘层改变,角化珠的比例不足10%。文献数据称,细胞核着色的免疫组化标记AFF2对于DEK::AFF2融合肿瘤的敏感性和特异性均为100%,但仍需进一步研究。这一亚型非角化型鳞状细胞癌的预后还不完全清楚,但有报道称局部复发率达56%,远处转移瘤达35%,死亡率达25%。
二.实性亚型腺样囊性癌
实性亚型腺样囊性癌为形态均一的基底样细胞呈致密巢状或片状,胞质稀少,散在于黏液样或透明样变性的背景中,核分裂活性高。残余管状或筛状生长的区域,是诊断线索之一。
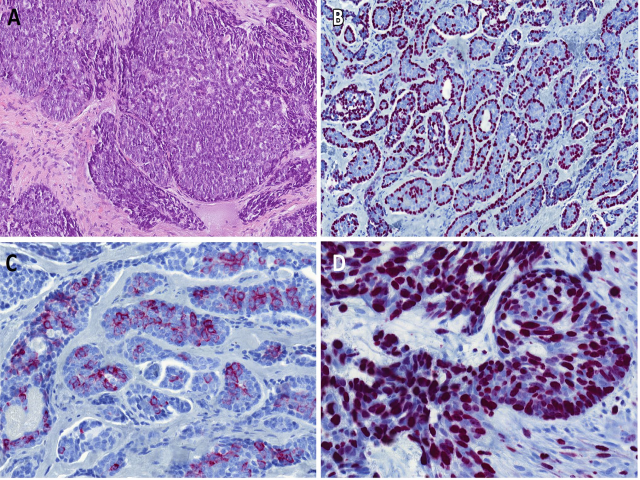
图1.腺样囊性癌:(A)基底样细胞呈实性巢状排列,少许区域有假筛状结构;腺样囊性癌为双相型恶性肿瘤,免疫组化管腔周围细胞表达p63(B,此处表现为显著梁状结构),管腔细胞表达CK7,为胞质/胞膜着色(C)。MYB在两种细胞均为细胞核的弥漫、强阳性着色(D)。
三.HPV相关多表型鼻腔鼻窦癌
该肿瘤也是由HPV所致的双相型上皮性肿瘤,此前曾称为HPV相关的鼻腔鼻窦癌、伴腺样囊性样特征;第五版世界卫生组织头颈部肿瘤分类中将其作为独特病种纳入。需要注意的是,尽管该肿瘤p16免疫组化一般为弥漫、强阳性,但相同结果也可见于腺样囊性癌,而后者与HPV完全无关。因此仅免疫组化p16不足以区分二者,需特殊的HPV检测才可以。
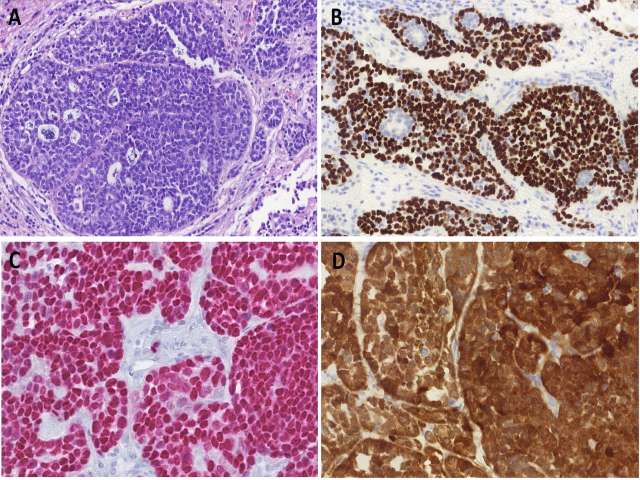
图2.HPV相关的多表型鼻腔鼻窦癌,组织学呈巢状结构,细胞为高级别基底样,且伴腺样囊性癌样假筛状特征(A)。典型的双相型特征可通过假腺样结构区域的基底细胞表达p63、管腔细胞不表达而得以体现(B)。SOX10在管腔细胞和周围细胞均为细胞核弥漫强阳性(C)。免疫组化p16弥漫强阳性,是该肿瘤诊断所必需。
四.鼻腔鼻窦黏膜恶性黑色素瘤
该肿瘤具有异质性,最常见为上皮样细胞或浆细胞样细胞,还可表现为梭形、横纹肌样、透明细胞样、未分化细胞等。瘤细胞疏松黏附、或排列呈实性巢状、束状、席纹状、器官样等,从而可类似多种其他肿瘤。胞质内有黑色素、在黏膜内播散是极好的诊断线索,但很多并无色素,且黏膜为溃疡或未取到。
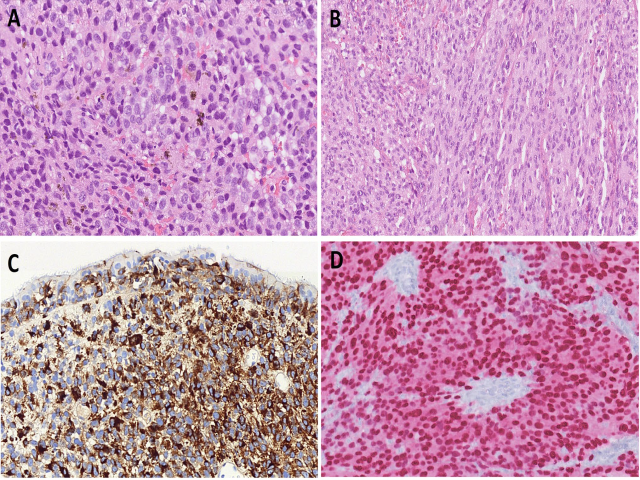
图3.鼻腔鼻窦黏膜恶性黑色素瘤,本例为上皮样细胞(A)或梭形细胞排列呈束状(B)构成的肿瘤,黑色素成分较少。免疫组化HMB45在恶性黑素细胞呈胞质强阳性,同时可显示出其在上方黏膜的雀斑样播散(C);SOX10为细胞核强阳性(D)。
五.SWI/SNF复合体缺陷型鼻腔鼻窦(腺)癌
SWI/SNF缺陷型鼻腔鼻窦癌是指存在SMARCB1和/或SMARCA4的失活。该肿瘤形态学主要为基底样(60%)、浆细胞样/横纹肌样(33%)表现,与非角化型鳞状细胞癌有重叠,但并无鳞状特征、角化、腺样结构。不过该肿瘤免疫组化方面可能会有神经内分泌标记的局灶、弱阳性,因此需注意鉴别神经内分泌肿瘤。
SMARCB1缺陷型鼻腔鼻窦腺癌组织学主要为嗜酸性、浆细胞样,且有特征性的腺体形成,约25%的病例可见卵黄囊特征。
SWI/SNF复合体缺陷型鼻腔鼻窦肿瘤需积极的多学科治疗,但其五年生存率仍接近0。相关靶向治疗及免疫检查点抑制剂治疗可能有一定效果。
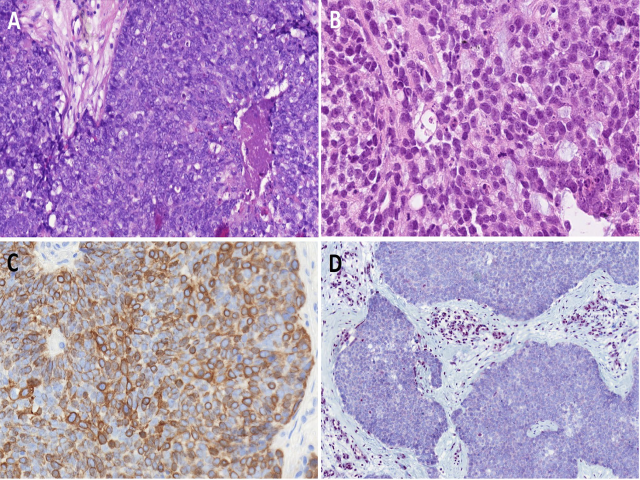
图4.SWI/SNF复合体缺陷型鼻腔鼻窦(腺)癌,为形态相对单一的细胞排列呈实性基底样细胞超,有小的粉刺状坏死(A)。另一例表现为浆细胞样,伴少许小管腔形成,细胞核重叠(B)。瘤细胞弥漫阳性表达CK5/6(C)。SMARCB1(INI1)阴性,淋巴细胞和内皮细胞可作为阳性内对照(D)。
六.NUT癌
该肿瘤的定义是指存在NUTM1基因融合,具体融合配体不一。仅从形态来说,该肿瘤与其他的“小圆形蓝细胞肿瘤”存在显著重叠,如淋巴瘤、恶性黑色素瘤、Ewing肉瘤、未分化癌等。因此该肿瘤的诊断必须结合必要的免疫组化和/或分子检测才可做出。
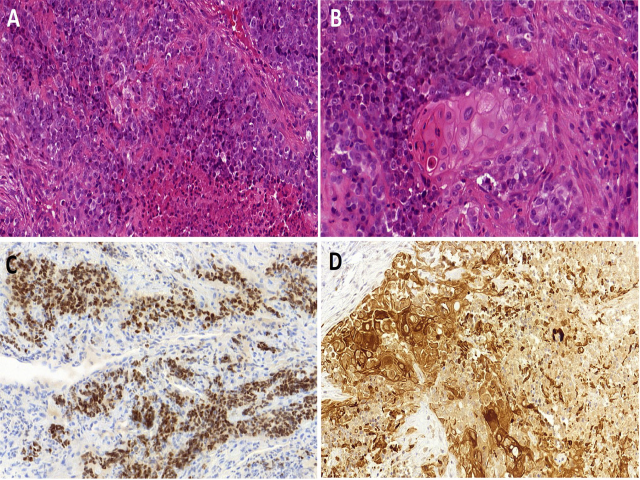
图5.NUT癌。该肿瘤呈实性生长,伴大片坏死,细胞为原始的圆形表现,胞质嗜酸性至嗜碱性,细胞核有显著多形性(A)。出现突然角化的典型表现有助于识别该肿瘤(B)。免疫组化NUT为细胞核着色(C),高分子量CK阳性、尤其角化区域(D)。
七.鼻腔鼻窦未分化癌
该肿瘤在组织学和免疫组化方面并无上皮(包括鳞状上皮和腺上皮)的特异分化,因此属于排除性诊断。该肿瘤虽然可能会有印戒样形态,但并无任何黏液产生。免疫组化方面表达广谱CK和低分子量CK(如CK7、CK8、CK18、OSCAR),但不表达CK5/6和p40;p63不可靠,因为可存在散在的着色。该肿瘤一般EMA阳性,且Syn和CgA可散在阳性,但组织学无神经内分泌分化。
该肿瘤中IDH2突变的几率为50%-88%,可通过突变特异性免疫组化识别出来。其临床意义在于IDH2突变的癌不管表型如何,预后要比SMARCB1缺陷型癌和有其他分子改变的鼻腔鼻窦未分化癌预后好。
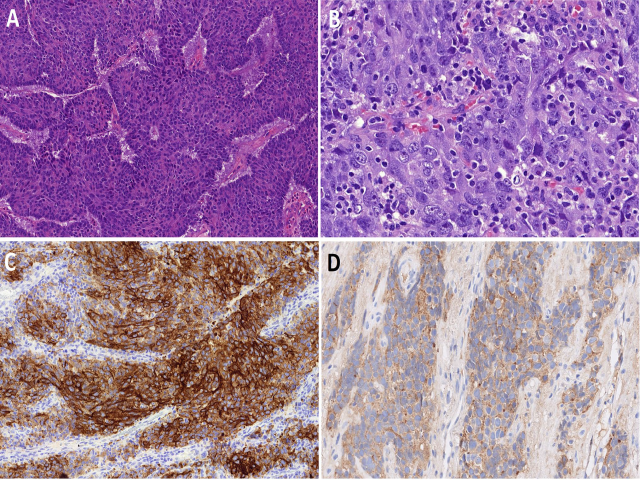
图6.鼻腔鼻窦未分化癌,为高级别基底样上皮细胞呈相互连接的梁状表现(A);可见高级别细胞核特征,如开放染色质、显著核仁、大量核分裂并有非典型核分裂(B)。免疫组化高分子量CK一般为弥漫强阳性(C),也可有Syn的阳性(D)。
八.鼻腔鼻窦畸胎癌肉瘤
由于该肿瘤为上皮。间叶、原始神经外胚层成分的混杂,因此小活检标本中可能因为并未取到所有成分而出现诊断困难。其免疫组化也是组成成分的相应表达。该肿瘤大部分属于SMARCA4缺陷型肿瘤;少部分病例会因为β-catenin突变而出现细胞核的异常表达。
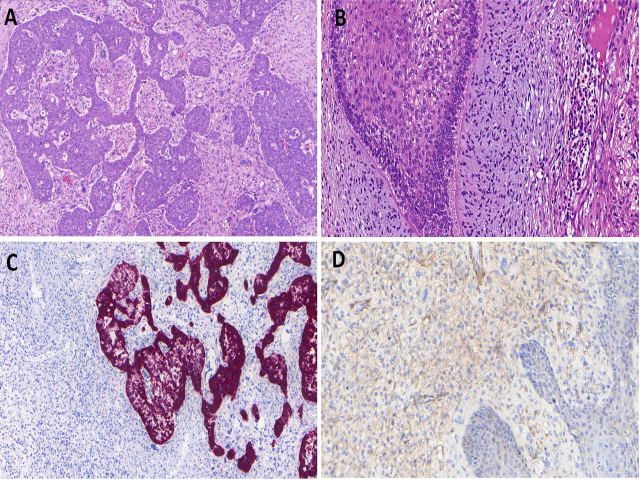
图7.鼻腔鼻窦畸胎癌肉瘤,本例有两种成分构成,上皮呈梁状的癌成分,非典型间质构成的肉瘤样成分(A);上皮成分周围可见束状间质,部分有软骨分化(B)。免疫组化高分子量CK在癌成分阳性,在肉瘤成分阴性(C)。Actin-S在肉瘤成分弱阳性,在癌成分阴性(D)。
九.造釉细胞瘤样Ewing肉瘤
该肿瘤属于Ewing肉瘤亚型,且免疫组化表达CD99和NKX2.2;其中NKX2.2极为敏感,但并不特异,因此应联合CD99共同应用。该肿瘤分子特点为t(11;22)易位导致EWSR1::FLI1融合。仅EWSR1基因重排不足以诊断该肿瘤,因为软组织肌上皮癌也有相同的EWSR1重排;必须确定其配体为FLI1才可做出该肿瘤的诊断。
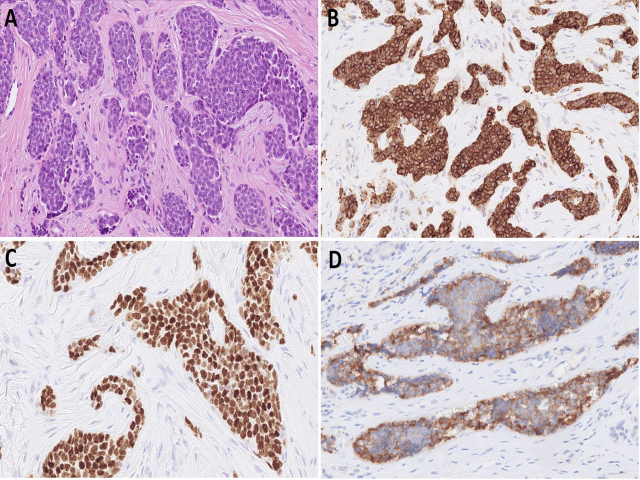
图8.造釉细胞瘤样Ewing肉瘤,细胞为小圆形蓝染形态,胞质嗜酸性、中等量,呈巢状和分叶状结构;周边有轻微栅栏状表现,细胞巢位于促纤维结缔组织增生性间质中(A)。瘤细胞表达高分子量CK(B)、p63(C),CD99呈细胞膜阳性(D)。
十.嗅神经母细胞瘤
根据结构、核分裂活性、细胞核多形性及有无纤维基质、(假)菊型团和坏死,可将嗅神经母细胞瘤分为四级。
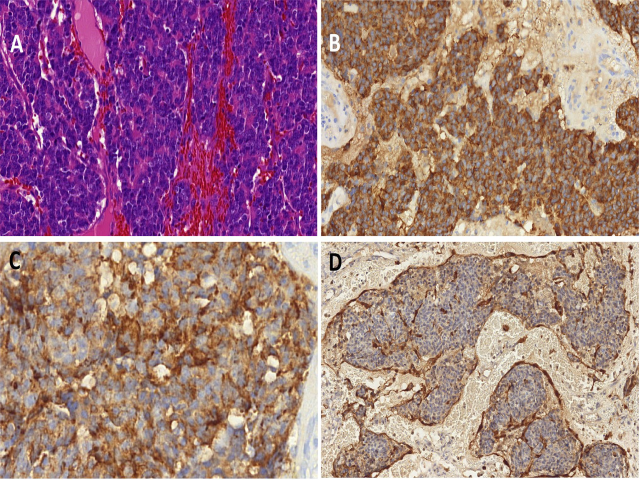
图9.嗅神经母细胞瘤,为多形性基底样神经外胚层细胞呈巢状结构,形成Homer Wright假菊型团(A)。免疫组化Syn(B)和CgA(C)弥漫强阳性,S100在残留支持细胞着色(D)。
往期回顾:
头颈病理十大之鼻腔鼻窦基底细胞样肿瘤十大(一)






















共0条评论