[导读] 译者:慧海拾穗
往期回顾:
经典型霍奇金淋巴瘤的病理诊断和鉴别诊断(1)
【经典型霍奇金淋巴瘤的鉴别诊断】
CHL的需要和以下疾病进行鉴别(图26.16),包括:
•反应性和非典型过程,包括病毒诱导的变化(HTLV1相关变化、EBV淋巴结炎、CMV淋巴结炎等)
•DLBCL•滤泡性淋巴瘤(FL)
•小淋巴细胞淋巴瘤/慢性淋巴细胞白血病和Richter综合征
•富含T细胞/组织细胞的大B细胞淋巴瘤(THRLBL)
•原发性纵隔(胸腺)大B细胞淋巴瘤(PMBL)
•EBV+ DLBCL和其他EBV相关淋巴组织增殖性疾病
•纵隔灰区淋巴瘤(MGZL,大B细胞淋巴瘤,特征介于PMBL和cHL之间)
• ALK+ DLBCL • NLPHL • ALCL
•成人T细胞白血病/淋巴瘤
•LyP和原发性皮肤ALCL(C-ALCL)
•血管免疫母细胞性T细胞淋巴瘤•肠病相关T细胞性淋巴瘤(EATL)•结外T/NK细胞淋巴瘤,鼻型
•外周T细胞淋巴瘤(PTCL),非特指型
•滤泡性T细胞淋巴瘤(FTCL)
•移植后淋巴增殖性疾病(包括HL样变异型)
•低分化癌和其他具有间变性特征的非造血肿瘤
•低级别B细胞淋巴瘤向霍奇金淋巴瘤的组织学转变(CLL,边缘区淋巴瘤的罕见病例,其他)
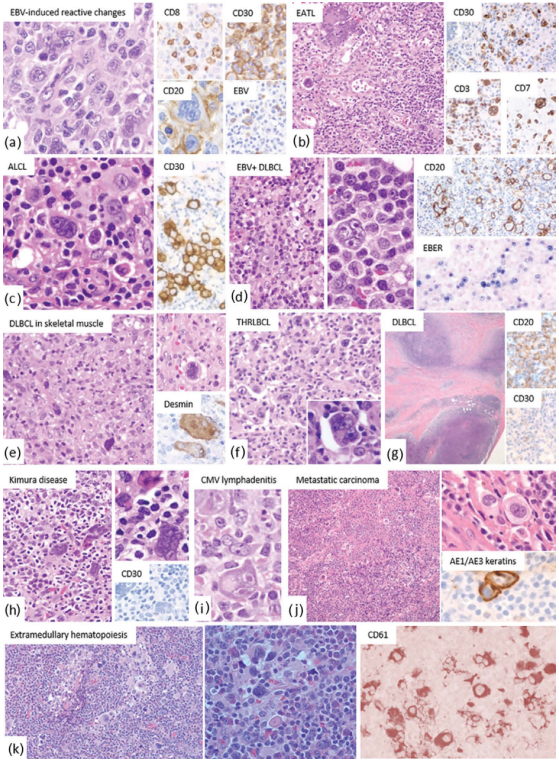
图26.16 CHL的鉴别诊断:(a)EBV引起的变化:非典型大细胞代表CD8+T细胞和大B细胞。CD30和EBV阳性。(b)肠病相关T细胞淋巴瘤(EATL):非典型T细胞CD3、CD7和CD30阳性。(c) ALCL:与HL类似,肿瘤CD30阳性,但它们通常表达一种或多种全T细胞标记物。部分ALCL表达EMA和ALK。(d)EBV相关DLBCL:EBV相关的B细胞淋巴增殖性疾病可能是多形性和单形性。前者可能类似于霍奇金淋巴瘤,特别是当存在R-S样细胞时。(e)DLBCL浸润骨骼肌:退化的肌肉细胞可能与R-S细胞混淆。缺乏CD30表达和desmin、myogenin和/或myoglobin的表达有助于排除HL。(f)富于T细胞/组织细胞的大B细胞淋巴瘤(THRLBCL):肿瘤细胞通常CD45、CD20、CD22、CD79a阳性,CD15和EBV/EBER阴性。(g)DLBCL伴纤维化,类似结节性硬化型HL。(h)木村病:滤泡内大的非典型细胞的位置、多核巨细胞的细胞形态学特征以及缺乏CD30表达将Kimura病与HL区分开来。(i)巨细胞病毒相关性淋巴结炎:具有嗜酸性核内包涵体的大细胞,类似于R-S细胞的大核仁。CMV免疫组化可用于鉴别诊断。(j)具有分散的癌症细胞的转移癌,类似于HL。肿瘤细胞CK阳性;(k)淋巴结中具有巨核细胞(CD61+)的髓外造血。
基于CD30表达的cHL鉴别诊断如下:
•ALCL(ALK+和ALK-)
•PTCL,罕见病例
•AITL
•原发性皮肤ALCL
•成人T细胞淋巴瘤/白血病
•蕈样肉芽肿(MF,转化)和Sézary综合征(SS)
•DLCBL,罕见病例
基于CD15表达的cHL鉴别诊断如下:
•ALCL(ALK+和ALK−),罕见病例•PTCL,罕见病例
基于EBV表达的cHL鉴别诊断如下:
•侵袭性NK细胞白血病(ANKL)
•AITL
•FTCL,罕见病例
•原发性EBV+淋巴结T或NK细胞淋巴瘤(淋巴结TNK)
•儿童系统性EBV+淋巴瘤(STCLC)•EBV+DLBCL、PBL和部分BL
•与EBV感染相关的反应性过程
•移植后淋巴增殖
•甲氨蝶呤诱导的和EBV相关的B细胞淋巴增殖性疾病
•淋巴瘤样肉芽肿(LyG)
基于R-S样细胞存在的cHL鉴别诊断如下:
•反应性过程,尤其是EBV诱导的•ALCL(ALK+和ALK-)
•PTCL
•AITL
•原发性皮肤ALCL(C-ALCL)
•成人T细胞淋巴瘤/白血病
•EATL
•偶尔B细胞淋巴瘤:DLBCL、MZL、CLL(有或无Richter转化)、FL(系统性和原发皮肤)
•移植后淋巴组织增生
• MGZL
反应过程,包括病毒引起的变化
在反应性淋巴结中总是可以看见散在的CD30阳性活化细胞(图26.15)。笔者认为此处有误,应该是图16。与霍奇金淋巴瘤相比,保留的淋巴结和未闭淋巴窦的结构通常支持反应性过程,但局部淋巴结受累或cHL的“滤泡间”变异型可能表现为很少的结构改变。据报道,淋巴结cHLs具有提示Castleman病的特征。仔细评估用于诊断R-S细胞的薄H&E切片和免疫组织化学有助于鉴别诊断。cHL常与EBV感染相关,且有传染性单核细胞增多症病史的患者有患淋巴瘤的风险。
图26.17显示了EBV感染背景下cHL的发展。cHLs(混合细胞和淋巴细胞消减型)也显示与人类免疫缺陷病毒感染相关。偶尔cHLs表现出明显的坏死(淋巴结梗塞),需要与 Kikuchi淋巴结炎(和坏死的大B细胞淋巴瘤)区分开来。
抗CMV或抗HSV免疫染色有助于区分类似CHL中R-S或霍奇金细胞的病毒感染的细胞。病毒性疾病(如传染性单核细胞增多症、疱疹性淋巴结炎和巨细胞病毒引起的改变)可能表现出细胞异型性(具有核仁(免疫母细胞)的大活化细胞)、小的坏死灶和多形性淋巴组织细胞浸润,类似于淋巴瘤。在大多数EBV诱导的变化中,存在多种反应模式,包括滤泡增生、滤泡周围和窦内单核细胞增生以及副皮质区增生。在一些EBV淋巴结肿大病例中,由于多形性浸润伴坏死和免疫母细胞增殖,有时形成片状和R-S样细胞的存在,导致结构变形。免疫母细胞CD30+,但也表达CD45,不表达CD15。许多活化细胞来自T细胞,表达CD8,但CD30+免疫母细胞通常表现为后生发中心B细胞表型(CD20+、BCL6-、CD10-、MUM1-、BOB1+和OCT2+)。
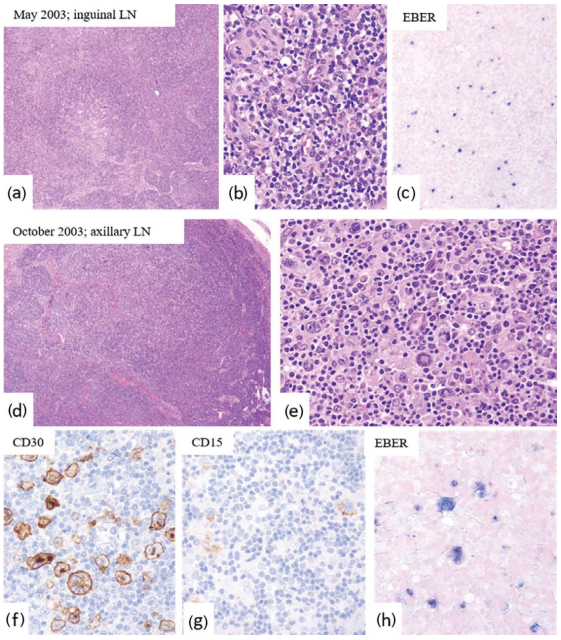
图26.17 EBV感染背景下的经典型HL(患者,男,30岁)。(a-c)腹股沟淋巴结有散在的EBV感染细胞(EBER+)(c)。无诊断性Reed-Sternberg细胞。(d-h)几个月后,患者在腋窝淋巴结中出现HL。CD30(f)、CD15(g)和EBER(h)标记肿瘤细胞。
部分免疫母细胞表达CD20。分离(界限分明)的B细胞和T细胞区以及具有B细胞和T-细胞表型的非典型细胞(免疫母细胞)的存在有助于排除恶性过程。淋巴细胞丰富型cHLs(结节型)需要与具有生发中心进行性转化(PTGC)的反应性淋巴结进行鉴别。
完全淋巴结消失和表达CD30和CD15的R-S细胞的存在确定为cHL。木村病由于有较多嗜酸性粒细胞、浆细胞和纤维化,可能类似于混合细胞型cHL,但其不同之处在于存在反应性生发中心和缺乏诊断性R-S细胞。Volaric等人报道cHL和反应性淋巴结的不同PD-L1表达模式:cHL病例在恶性R-S细胞群中PD-L1表达最高,40%的cHL病例PD-L1表达>50%,而淋巴结中没有这种程度的PD-L1染色[43]。
伴散在Reed-Sternberg样细胞的低级别B细胞淋巴瘤
低级别B细胞淋巴瘤必须与淋巴细胞丰富型cHL鉴别。一些具有显著纤维化的FL在低倍镜下可能类似于结节硬化型cHL。此外,还报道了罕见的FL病例,其淋巴结有嗜酸性粒细胞浸润。在许多低级别淋巴瘤中,包括SLL/CLL、MZL、系统性和原发性皮肤FL,通常存在较大细胞混合,偶尔可能类似于霍奇金细胞或R-S细胞。在FL和CLL中,分子研究表明,部分病例R-S样细胞可与肿瘤B细胞克隆相关。SLL/CLL患者可能会发生组织学转变为大细胞淋巴瘤(Richter’s),其最常见的形式为DLBCL或霍奇金淋巴瘤。SLL/CLL的病史或除了霍奇金淋巴瘤浸润外,具有增殖中心的小B细胞的典型SLL/CLL浸润的存在有助于鉴别诊断。套细胞淋巴瘤可通过表达CD5、CD43、BCL1(cyclin D1)和SOX11的B细胞浸润识别,FL表现出典型的结节结构,淋巴瘤细胞CD10、BCL2和BCL6阳性。MZL主要由中小细胞组成,通常表现为单核细胞。在淋巴结中,残留滤泡定植并破坏滤泡树突状细胞网,在结外MZL(MALT淋巴瘤)中,存在特征性淋巴上皮病变。MZL常伴有单克隆浆细胞。图44.5(第44章)显示了具有R-S样细胞的胃MALT淋巴瘤,提示出现了大细胞转化。
弥漫性大B细胞淋巴瘤及其变异
DLBCL及其变异,如THRLBL、具有间变特征的DLBCL和PMBL可能在形态学和/或表型上类似cHL。DLBCL通常由大片细胞组成,但可能存在散在的R-S样细胞。结内间变型DLBCL(图26.18)显示大细胞片状增生(有或无窦内模式),通常有R-S样细胞。肿瘤细胞B细胞标记物和CD30阳性。R-S样细胞也可在甲氨蝶呤相关B细胞淋巴瘤中见到,并且几乎总是存在于ALK+DLBCL中。与临床病史(长期类风湿性关节炎、女性为主、年龄较大和既往治疗)和免疫组化的相关性有助于建立正确的诊断。cHL,特别是淋巴细胞丰富型和混合细胞型cHL与THRLBL之间的鉴别诊断可能很困难。
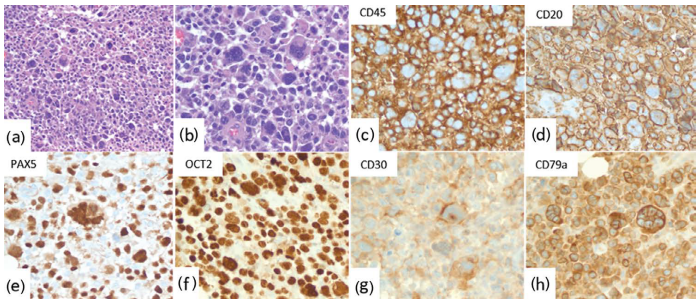
图26.18 DLBCL间变型,具有许多R-S样细胞。(a和b)组织学(中倍和高倍)显示高度弥漫的多形性大细胞浸润有较多多核R-S样细胞。(c–h)免疫组化。肿瘤细胞CD45(c)、CD20(d)、PAX5(e)、OCT2(f)、CD30(g)和CD79a(h)阳性。
具有典型细胞形态和免疫表型的诊断性R-S细胞(CD30+、CD15+、EBV+、CD45-、CD19-、MUM1+、PAX5弱+)的存在有助于诊断cHL。DLBCL常CD45、CD20、PAX5、BOB1、OCT2、CD79a、BCL6和MUM1阳性。少数DLBCL病例表达CD30表达,但CD15为阴性。部分cHL病例可能是CD20+,罕见的病例可能表现出PAX5强表达,另一方面,罕见DLBCL病例可能是CD20-甚至CD45-,这使鉴别诊断复杂化。其他B细胞标记物(如CD19、CD22、CD79a、OCT2和BOB1)的免疫染色有帮助,所有其他B细胞标志物一致强表达将有助于排除cHL。THRLBL是一种B细胞淋巴瘤,与cHL相似,肿瘤细胞只是少数,没有形成片状或聚集(与典型的DLBCL相反)。肿瘤细胞具有中心母细胞或免疫母细胞形态,但有时它们像霍奇金或R-S。它们表达B细胞标记物、CD45,通常表达BCL6(50~90%)和MYC(65%),很少表达CD10。CD30、CD15和CD5通常阴性。
原发性纵隔(胸腺)大B细胞淋巴瘤
PMBL和cHL在形态学和免疫表型特征方面有重叠,因此鉴别诊断可能具有挑战性。PMBL表现为年轻患者(中位年龄为35-3岁)的前纵隔和上纵隔肿块。组织学上表现为大细胞弥漫性浸润,细胞核圆形或多形,细胞质通常透亮。肿瘤浸润伴随着肿瘤细胞被硬化和胶原带分隔。免疫表型上,PMBLs通常CD20、MUM1、BCL6、CD23、CD45、CD79a、p63呈阳性,CD30通常局灶阳性。PMBL中CD30染色强度弱于cHL,cHL中CD20的表达仅在部分病例中阳性,在这些阳性病例中,染色不一(部分)。cHL中的CD15(尽管并不总存在)仅在极少数PMBL病例中阳性。EBV(EBER)阳性也有助于cHL诊断而非PMBL。与PMBL相反,CD23和p63的表达仅在很少cHL中阳性。
纵隔灰区淋巴瘤
纵隔偶发病例,具有cHL(结节性硬化变体)和PMBL之间的重叠特征,被归类为MGZLs(B细胞淋巴瘤,特征介于PMBL和cHL之间)。MGZL最常见于20-40岁年轻男性患者,伴有巨大的纵隔肿块。少数病例可能会扩散到锁骨上淋巴结、肺、肝、脾或骨髓,而其他结外部位的受累则很少。生长模式显示PMBL(片状生长)和结节性硬化cHL(在纤维化基质中具有多形性大细胞)之间的重叠特征。与cHL相比,MGZL通常有稀疏的炎症细胞浸润,肿瘤细胞密度始终很高,尽管在MGZL中可以看到cHL(结节性硬化型)和PMBL之间的完整形态学谱。MGZL的形态学和免疫表型之间通常存在不同步,形态学类似cHL的病例表现出与DLBCL更相似的表型,反之亦然,而组织形态学类似DLBCL的病例表现为R-S细胞的表型。大B细胞淋巴瘤具有霍奇金淋巴瘤和弥漫性大淋巴瘤之间的中间特征(图26.16)。几乎所有的灰区淋巴瘤EBV阴性有助于与EBV+DLBCL的鉴别诊断。病例不应仅基于CD20的强而一致阳性而被归类为灰区淋巴瘤,如cHL中所见。Sarkozy等人发现86例的形态学与cHL更密切相关,但基于所有肿瘤细胞(cHL样MGZL)强表达B细胞标记物(CD20和/或CD79a、OCT2、BOB1、PAX5),具有大B细胞淋巴瘤免疫表型。共有53例病例在形态学上与大B细胞淋巴瘤更密切相关,但具有cHL免疫表型(PMBL样MGZL)。在Sarkozy报道中,24%的GZL与EBV相关,17%不在纵隔部位[5]。CD30在所有肿瘤细胞上一致强阳性表达,特别是当伴有CD15表达时,有助于诊断MGZL而非CD30+DLBCL或PMBL。
图26.19显示了两例具有cHL和PMBL重叠特征的纵隔淋巴瘤(许多B细胞标记物的阳性表达倾向于灰区淋巴瘤而非cHL)。
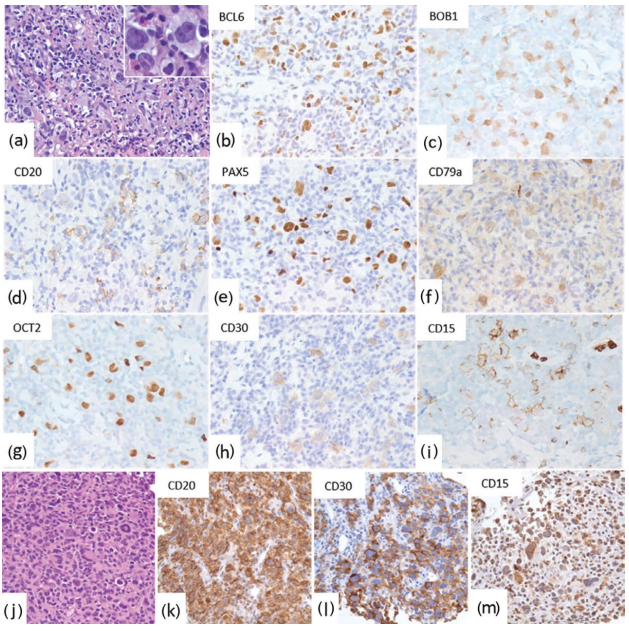
图26.19两例(a-i和j-m)灰区淋巴瘤(纵隔):(a) 组织学显示多形性浸润,有散在大细胞和嗜酸性粒细胞(插图显示R-S样细胞)。(b-i)免疫组织化学。肿瘤细胞BCL6(b;强表达)、BOB1(c)、CD20(d;弱表达)、PAX5(e;强表达,D79a(f)、OCT2(g)、CD30(h;弱表达,和CD15(i)阳性。(j-m)具有大量R-S样细胞(j)的LyG表达CD20(k,强表达)、CD30(l,强表达),和CD15(m;强表达)。
EBV+粘膜皮肤溃疡
EBV+粘膜皮肤溃疡是EBV相关的B细胞增殖,通常具有霍奇金样特征,发生于年龄相关或医源性免疫抑制患者。其特点是局部累及皮肤或粘膜部位,临床过程缓慢。患者表现为口腔粘膜、皮肤或胃肠道有明显的局限性病变,通常是疼痛性溃疡病变。淋巴结不受累。形态学上,溃疡基底通常有密集的多形性浸润,由浆细胞、嗜酸性粒细胞、组织细胞和类似霍奇金或R-S细胞的大转化细胞组成。在病变的底部,有成熟T细胞呈带状浸润。大细胞CD30阳性,并且常常表现出CD20表达不一。半数病例CD15阳性。表达EBER和LMP1。
多形性B细胞淋巴增生性疾病
多形性B细胞淋巴增生性疾病包含非典型B细胞,包括一些可能类似霍奇金和R-S细胞的B细胞。这些病变发生在移植后环境(多形性移植后淋巴增生性疾病)或医源性免疫缺陷环境。与cHL相反,EBER在全形态谱中是阳性的,并且不局限于霍奇金或R-S细胞。病变在停用免疫抑制剂甲氨蝶呤后通常会好转。
EBV+弥漫性大B细胞淋巴瘤
部分EBV+DLBCL病例与cHL重叠,显示大量转化的R-S样细胞和多形态反应性成分。EBV阳性有助于排除THRLBCL。肿瘤细胞表达B细胞标记物、MUM1和CD30(经常),有时与CD15共表达。
淋巴瘤样肉芽肿
LyG是一种罕见的血管中心性和血管破坏性EBV相关B细胞淋巴增生性疾病。主要发生在肺部,其次是皮肤、肾脏、上消化道、胃肠道、肝脏、肾上腺和结膜。浸润呈多形性,混合有小淋巴细胞、组织细胞和偶尔的浆细胞,无中性粒细胞、嗜酸性粒细胞或多核巨细胞。非典型中到大细胞的数量取决于LyG的级别(从I级罕见到III级大量;图26.20)。一些肿瘤细胞可能类似于R-S细胞。肿瘤细胞CD20阳性,CD30可能阳性(不表达CD15)。
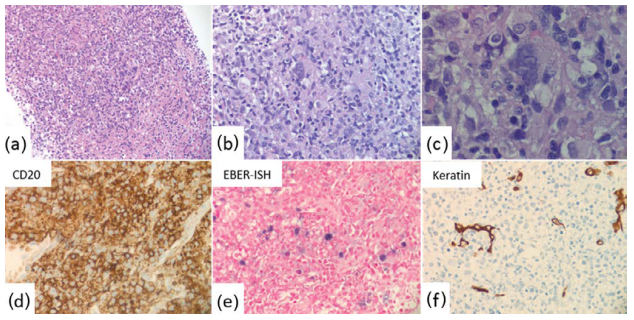
图26.20 LyG(一名33岁HIV+患者的肺活检):(a-c)组织学(低倍、中倍和高倍),非典型多形性浸润,有许多大细胞,有些类似于与3级LyG相似的R-S细胞。(d-f)免疫组化显示大细胞CD20(d)和EBER(e)阳性。细胞角蛋白染色(f)突出残存的肺组织。
间变性大细胞淋巴瘤
cHL和ALCL均为CD30+。ALCL和cHL(尤其是结节硬化型合胞体变异和淋巴细胞消减型)通常具有相同的形态学特征,这可能会导致一些诊断上的困难。B细胞谱系标记PAX5、EBV(EBER)和CD15的表达表明是cHL,因为只有极少数ALCL病例PAX5或CD15阳性。另一方面,EMA、T细胞抗原(CD2、CD3、CD5和/或CD7)、细胞毒性蛋白(穿孔素、TIA1、颗粒酶B)、CD43和CD45表达将指示ALCL。在T细胞标记物中,cHL在罕见情况下可能显示CD2或CD4的表达。当然,ALK的表达应诊断为ALCL。MUM1对于cHL是典型的,但ALCL也可表达。一些ALCL病例可能缺乏泛T细胞抗原表达(所谓的裸细胞型),因此可能需要扩大免疫表型组合(包括细胞毒性蛋白、EMA、CD43、CD4、CD8)来区分这两种实体。在困难的病例中,可能需要对T细胞克隆性分子检测,以确定肿瘤细胞的T细胞谱系。
外周T细胞淋巴瘤
霍奇金样细胞和R-S样细胞通常存在于非特指PTCL及其变体,特别是PTCL的滤泡变异型。类似cHL(尤其是富含淋巴细胞亚型)的大非典型CD30+、CD15+和EBV+霍奇金样和R-S样细胞通常见于具有滤泡生长模式的罕见PTCL变体,称为PTCL的滤泡变异型。PTCL滤泡变异型显示非典型的中小型CD3+T细胞,其TFH表型与AITL相似(它们表达CD10、BCL6、PD-1和CXCL13)。
血管免疫母细胞性T细胞淋巴瘤
霍奇金样和R-S样细胞常见于AITL。AITL中的大非典型细胞表现为B细胞表型,EBV和CD30阳性,这可能导致cHL的误诊(罕见病例甚至可能显示CD15表达)。
T细胞群的非典型表型(包括CD10、PD1、BCL6和CXCL13的表达)和总体组织形态学特征(如血管增多、非典型透明细胞簇和滤泡树突状细胞网膨胀)有助于正确诊断。
成人T细胞白血病/淋巴瘤
成人T细胞白血病/淋巴瘤(ATLL)受累淋巴结通常表现为R-S样细胞和霍奇金样细胞,通常表现为霍奇金样ATLL,但也表现为其他ATLL类型,包括多形性小细胞型、多形性中/大细胞型和间变性大细胞型。
皮肤CD30+T细胞疾病
LyP的特征在于存在类似于R-S细胞的大的多核细胞CD30+。此外,LyP可能偶尔进展为ALCL或cHL。原发性和系统性ALCL也可能累及皮肤。由于cHL很少累及皮肤,因此大多数原发性皮肤CD30+淋巴增生性疾病的鉴别诊断很少包括cHL,而是集中于炎症性或药物性皮肤病、成人T细胞淋巴瘤/白血病(ATLL)和转化型MF。在少数皮肤HL病例中(继发比原发常见),形态学和免疫表型与淋巴结相似。
结节性淋巴细胞为主型霍奇金淋巴瘤
NLPHL主要需与淋巴细胞丰富型cHL鉴别。这两种实体的特点都是以小B淋巴细胞为主,低倍镜下呈模糊结节状,散在非典型大细胞周围的T细胞呈花环状。NLPHL的LP细胞CD45、B细胞标记物(CD19、CD20、CD22、CD79a、BOB1、OCT2和PAX5)阳性,偶尔EMA和IgD阳性,CD30、CD15和EBV(EBER)阴性。PAX5和其他B细胞标记物在NLPHL中的表达比在cHL中强得多。只有零星的NLPHL病例CD30和/或CD15阳性。NLPHL中富含B细胞的结节还含有数量增加的具有滤泡辅助表型(TFH)的小T细胞,表达PD1、CD3、CD4和CD57。
富含组织细胞的聚合物
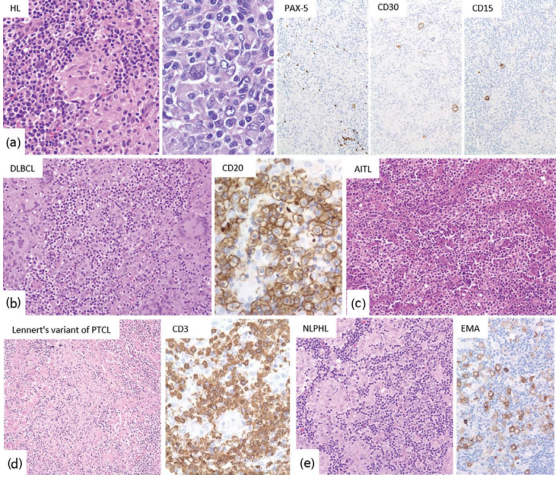
具有大量组织细胞聚集的HL必须与炎性病变(肉芽肿性病变)、Lennert淋巴瘤和其他具有明显上皮样细胞反应的淋巴瘤(如DLBCL、PTCL、AITL或NLPHL)进行鉴别(图26.21)。
非造血肿瘤
转移癌通过免疫表型(肿瘤细胞表达角蛋白)来区分。
骨髓霍奇金淋巴瘤的鉴别诊断
诊断考虑因素(尤其是无cHL病史的患者)包括ALCL、THRLBL、原发性骨髓纤维化(PMF)和其他伴有网织蛋白纤维增加的骨髓增殖性肿瘤、AITL、转移癌、DLBCL、伴Richter综合征的CLL和肉芽肿性炎。



















共0条评论