[导读] 编译整理:魏建国,王强
简介
基因缺陷导致Switch/Sucrose不发酵(Switch/Sucrose nonfermentable,SWI/SNF)染色质重塑复合体组成部分(亚基)失活,已逐渐被视为多种良、恶性肿瘤发生和/或进展机制中的核心型分子驱动事件,且涉及所有组织学谱系(上皮性、间质性、脑膜、神经胶质、血液系统、黑素细胞)及多个不同器官。SWI/SNF复合体中的20多个基因中,近些年研究较多的是SMARCB1(INI1)、SMARCA4、SMARCA2、ARID1A。对于所有瘤种来说,SWI/SNF基因突变的总体发生率约为20%,与TP53突变的几率相似。与SWI/SNF的肿瘤抑制功能相符,其致病机制是失活突变或缺失导致相应基因产物(蛋白)缺失。目前已有针对SWI/SNF蛋白的质量可靠、商用免疫组化检测抗体,且已成为这类基因型诊断和筛查的强大、新兴工具,是这类新兴癌种识别的重要基础。
目前为止,还没有针对这类罕见和极具侵袭性病变的特异性治疗方案。不过其异乎寻常的侵袭性,加之有报道称对某些特殊化疗方案的效果更好,强烈支持将该组肿瘤单独分类。SMARCB1缺陷型、SMARCA4缺陷型肿瘤有些对于铂类为主的化疗方案效果很好;针对EZH2、CDK4/6、其他SWI/SNF复合体问题的相应治疗方案已在临床取得了不错的效果。最后,越来越多的证据表明,SWI/SNF缺陷型恶性肿瘤中至少有一部分可能对免疫检查点抑制治疗效果很好,但尚未得到重复验证。
所有上述信息都表明,应该对这类罕见恶性肿瘤进行精确分类;只有这样做,才有可能有针对性的在形态-分子基础上进行特异性治疗方案的研究和优化。SWI/SNF复合体中基因突变的不同有显著的部位特异性,如女性生殖器官主要为ARID1A突变,软组织肿瘤主要为SMARCB1突变,肺癌主要为SMARCA4突变。与此一致,鼻腔鼻窦处肿瘤的SWI/SNF改变主要局限于SMARCB1(INI1)和SMARCA4亚基。德国病理专家Agaimy曾在《Adv Anat Pathol》杂志撰写综述,详尽介绍了SWI/SNF缺陷型鼻腔鼻窦癌的流行病学特征、临床病理学特征和分子特征。为帮助大家更好的了解相关知识点,我们将该文要点编译介绍如下。
SMARCB1缺陷型鼻腔鼻窦癌
SMARCB1是SWI/SNF复合体中的核心亚基,定位于染色体22q11.2。这一进化上高度保守的肿瘤抑制因子普遍表达于所有类型正常人体细胞的细胞核、无SMARCB1失活改变肿瘤的细胞核。SMARCB1基因双等位失活导致该蛋白表达缺失。SMARCB1缺陷是很多肿瘤性病变的定义性特征,也是诊断依据,具体如软组织的上皮样肉瘤、颅内及颅外的恶性横纹肌样肿瘤(所谓非典型畸胎瘤/横纹肌样肿瘤【atypical teratoid/rhabdoid tumors,AT/RT】)、肾髓质癌。此外,还有数量不等的其他上皮性和间质性病变可出现原发性或继发性SMARCB1表达缺失、伴或不伴相关去分化。
1.SMARCB1缺陷型鼻腔鼻窦癌
部分低分化或未分化鼻腔鼻窦癌中存在SMARCB1缺陷,最初是2014年由两个独立研究小组发现的;其后又有个别案例报道,最大的一组多机构研究包括了39例患者。目前为止,文献中对此报道不足200例,但该肿瘤肯定比报道中的更为多见。
SMARCB1缺陷型鼻腔鼻窦癌男性患者稍多见。患者年龄19-89岁不等,平均52岁。大部分病例表现为局部进展期(cT4)。就鼻旁窦来说,最常受累的是筛窦,鼻腔一般为鼻窦受累基础上不同程度累及,但单独鼻腔受累并不常见。
SMARCB1缺陷型鼻腔鼻窦癌的定义为:(1)无其他类型鼻腔鼻窦癌的明确特征;(2)形态学无鳞状分化或腺样分化;(3)SMARCB1表达完全缺失。与大部分SMARCB1缺失型肿瘤相同,该类肿瘤细胞形态单一,细胞和细胞核特征方面无明显多形性,细胞核无污浊、怪异表现,无瘤巨细胞。大部分(60%)病例表现为基底样细胞形态,偶尔可能与经典的非角化型基底样鳞状细胞癌无法区分。如前所述,从定义来说,无明显鳞状特征及角化。此外,基底样细胞常与间变表现的较大细胞混杂在一起。细胞一般形成大而界限分明、常伴分支的实性巢状及片状。约30%的病例有嗜酸性细胞,常呈浆细胞样,偶见横纹肌样形态。基底细胞样肿瘤中同样散在浆细胞样和/或横纹肌样细胞,但一般仅为仔细检查时偶见。最初的报道中,个别病例有局灶腺样表现,但目前将有腺样结构形成的肿瘤视为SMARCB1缺陷型鼻腔鼻窦腺癌的亚型,详见后述。个别病例中局灶有透明细胞,但梭形细胞和肉瘤样特征极为罕见。文献中报道的病例均未见表面上皮异型增生和原位癌,但肿瘤在表面上皮的定植和Paget样播散可非常类似表面上皮异型增生或原位癌。
免疫组化方面,SMARCB1缺陷型鼻腔鼻窦癌均一表达CK;大部分病例程度不等的表达鳞状表型,部分或局灶、片状直至弥漫的表达CK5(64%)和p63/p40(55%)。近半数(48%)病例表达CK7。所有报道的病例均不表达高危型HPV、EBV和NUT。神经内分泌标记局灶表达的情况也有报道。虽然SMARCB1缺失是其定义性特征,但SWI/SNF其他亚基的共缺失罕见;个别病例中可能有SMARCA2(但不是SMARCA4和ARID1A)的缺失(译者注:该处的“缺失”原文表述为“detected”,经查阅参考文献,应结合上下文,理解为“缺失”)。
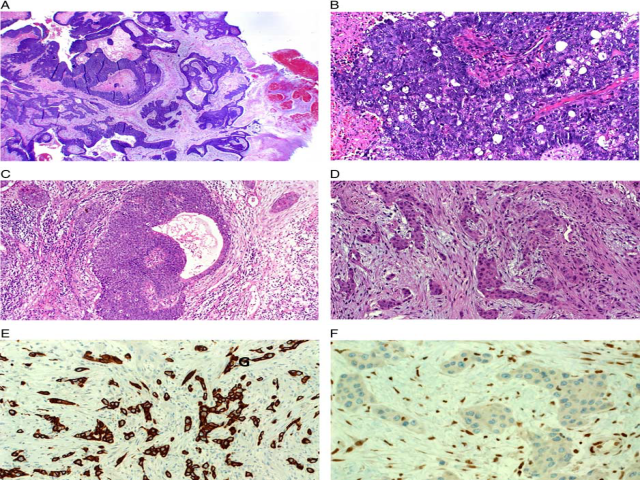
图1.SMARCB1缺陷型鼻腔鼻窦癌典型例子:(A)基底样(深染)形态单一的细胞、沿着表面上皮生长并取代表面上皮和固有黏膜腺体,低倍镜下形成外生性-内生性乳头状生长;(B)有黏附性的、形态单一的基底样细胞,外周有一定栅栏状结构;(C)程度不等的取代正常呼吸道腺体,可类似原位癌;(D)本例表现为鳞状表现更为显著的、低黏附性、小的浸润性细胞巢,位于促纤维结缔组织增生间质内,免疫组化强阳性表达CK5(E),SMARCB1表达缺失(F)。本例最初诊断为鳞状细胞癌,但对铂类为主的化疗方案效果极好,因此进行了会诊,修订诊断为SMARCB1缺陷型鼻腔鼻窦癌。
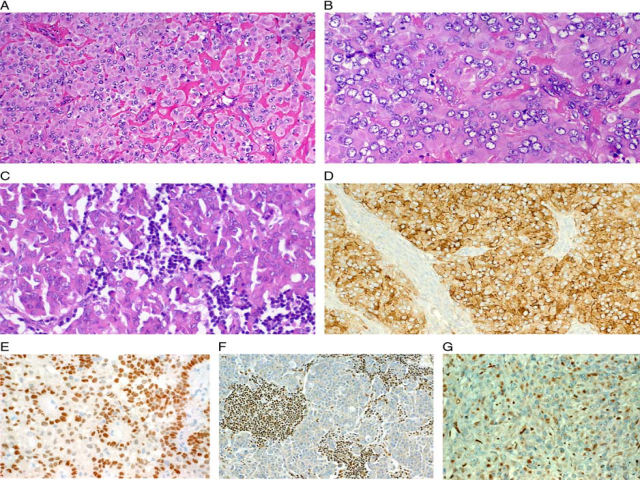
图2. SMARCB1缺陷型鼻腔鼻窦癌的少见特征:(A)瘤细胞嗜酸性,胞质丰富,形成大小不一的细胞簇和细胞巢,类似肌上皮肿瘤;(B)高倍镜下,细胞核形态均一;(C)另一例淋巴结转移病例,肿瘤细胞嗜酸性,可能会误判为非角化型鳞癌;(D)这类罕见的无角化肿瘤内,EMA强阳性表达很有意义;(E)50%-60%的病例中可有p40的中等程度至局灶阳性表达;(F)本例淋巴结转移灶中,SMARCB1表达完全缺失;(G)个别病例中,SMARCB1可能会与横纹肌样细胞包涵体有交叉反应,导致程度不等的胞质着色,不要误判为SMARCB1仍有表达。
大部分病例中,可通过FISH检出累及SMARCB1基因位点的双等位基因(纯合型)缺失或单等位基因(杂合型)缺失。较大基因panel检测的病例中未见其他驱动突变,尤其无IDH2突变,可以与鼻腔鼻窦未分化癌鉴别。
SMARCB1缺陷型鼻腔鼻窦癌临床行为具有侵袭性,总生存时间中位数39个月。死因主要为局部进展、无法切除的病变,但也有局部转移和远处转移导致死亡的报道。单变量分析表明,男性、T4b的分期是总生存期的显著决定因素;多变量分析表明,仅T4b具有显著预后意义。
尽管尚无针对这一肿瘤类型的前瞻性治疗研究,但部分病例偶尔应用铂类为主的化疗发现有非常显著的效果,提示需准确诊断出这一病种,这样也有利于未来对其进行恰当治疗方案的评估。
该肿瘤主要应根据具体病例中的组织形态学表现来确定鉴别诊断。以往,大部分病例都被归为鼻腔鼻窦未分化癌谱系,或被称为基底样非角化型鳞状细胞癌、肌上皮癌。罕见情况下,呈横纹肌样特征的肌上皮癌也可表现为SMARCB1缺失,此时类似SMARCB1缺陷型鼻腔鼻窦癌。不过,SMARCB1缺陷型鼻腔鼻窦癌中一般并不表达肌上皮标记(S100、SOX10、calponin、SMA)。SMARCB1缺陷型鼻腔鼻窦癌中出现p16团块状着色的情况并不常见,这种情况更提示HPV相关基底细胞样鳞状细胞癌。根据定义,SMARCB1缺陷型鼻腔鼻窦癌并不表达NUT蛋白,也并无致癌性HPV感染和EBV感染。其他部位原发或转移的SMARCB1缺陷型肿瘤在罕见情况下也可发生于头颈部,同样应注意鉴别。
——未完待续——
点此下载原文献
参考文献
[1]Agaimy A.SWI/SNF-deficient Sinonasal Carcinomas.Adv Anat Pathol.2023;30(2):95-103.
doi:10.1097/PAP.0000000000000372















共0条评论