[导读] 译者:陈旭
导读
第5版WHO乳腺肿瘤分类(2019),将小叶肿瘤(LN)定义为“起源于终末导管小叶单位(TDLU)失粘附性上皮细胞的不典型增生,伴或不伴有终末导管的Paget样播散”。LN包括不典型小叶增生(ALH)和小叶原位癌(LCIS)。近年来,随着分子病理学不断发展,对组织学形态特征的认识不断深入,加深了对小叶肿瘤及其亚型的研究和分析。最近发表了一篇优秀综述[1],详尽总结了目前乳腺LN的指南更新。现全文翻译如下,供参考。
简介
自1941年Foote和Stewart首次描述“小叶癌”以来,LCIS和ILC的范围已经扩大。他们最初描述了一种原位癌的一种罕见类型,其累及小叶和较小的小叶内导管(相对于最常见的“非浸润性粉刺癌”,后者累及较大的导管),由非粘附性细胞组成,伴有浸润性成分,分别符合病理医师目前认为的经典型LCIS和经典型ILC。从那时起,ILC的几种形态变异型,以及LCIS的不同亚型得到了多数病理医师的认可。
在20世纪90年代初期,免疫组织化学(IHC)将E-cadherin(一种在细胞间粘附中起关键作用的跨膜蛋白)的缺失,确定为小叶癌的一个决定性特征。编码E-cadherin的CDH1基因的双等位基因失活,在随后的研究中,被证实是ILC和LCIS发病机制中的关键步骤。
本综述重点关注:①非浸润性LN,即ALH和LCIS的诊断和当前分类,以及对治疗的影响;②IHC的作用;③新描述的ILC形态变异型;④具有混合导管和小叶特征的浸润性癌的临床病理学特征和命名法;⑤浸润性癌伴小叶表型的诊断及其临床意义。
1、非浸润性LN
非浸润性LN,是TDLU的非粘附性上皮细胞的增殖,但也可能以Paget病样生长模式累及终末导管。肿瘤细胞可分为三种类型:A型和B型细胞,以及具有小叶表型(非粘附性)和多形性核(至少是淋巴细胞核的四倍大小)的细胞。A型细胞较小,细胞核圆形至椭圆形,核仁不明显,细胞质稀少。B型细胞稍大,大小和形状有所不同,细胞质更丰富,可能显示出明显的核仁。这些细胞的增殖,在TDLU中的程度和范围,以及细胞学特征和受体谱上各不相同,并且根据当前的世界卫生组织(WHO)分类,分为ALH和LCIS,其中包括经典型小叶原位癌(CLCIS)、旺炽型小叶原位癌(FLCIS)和多形性小叶原位癌(PLCIS)(图1)。这些病变的形态学标准详见表1。ALH和CLCIS代表形态学谱,通常称为LN。
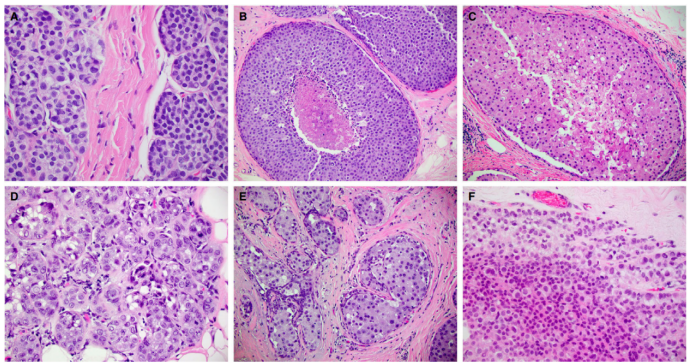
图1.非浸润性LN。A,经典型LCIS具有A型(右)和B型细胞(左)。B,旺炽型LCIS伴坏死。C,旺炽型LCIS伴大汗腺细胞学特征。腺泡明显膨胀,没有显著的核多形性和丰富的嗜酸性细胞质。D,多形性LCIS累及小叶,没有明显的腺泡膨胀。E,多形性LCIS伴大汗腺细胞学特征。F,LCIS,经典型为主,伴散在的多形性细胞。
表1.ALH和LCIS的形态特征

应该注意,现认为FLCIS是一种实体,“旺炽型”一词不应该用来描述广泛的CLCIS。在第5版WHO分类中,没有说明诊断FLCIS所需的受累腺泡数或范围的最小程度,也不清楚单个腺泡受累时是否应诊断FLCIS。如果肿瘤细胞增殖导致大量腺泡扩张,能对应于放射学肿块伴钙化,或显示中央性坏死,则建议诊断FLCIS。在粗针穿刺活检(CNB)中偶然发现的A型或B型细胞(直径约40个细胞)增殖累及单个腺泡,目前其临床意义尚不确定。
不同类型的非浸润性性LN之间的区别,可能并不总是那么简单。偶尔,呈现典型的LN细胞学的原位病变,腺泡扩张程度可能介于CLCIS和FLCIS之间。在这些病例中,无论累及多少腺泡,WHO都建议将其归类为CLCIS。罕见病例中,以ALH或CLCIS形态为主的病变,可能偶尔会出现较大的细胞,并伴有轻度至中度的核多形性。目前建议将其分类CLCIS伴B型细胞。这些发现的生物学和临床意义,目前尚不清楚。
LCIS的主要鉴别诊断是导管原位癌(DCIS)。具有低或中级别细胞核的DCIS,可能类似CLIS或FLCIS(图2A,B)。同样,PLCIS可能类似于高级别DCIS。二级管腔和筛状结构的存在,倾向于导管分化;然而,应该注意,并存LN和残余良性上皮细胞的腺腔,可能类似非典型导管增生性病变。此外,LCIS和DCIS可能共存于同一个腺泡中(图2C,D)。如果原位出现粉刺坏死,对于具有混合特征的癌,诊断线索是坏死碎片与相邻细胞之间界面的出现。在LCIS中,与坏死相邻的细胞,呈圆形至椭圆形,非粘附性,而在DCIS中,细胞粘附性更强,与坏死碎片相邻的顶膜具有明确的线性外观(图2E,F)。
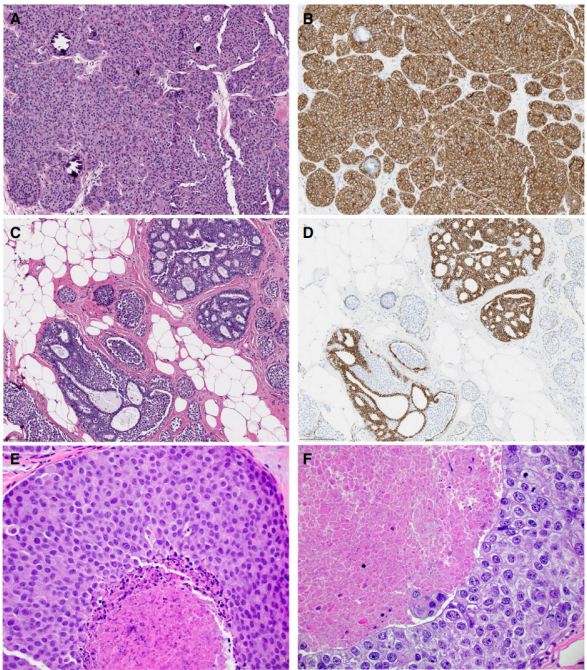
图2.小叶原位癌(LCIS)和导管原位癌(DCIS)的形态学重叠和鉴别。A,类似LCIS的低级别DCIS。存在不连续的细胞膜和少数二级管腔,管腔周围细胞具有相似的形态学,使得管腔似乎位于实性成本中,应该怀疑DCIS的可能性,并由E-cadherin(B)染色模式证实。C,具有筛状结构的低级别DCIS和LCIS累及相同的导管。E-cadherin免疫染色(D)突出显示两种细胞群。E,肿瘤细胞和坏死碎片之间有明显分界,有助于辨认LCIS,它显示更参差不齐的外观。相比之下,DCIS(F)似乎由肿瘤细胞的顶端细胞膜形成一条清晰的界线。
ALH和CLCIS较常见于绝经前妇女。这些病变通常在临床和放射学上具有隐匿性,通常是偶然发现的。ALH和CLCIS通常是双侧和多中心生长的,但它们的真实发病率很难确定。虽然ALH和CLCIS,通常合并为LN,但与一般人群相比,ALH患乳腺癌(BC)的相对风险是正常人的4-5倍,CLCIS是正常人的8-10倍,因此区分两者,可能有助于准确的风险评估。
相反,FLCIS和PLCIS主要为绝经后妇女,并且通常伴有ILC。不伴浸润性肿瘤的FLCIS和PLCIS的情况是罕见的,这些病例的X线检查主要表现为钙化,偶有肿块或结构变形。
CLCIS几乎总是ER阳性和HER2阴性。与此相似,FLCIS通常是ER阳性(94–100%),但在5–18%的病例中HER2过表达。具有大汗腺分化的FLCIS,较少出现ER阳性(33%)。与CLCIS和FLCIS相比,PLCIS在14-34%的病例中呈ER阴性,特别是伴有大汗腺化生的PLCIS(18-100%ER阴性),并在13-43%的病例中显示HER2过表达。无论亚型如何,雄激素受体在LCIS中几乎总是阳性。
除了CDH1基因的双等位基因失活(LN的标志)之外,靶向二代测序研究,已经确定了FLCIS和PLCIS中重现性ERBB2、ERBB3改变。在一项研究中,使用基于阵列的比较基因组杂交,FLCIS显示出比CLCIS更多的基因组改变,并且FLCIS具有与大汗腺PLCIS相似的基因组复杂性。这些研究表明,FLCIS和PLCIS在生物学上与CLCIS不同,表明其具有更强的侵袭性。
2、CNB诊断LN的临床管理
非浸润性LN的管理,因病变类型和全球不同实践而异(表2)。然而,相关专家一致认为,应切除病理学和影像学结果不一致的病灶。
表2.粗针穿刺活检诊断的原位小叶癌管理区域指南
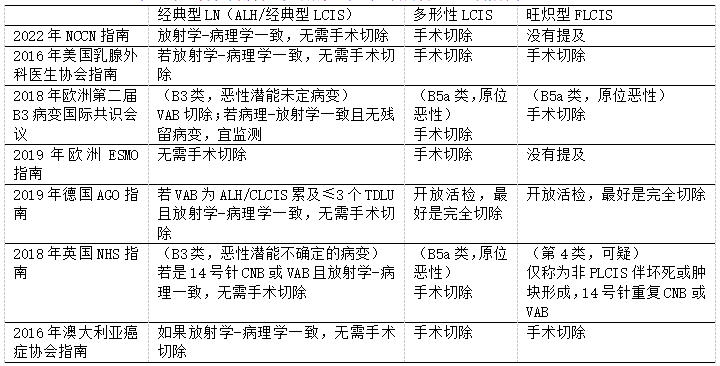
CNB,粗针穿刺活检;VAB,真空辅助活检
目前,大多数指南不支持对CNB诊断的ALH和LCIS进行手术切除。美国的管理倾向于保守治疗,患者通常进行随访,并提供化学预防和内分泌治疗。在2019年早期BC管理指南中,欧洲肿瘤内科学会对于LN管理描述为:“不像DCIS,LN视为浸润性癌的非必然前驱病变。作为双侧乳腺未来发生浸润性癌的风险因素(相对风险5.4–12),不需要积极治疗”。同年,一个由欧洲专家组成的多学科小组发表的共识建议,认可使用真空辅助活检(VAB)切除ALH和LCIS(分类为B3病变),前提是在病灶影像学上可见。英国国家卫生服务局推荐类似的管理。如果在VAB中ALH或CLCIS累及的TDLU少于4个,德国妇科肿瘤组乳腺委员会不建议手术切除。VAB切除术,是一种局麻微创手术,它在欧洲国家盛行,但北美少见。
相比之下,CNB诊断的PLCIS需要随访切除。美国、澳大利亚和大多数欧洲国家,也认可FLCIS的手术切除(其中FLCIS被归类为B5a病变——原位恶性),但在英国除外。在英国,FLCIS被归类为B4病变,进行治疗时,用14号针进行CNB或VAB。
AJCC癌症分期分类手册第8版,未将LCIS包括在Tis类别中。然而,LCIS在第8版UICC恶性肿瘤分类中,仍被归类为Tis(LCIS),就像在第7版AJCC分期中一样。LCIS在当前的AJCC分类中,被认为是良性实体,但没有提及PLCIS和FLCIS。
3、手术标本中的LN
手术切缘存在的经典型LN,不需要再次切除,不应报告切缘状态,无论它是风险最高的发现还是伴有非经典型LCIS、DCIS或浸润性癌。PLCIS和FLCIS的处理,需要完全切除;然而,目前还没有关于这些病变的切缘满意度的指南(表3)。此外,缺乏关于放疗和化学预防对这些患者作用的研究。欧洲肿瘤内科学会(ESMO)从治疗的角度,将PLCIS视为高级别DCIS,其中包括对接受保乳手术的患者进行辅助放射治疗。
表3.手术切除非浸润性LN的手术区域管理指南
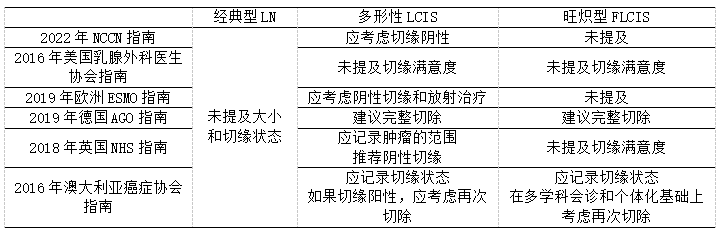
在2016年切除标本病理学报告指南中,英国皇家病理医师学院建议记录PLCIS和FLCIS(指具有经典细胞学、中央坏死和扩张腺泡的LCIS)的疾病范围和切缘距离。美国病理医师协会目前的指南,在癌症报告模板中不包括FLCIS和PLCIS。
为了标准化切除标本中PLCIS和FLCIS的报告标准,国际癌症报告合作组织(ICCR)最近发布了相关专家的建议,其中包括来自八个不同国家的10名乳腺病理医师、1名乳腺外科医生和1名乳腺放射肿瘤学家。数据集【也是为报告DCIS和其他低级别病变,如包膜乳头状癌(EPC)、实体乳头状癌(SPC)原位和Paget病】包括必填和推荐字段(表4)。重要的是,对于PLCIS和FLCIS,专家建议记录疾病的范围和切缘状态,因为这些病变看起来更像DCIS,而不是CLCIS。非CLCIS不需要核级别(对DCIS是强制性的),因为根据定义,PLCIS应该是高级的,而FLCIS应该是低级或中级的核级别。该指南提到了对DCIS手术标本中微钙化的评估(如果这是活检指征)。虽然这不是针对FLCIS和PLCIS指定的,但这些病变最常在活检中检测到可疑钙化,因此还应进行病理评估,以及与标本X线对照确认。同样,该数据集包括ER评估,作为DCIS所需的辅助研究。这也应包括在FLCIS和PLCIS的报告中。
表4.ICCR推荐的用于报告手术标本中的FLCIS和PLCIS的数据
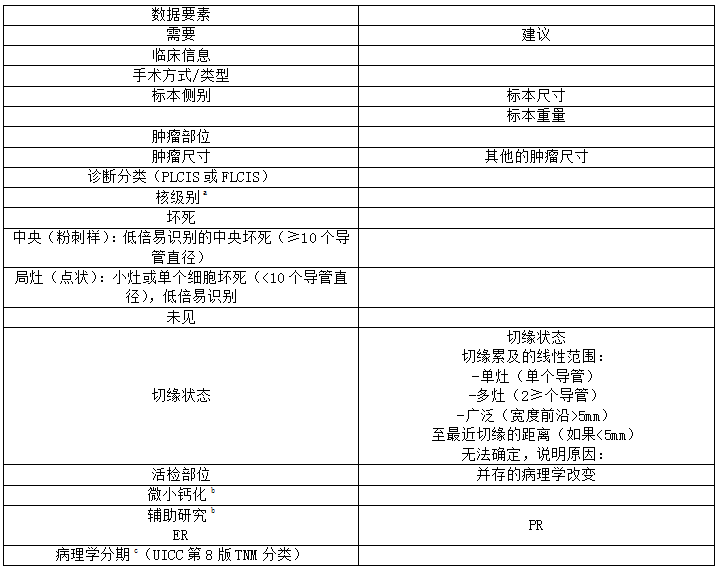
a.根据定义,PLCIS应为高级别核,FLCIS应为低或中级别核。
b.在这部分指南中专门未提及FLCIS或PLCIS。
c.AJCC第8版TNM分类的Tis类别中未包括LCIS。UICC第8版仍包括LCIS作为原位癌。
4、免疫组织化学
E-cadherin表达缺失,被认为是小叶病变的标志;然而,在高达24%的ILC和LCIS病例中,都描述了E-cadherin异常表达。异常的E-cadherin表达,可以有不同的模式,例如减少(与正常小叶中的染色相比)、不完整的膜表达、点状核周高尔基体型模式和弥漫性细胞质染色。在一小部分ILC中,也描述了强烈、完整的膜染色。然而,保留E-cadherin表达的小叶病变,显示细胞质p120或缺乏膜β-catenin,表明cadherin-catenin复合物功能障碍,这是ILC和LCIS的特征。专家建议使用E-cadherin进行初始染色,以帮助对形态不明确的癌进行分类,而p120和β-catenin可以进一步帮助确认具有不一致形态和E-cadherin染色的肿瘤。需要注意的是,诊断ILC时E-cadherin染色不是必需的,乳腺病理专家的意见是,E-cadherin不应在原位或浸润性癌中显示清晰的小叶形态。
在检查原位病变时,E-cadherin染色模式的解释,应始终结合形态学,因为残留的良性导管上皮和混合的肌上皮细胞,显示E-cadherin呈膜表达,不要误认为肿瘤细胞仍有表达。此外,与良性导管上皮细胞相比,肌上皮细胞可能显示E-cadherin染色减少,这可能被误解为LN。
——未完待续——
点此下载原文献



















共0条评论