[导读] 作者:张波
原发性鼻腔黏膜黑色素瘤1例临床病理学分析
张波1,林秋宁2,陈恒宇3,郝兴辉4
广东医科大学附属第三医院(佛山市顺德区龙江医院)
[关键词]鼻腔肿瘤;黏膜黑色素瘤;临床病理分析
[中图分类号]R739.62
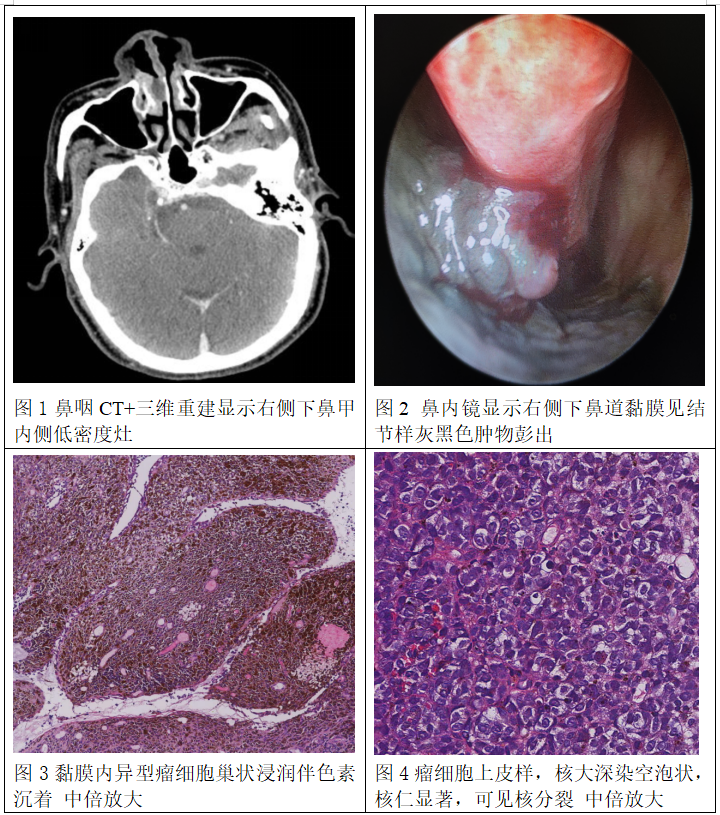
患者男性,75岁,临床表现右侧鼻腔无明显诱因涕中带血10余天就诊,皮肤粘膜等未见明显异常。鼻咽CT+三维重建:鼻中隔稍向左侧偏曲,双侧下鼻甲稍肥厚,右侧下鼻甲内侧低密度灶(图1)。专科鼻内镜检查:鼻粘膜充血,鼻中隔不规则偏曲,双侧下鼻甲肥大,右侧下鼻道黏膜见结节样灰黑色肿物彭出(图2)。
病理检查 (右侧下鼻道)灰红色碎组织一堆,共大小1.0cm×0.6cm×0.3cm,质软,全埋。镜下黏膜组织间质内见异型瘤细胞巢状浸润,瘤细胞上皮样胞质少,核大深染,部分细胞核呈空泡状或双核,核仁显著,核分裂及色素沉着可见(图3-4)。免疫组化结果显示瘤细胞表达S-100、HMB45、MelanA, CK、CK5/6、CD56、Syn、LCA均不表达,p53为野生型,Ki-67增殖指数约40%,EBER原位杂交阴性。二代基因测序(Next Generation Sequencing,NGS)检测到 CDKN2A和CDKN2B 纯合缺失。
病理诊断:(右侧下鼻道)原发性黏膜黑色素瘤。
讨论 黏膜黑色素瘤 (mucosal melanoma,MM)是黑色素瘤的特殊类型,最新 WHO分类[1] 将MM分为黑色素瘤,NOS、结节性黑色素瘤及黏膜雀斑样黑色素瘤。原发部位包括头颈部(鼻咽和口腔)、胃肠道(上消化道和下消化道)、泌尿生殖系统、 呼吸系统和其他部位[2]。原发性鼻窦鼻腔黏膜黑色素瘤(sinonasal mucosal melanoma,SNMM)罕见且具有高侵袭转移性以及较差预后的特点。一项来自美国的(national cancer databases,NCDBS)研究描述,原发性MM占所有黑色素瘤的1.3%,其中55% 在头颈部区域(包括鼻腔鼻窦及口腔)[3]。尽管SNMM是最常见的头颈部MM,但它仅占所有黑色素瘤约1%,在所有鼻腔鼻窦肿瘤占比不到5% [3]。年龄分布广泛(13~93岁)[4],好发年龄50~80岁,中位年龄为70岁, 比皮肤黑色素瘤(cutaneous melanoma,CM) (平均55岁) 年龄偏大。据报道[5-7],SNMM的发生与环境因素和先天免疫因素之间存在联系,非洲或日本血统、烟草和甲醛暴露以及先前存在的鼻窦黑变病被认为是可能的危险因素。与CM不同SNMM与紫外线照射无关,而与非角化性湿黏膜的黏膜痣相关[1],并通过遗传及分子的累积效应改变而发生恶变。SNMM临床无特异表现,常见为鼻衄、鼻塞、嗅觉减退或缺失以及面部疼痛或头痛等,晚期可伴有复视、眼球突出,或由于侵犯眼眶和颅骨而引起相应的其他神经症状。70%部位在鼻腔的鼻甲、鼻侧壁和鼻中隔,其次是上颌窦和筛窦。鼻内窥镜检查或前鼻镜检查多呈黑蓝色或棕色的斑点、溃疡或息肉样肿块;在无色素性情况下,为淡黄色或半透明样[8-9]。CT通常表现为增强的软组织肿块影与邻近的骨性破坏,MRI特征取决于病变的黑色素含量以及自由基、金属离子和高铁血红蛋白,含有色素者T1为高信号,无色素者通常显示低至中T1信号和高T2信号[10]。
SNMM组织病理学形态多样可模仿其他多种恶性肿瘤,诊断具有挑战性,可分成原位型、侵袭型和混合型三种亚型。侵袭型主要为上皮样细胞,也可有纺锤形、横纹肌样、浆细胞样、多边形、未分化、小细胞样或其他形态,细胞中等大小,核仁显著,较高的核分裂及增值指数,坏死及溃疡常见,呈实性、血管外皮瘤样、车辅状、腺泡状、假乳头状,伴佩吉特样播散及间质浸润[1]。目前针对原发SNMM的原位黑色素瘤(melanoma in situ,MIS)的诊断标准尚未明确,通常表现为单个或痣巢状异型的黑色素细胞在上皮内增殖,表面上皮可完整伴或不伴佩吉特样播散。30%~70% 病例无色素[3],当缺少典型特征与其他肿瘤鉴别困难时要加做免疫组织化学标记物。SNMM免疫组织化学染色可表达S-100、SOX-10、HMB-45、Melan-A(MART-1)、MiTF,酪氨酸酶、vimentin,还可以表达上皮细胞标志物 (包括CK和EMA)、肌源性标志物 (desmin),神经内分泌标志物和神经丝蛋白、脂肪酸合酶、CD63 、CD68/KP1以及会出现p16的缺失(74%)。
在基因组水平上MM与CM显著不同。通常MM肿瘤突变负荷(tumor mutational burded,TMB)相对较低, MM基因组不稳定性高,如C-KIT、SF3B1及SPRED1等在MM驱动基因突变中较高,而在CM中突变率较低,只有28%的MM具有MAPK途径激活突变(包括BRAF、NRAS、NF1),野生型占比为51%~72%;与CM相反,在MM中BRAFV600E突变仅有6%,而CM可达50%以上[11]。SNMM存在多种基因突变,包括但不限于NRAS、BRAF、C-KIT、TERT、PTEN、SPRED1、SF3B1、TP53、ATRX、HLA-A、CHD8和p16/INK4a的丢失以及染色体结构变异等。SPRED1是MM中重要的抑癌基因(鼻腔黏膜约占6%)[12],SPRED1的突变状态对于存在C-KIT突变患者C-KIT抑制剂的临床疗效具有重要评估及预测作用[11]。CDKN2A又称细胞周期蛋白依赖性激酶抑制剂2A, CDKN2B是CDKN2A同源基因,两者生物学功能相同。研究[13-14]显示,CDKN2A缺失可促进CDK4/6及下游转录因子E2F1激活,并刺激黑色素瘤促转移基因BRN2的表达上调,最终导致肿瘤转移的发生,CDKN2A缺失可能参与黑色素瘤早期侵袭和转移。本例SNMM诊断明确,NGS检测到伴有CDKN2A和CDKN2B 纯合缺失,未检测其他基因异常,提示该患者发展为侵袭及转移的机会大。
SNMM患者的分期和预后评估首先应进行系统完善的皮肤和眼科检查,以及CT和脑MRI排除其他部位的黑色素瘤转移。目前,美国癌症联合委员会(The American Joint Committee on Cancer,AJCC)第八版提出鼻腔和鼻窦癌(carTNM)和头颈部MM(mmTNM)两种不同的分期系统,mmTNM初始即为T3。故SNMM通常诊断时即为晚期,预后不良,血行转移率高于淋巴道转移。显微外科术或开放手术切除加是SNMM的主要治疗方法,切缘阳性、神经及脉管侵犯与不良预后相关,选择性淋巴结清扫的作用尚存争议,在术中增加化疗或免疫治疗可能会提高患者的生存率[3]。随着针对MM突变基因的不断研究,各种靶向及免疫治疗药物如帕博利珠单抗、曲美替尼、易普利姆玛、维罗非尼、伊马替尼、阿昔替尼为携带各种突变的MM等提供治疗机会。
鉴别诊断 由于SNMM组织学形态多样,需要借助免疫组化主要与以下疾病进行鉴别:未分化型非角化癌、低分化腺癌、非霍奇金淋巴瘤、嗅母细胞瘤、小细胞癌、未分化癌、 NUT、横纹肌肉瘤、尤文肉瘤、纤维肌源性、神经源性、成骨源性肉瘤以及肉瘤样癌等[1]。
综上,原发性SNMM是一种罕见高侵袭性肿瘤,具有高转移潜力和不良预后,目前尚无满意的治疗标准,手术、放化疗收效甚微且易复发。由于基因组方面突变负荷低,染色体结构变异以及拷贝数改变导致基因组不稳定性高,同时驱动基因的突变图谱也存在独有的特点,联合靶向及免疫治疗可能会提高疗效。
参考文献
[1]方三高,魏建国,陈真伟,等.黏膜黑色素瘤临床病理新进展[J].诊断病理学,2022,29(5):439-442.
[2] SPENCER K R, MEHNERT J M. Mucosal Melanoma: Epidemiology, Biology and Treatment[J]. Cancer Treat Res, 2016, 167:295-320.
[3]Behzad Salari,Ruth K. Foreman,Kevin S. Emerick,et al.Sinonasal Mucosal Melanoma: An Update and Review of the Literature[J].AmJ Dermatopathol ,2022,44(6):424-432.
[4]Thompson LD, Wieneke JA, Miettinen M. Sinonasal tract and nasopharyngeal melanomas: a clinicopathologic study of 115 cases with a proposed staging system. Am J Surg Pathol. 2003;27(5):594–611.
[5] Lourenço SV, Fernandes JD, Hsieh R, et al. Head and neck mucosal melanoma: a review[J]. Am J Dermatopathol, 2014;36:578–587.
[6] Spencer KR, Mehnert JM. Mucosal melanoma: Epidemiology, biology and treatment[J]. Cancer Treat Res,2016;167:295–320.
[7] Salari B, Duncan LM, Lennerz JK, et al. Observed progression from melanosis with melanocyte hyperplasia to sinonasal melanoma with distant metastasis and a unique genetic rearrangement[J]. J Cutan Pathol, 2021;48:948–953.
[8] Dréno M, Georges M, Espitalier F, et al. Sinonasal mucosal melanoma: a 44-case study and literature analysis[J]. Eur Ann Otorhinolaryngol Head Neck Dis. 2017;134:237–242.
[9] Alves IS, Berriel LG, Alves RT, et al. Sinonasal melanoma: a case report and literature review[J]. Case Rep Oncol Med. 2017;2017:8201301.
[10]Oren N,Vaysberg A,Ginat DT.Updated WHO nomenclature of head and neck lesions and associated imaging findings[J].2019,10(1):72.
[11]唐黎瑞,代杰,毛丽丽,等.黏膜黑色素瘤基因组学研究进展[J].肿瘤综合治疗电子杂志,2022,8(1):22-28.
[12]NEWELL F, KONG Y, WILMOTT J S, et al. Whole-genome landscape of mucosal melanoma reveals diverse drivers and therapeutic targets[J]. Nat Commun, 2019, 10(1):3163.
[13] Zeng, H, Jorapur, A, Shain, AH, et al. Bi-allelic loss of CDKN2A initiates melanoma invasion via BRN2 activation[J]. Cancer Cell, 2018,Cancer Cell, 34, p56-68.e9.
[14] Shain, AH, Joseph, NM, Yu, R, et al. Genomic and Tranomic Analysis Reveals Incremental Disruption of Key Signaling Pathways during Melanoma Evolution[J]. Cancer Cell,2018, 34, p45–55.e4.














共0条评论