[导读] 译者:陈旭
(2)增生型天疱疮
增生型天疱疮是一种罕见的PV临床变体,其特征是糜烂和植物状斑块,好发于间擦部位、头皮和口腔粘膜。传统上,已经认识到表型和临床病程不同的两种临床亚型。在Hallopeau型中,最初的病变是脓疱,随后演变成乳头状斑块。另一方面,Neumann型的早期病变更广泛且呈水泡状,类似于PV(图6)。它们破裂并逐渐转变为真菌样斑块。然而,这两种亚型之间的区别并不总是明确的。
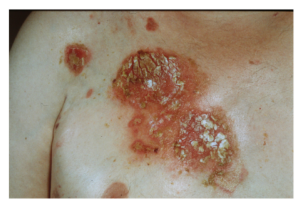
图6.早期增生型天疱疮。胸部覆盖着黄色硬壳的红斑基底上有腐蚀的渗出斑块。
早期增生型天疱疮皮损的组织病理学,因亚型而异。Hallopeau型脓疱性病变的特征,是嗜酸性海绵体水肿和微脓肿,而Neumann型的初始病变,表现为基底上层棘层松解和上皮内水肿。两种亚型的病变,均表现为角化过度、增生和乳头状瘤病形式的明显上皮改变。上皮下和上皮中,可见大量嗜酸性粒细胞浸润,特别是基底上层(图7A)。基底上层棘层松解是典型形态表现,然而,它可能被显著的炎症和上皮变化所掩盖,因此只能在局部辨别(图7B)。免疫病理学检查结果,与PV相似。在大多数增生型天疱疮病例中,可见抗桥粒芯糖蛋白3抗体。
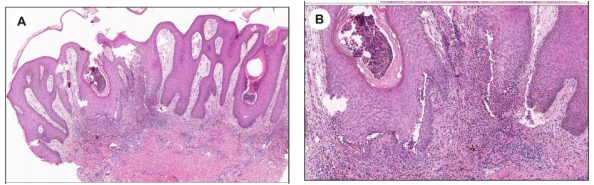
图7.增生型天疱疮。A(x40)和B(x100)。假性上皮瘤样增生伴表皮内中性粒细胞微脓肿、基底上层棘层松解和伴有许多嗜酸性粒细胞的混合性真皮炎症。直接免疫荧光研究证明了IgG和C3(未显示)的强烈表皮细胞表面沉积。
(3)非自身免疫模拟物
Hailey-Hailey、Darier和Grover病,是没有自身免疫病因的棘层松解性皮肤病,在组织病理学上属于天疱疮的鉴别诊断。它们的共同点,是在免疫荧光结果阴性的情况下,存在棘层松解,并伴有不同程度的角化不良。最近的一项研究描述了5例Grover病,合并大疱性类天疱疮(BP)。Grover病导致的BMZ损伤,可能触发自身抗体的形成,从而导致BP的发生。
②表层上皮内分离的免疫大疱性疾病
(1)落叶型天疱疮(PF)
临床上,PF的特征是浅表水泡和松弛性大疱,它们很脆弱,在破裂时会发展成结痂和鳞状糜烂和斑块(图8A-C)。面部和上躯干受累,是脂溢性分布的典型表现。皮损也可发展为红皮病。事实上,在自身免疫性大疱性皮肤病中,PF最常见于红皮病。通常不存在黏膜受累。
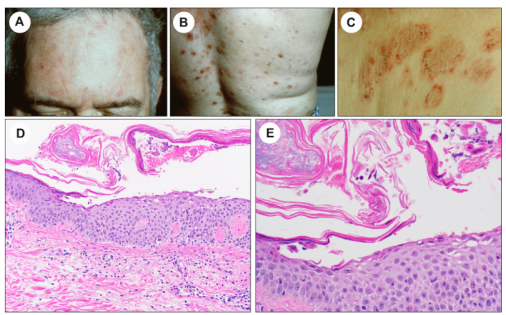
图8.落叶天疱疮。(A)额头上有边界不清的浅棕色斑疹和斑块,有轻度鳞屑。(B)下背部伴有炎症后色素沉着过度的红斑性丘疹。(C)周围结垢的环状斑块。落叶型天疱疮有时类似于丘疹鳞屑病,如牛皮癣。D(x100)和E (x200)。表面分离,大部分表皮保持完整。偶见炎症细胞在角膜层的分离碎片中注意到红细胞。
PF的经典显微镜下特点,是表皮内颗粒层或角膜层的裂解(图8D和E)。在 一项队列研究中,在大约三分之一的PF病例中,观察到一种独特的组织病理学模式,包括具有扁平形状的棘层松解细胞和伴有增厚颗粒层的透明角质颗粒增加。并被作者称为棘层松解性颗粒过多症。在上述研究中,一半以上的PF病例,存在具有深染细胞核和嗜酸性细胞质的角化不良细胞,角化不良程度是PF和PV的区别特征之一 。更明确的PF病变,可能与表皮改变有关,例如表皮增生和角化不全。术语“银屑病样PF ”,用于PF的独特临床病理表型,具有明显的银屑病样表皮增生和局灶性棘层松解。
在DIF上,IgG和C3的网状细胞间染色是典型表型。IgG沉积的频率和强度,通常大于C3沉积,可能是因为天疱疮是由IgG4自身抗体介导的,而IgG4自身抗体不一定能固定补体。荧光模式可能仅限于表皮。
(2)红斑天疱疮和疱疹样天疱疮
一些作者认为红斑天疱疮的免疫荧光表现,是PF和红斑狼疮(LE)免疫荧光特征的组合,而其他学者认为,它是局限于面部中央区域和其他脂溢区域的PF形式。红斑天疱疮的组织病理学特征,实际上与PF的组织病理学特征无法区分。在前者中,可能很少观察到BMZ的界面变化。在DIF上,红斑天疱疮的特征是,BMZ处细胞间IgG、C3沉积以及颗粒状免疫反应物沉积的混合模式。
疱疹样天疱疮,是另一种值得注意的天疱疮变体,它融合了疱疹样皮炎(DH)的临床特征和天疱疮的免疫病理学发现。其免疫学特征更常见于PF,具有抗桥粒芯糖蛋白1抗体。皮肤病学检查显示强烈瘙痒、荨麻疹或环状斑块伴有水泡和糜烂,成组排列位于躯干和四肢近端。在大多数情况下,存在表皮内嗜酸性粒细胞浸润伴海绵化,可能与中性粒细胞混合。标志性的显微发现之一,是表皮内囊泡或脓疱形成,通常位于角膜下或棘突内。然而,棘层松解通常不存在或很少,这可能是由于疱疹样天疱疮中的自身抗体,与 PF的潜在病例相比具有降低的致病活性。
(3)地方性天疱疮
地方性天疱疮,之前被称为fogo selvagem(FS;葡萄牙语中的“野火”)。FS发生在南美洲的某些地区,尤其是巴西中西部。在具有遗传易感性(可能是某些人类白细胞抗原等位基因)的个体中,与当地生态学相关的环境因素(例如,模拟属的黑蝇),似乎会引发免疫反应。值得注意的是,有一种来自哥伦比亚的地方性PF的独特变体,称为El Bagre地方性PF,与免疫性肾损伤有关。地方性和散发性PF,具有相同的组织病理学和免疫病理学表现 。
(4)非自身免疫模拟物
PF鉴别诊断的主要疾病,是大疱性脓疱病和葡萄球菌性烫伤样皮肤综合征(SSSS),两者都是由金黄色葡萄球菌产生的剥脱性毒素A和B引起的脓皮病。组织病理学上,大疱性脓疱疮、SSSS和PF ,在表皮颗粒层表现出分离,并伴有棘层松解细胞。明确的诊断,需要对临床因素,以及模棱两可的病例中的DIF和ELISA进行评估。
Ⅲ、具有荨麻疹表现的免疫性大疱性疾病
①非大疱性类天疱疮
非大疱性类天疱疮,具有不同的临床表现,其特征为红斑、斑块或结节、湿疹性皮损,或罕见的红皮病。多项研究发现,荨麻疹病变是非大疱性类天疱疮最常见的表现。瘙痒是大多数非大疱性类天疱疮的共同特征。此外,没有原发性皮肤损伤的剧烈瘙痒,是一部分患者的唯一主诉,在这些患者中,免疫病理学结果与BP一致。由于皮肤表现的非特异性,延迟数月至数年的诊断并不少见。最近的研究指出,只有一小部分患者,在随访期间出现水泡 。因此,一些学者建议使用术语“非大疱性类天疱疮”。
非大疱性类天疱疮的组织病理学无特异性,几乎没有提示诊断的线索。炎症浸润的重要细胞组成,是嗜酸性粒细胞,既存在于海绵化的表皮中,也存在于具有血管周围和间质分布的真皮中。嗜酸性粒细胞也可能沿着BMZ排列。其他研究发现,乳头状真皮水肿和可变的淋巴细胞和中性粒细胞真皮浸润 。非大疱性类天疱疮和BP,具有相同的免疫病理学特征。非大疱性类天疱疮中的抗体,主要是IgG4。值得注意的是,BMZ处的线性C5-9沉积,可能是非大疱性类天疱疮的早期发现。
Ⅳ、伴有中性粒细胞性乳头炎的免疫性大疱性疾病
中性粒细胞性乳头炎,以真皮乳头的中性粒细胞浸润为特征,通常存在于DH和LABD中;然而,在BP、大疱性SLE或炎性EBA中,也可能观察到类似的浸润现象。
①疱疹样皮炎(DH)
疱疹样皮炎(DH),是一种麸质敏感性的自身免疫性皮肤病,目前被认为是乳糜泻的一种皮肤表现。然而,肠道症状仅存在于一部分患者中。临床上,DH的特征,是强烈瘙痒的丘疹水疱成群分布且对称分布,好发于肘部、膝部、前臂和臀部(图9A-C)。在不能再确定原发病灶的情况下,分布模式是诊断的重要线索。局部表现,如掌跖角化病,不太常见。DH的一个独特表现是掌跖紫癜, 特别是发生在儿童中,也可见口腔黏膜受累(图9D)。
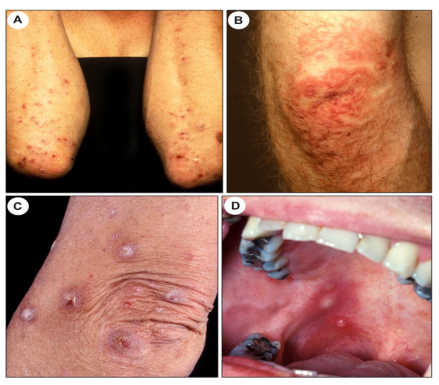
图9。疱疹样皮炎。(A)累及上肢伸肌表面的侵蚀性丘疹和丘疱疹。(B)多环结构的红斑,肘部中央透明。(C)肘部角化过度、脱落的丘疹。(D)口腔粘膜上的完整水泡。
光学显微镜下,在早期DH病变的真皮乳头中,可检测到具有可变嗜酸性粒细胞和纤维蛋白组合的中性粒细胞微脓肿。可见完整的表皮下囊泡形成,其中中性粒细胞占优势(图10A)。然而,很大一部分DH,都与这种经典描述背道而驰。文献中报道的一些非特异性发现,包括血管周围淋巴细胞浸润、真皮乳头状纤维化和火焰样改变。经典的DIF发现,是颗粒状IgA沉积,伴有真皮乳头的点彩和突出样该变(图10B)。沉积在距离活动性病变约1厘米的未受累“周围”皮肤中,最为突出。DIF结果显示,颗粒状和纤维状IgA沉积物,可能同时或在不同时间点在同一患者身上观察到。高达10%的DH病例,出现假阴性DIF结果,而组织病理学检查,在多达三分之一的患者中可能是非特异性的 。因此,专家推荐,由抗组织转谷氨酰胺酶组成的血清组或抗肌内膜抗体,应纳入诊断标准。正在进行的关于表皮转谷氨酰胺酶抗体血清学检测,作为筛选工具,显示出潜在应用价值。
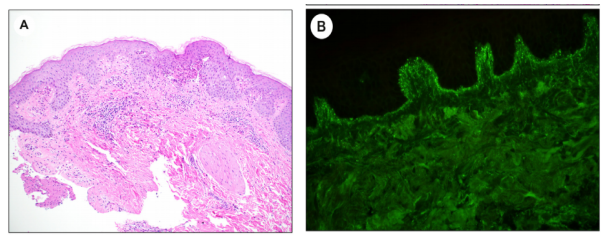
图10.疱疹样皮炎。(A)真皮乳头尖端的中性粒细胞微脓肿,伴有混合性血管周围浸润(x100)。(B)颗粒状IgA沉积在直接免疫荧光检查中在真皮乳头处加重。
②线性IgA大疱性皮肤病(LABD)
线性IgA大疱性皮肤病,是一种临床异质性疾病,可见沿BMZ的线性IgA沉积。基于抗体谱和免疫电子显微镜,现已鉴定出两种不同的LABD亚型,即更常见的透明层类型和不太常见的致密层下层类型。前者患者的血清,具有与97-kDa或120-kDa裂解的BP180细胞外多肽反应的自身抗体,而针对VII型胶原蛋白的自身抗体,与后者有关。LABD影响儿童和成人,具有双峰发病年龄分布。临床上,LABD具有类似于DH、BP或 EB的多种表现(图11A和B)。在环状红斑背景上,具有多环结构的紧张性水疱,类似于“珍珠串”,通常与LABD相关;然而,这种形态只存在于一小部分病例中。LABD的不常见表现,包括荨麻疹斑块和类似于离心环状红斑的病变。万古霉素,是药物诱导的LABD最常见的罪魁祸首。有趣的是,有两例LABD表现类似于麻疹样药疹,没有水泡,与万古霉素有关。除了麻疹样表现外,药物诱发的LABD ,也可能类似于中毒性表皮坏死松解症。IBD,特别是溃疡性结肠炎和LABD之间的关联已被报道。

图11.线性IgA大疱性皮肤病,有色皮肤表现不典型。A和B.小而完整的大疱,在口周位置正常外观的皮肤上出现透明液体。C(x100)、D(x200)和E(x200)。表皮下分离伴中性粒细胞炎症。F.直接免疫荧光检查基底膜区的线性IgA模式,与线性IgA大疱性皮肤病一致。
与DH中的中性粒细胞性乳头炎相比,LABD中的中性粒细胞性乳头炎,可能具有更分散的分布,并且可能延伸形成具有中性粒细胞的上皮下水疱(图11C-E)。嗜酸性粒细胞在药物诱导的成人LABD病例中,可能尤为突出,这对BP的鉴别诊断,提出了挑战。2019年发表的一项研究,发现一半以上患者可见嗜酸性粒细胞弥漫分布。可以观察到火焰样改变。IgA在DIF上的线性BMZ沉积,是LABD的特征(图11F)。循环IgA抗体可以在大约2/3的LABD患者中,通过使用IgA结合物的IIF检查到;与成人相比,儿童的检出率更高。
Ⅴ、具有角膜内或表皮内中性粒细胞的免疫大疱性疾病
①IgA天疱疮
IgA天疱疮,是一种免疫大疱性疾病,其特征是上皮细胞内存在细胞间IgA免疫反应。根据临床病理学表现,该病可分为两类,即角膜下脓疱性皮肤病(SPD)型和表皮内中性粒细胞(IEN)型。前者主要与识别桥粒芯蛋白1 的自身抗体相关,而后者的抗体谱更为异质。IgA天疱疮的经典表现,是瘙痒性丘疹、松弛性水泡和脓疱的组合,在躯干和四肢近端呈环状分布。在组织病理学检查中,IgA天疱疮的显著特征,是存在角膜下或表皮内中性粒细胞性脓疱,其在上皮内的水平取决于具体类型。浸润在SPD型中位于角膜下,而在 IEN型中,浸润位于上皮中较低位置。
值得注意的是,IgG/IgA天疱疮是一种难以分类的异质性疾病。临床病理学研究表明,IgG/IgA天疱疮在病变分布和形态以及棘层松解的方面,与IgA天疱疮有很大不同。然而,IgG/IgA天疱疮和IgG天疱疮没有显著差异,这表明IgG/IgA天疱疮,可能代表IgG天疱疮,而非IgA天疱疮的变体。最近的一项研究,描述了27%患者,伴发恶性肿瘤 。
Ⅵ、副肿瘤性天疱疮(PNP)
副肿瘤性天疱疮(PNP),是与潜在肿瘤相关的异质性自身免疫综合征的皮肤黏膜表现,尤其是在非霍奇金淋巴瘤和Castleman 病中。发病机制复杂,涉及细胞介导免疫和体液免疫,自身抗体靶向多种蛋白质,例如桥粒芯糖蛋白1和3、BP180和BP230 、桥粒芯蛋白、periplakin和envoplakin等。弥漫性和进行性口腔炎,是 PNP的典型特征,通常是就诊的初始征兆(图12A)。皮肤表型变化很大,可能类似于多形性红斑、PV、BP、移植物抗宿主病或LP。肢端受累是PNP的特征。广泛性糜烂性口炎,并延伸至朱唇并伴有掌跖病变的情况下,PNP的诊断, 优于PV(图12B)。除了皮肤粘膜表现外,PNP的特征还包括可能致命的呼吸道受累,表现为闭塞性细支气管炎。一些研究还描述了该病与肾脏和神经系统受累的关联。副肿瘤性自身免疫性多器官综合征,已被提议作为一个术语来涵盖该疾病的多系统性质 。尽管在诊断和治疗方面取得了进步,但PNP的死亡率仍然很高,高达90% 。
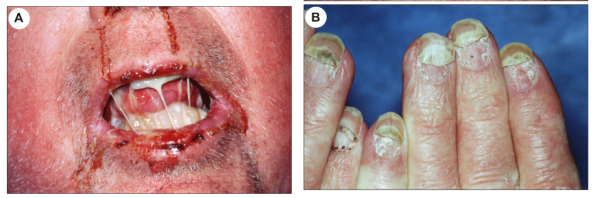
图12.副肿瘤性天疱疮(A)弥漫口腔炎伴有嘴唇和舌头上的疼痛性糜烂。(B)指甲受累。
基底上层棘层松解和界面皮炎的组合,被认为是PNP的典型特征(图13A和B);然而,这种组合并不是在所有情况下都能见到,即使在对多个部分进行评估之后,也是如此(图13A和B)。在一些病例中,可发现全层上皮坏死。在DIF检测中,大多数病例显示IgG、C3的细胞间沉积,而BMZ处的线状或颗粒状免疫沉积较少见。线性和细胞间免疫荧光的结合,高度提示PNP。然而,这种混合模式,仅出现在四分之一的病例中。一些研究还描述了类似于LP的DIF模式,具有细胞样体和沿着BMZ的毛茸茸的纤维蛋白原沉积。病变上皮细胞表达plakins,但不表达桥粒芯糖蛋白1和3,因此被认为是PNP的高度特异性IIF底物。
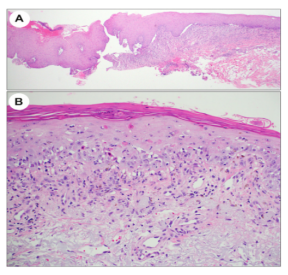
图13.副肿瘤性天疱疮。A.伴有基底上裂的多个病灶的苔藓样炎症(x40)。B.角化不良角质形成细胞、液泡变化和色素失禁的界面反应模式(x200)。
总结
尽管在免疫大疱性疾病的诊断方面取得了进展,但光学显微镜结合细致的身体检查,以及免疫检测结果的整合,仍然是检查的基础。识别上皮内或上皮下分裂的水平,和炎症浸润的组成,可以帮助病理学家对疾病过程进行分类,与其它疾病鉴别,从而适当地指导临床医生进行潜在的鉴别诊断、进一步检查和合适的临床管理。
往期回顾:
自身免疫性大疱性皮肤病的组织病理学特点(一)





















共0条评论