[导读] 译者:陈旭
导读
自身免疫大疱性皮肤病的定义,是针对表皮或基底膜区粘附蛋白的自身抗体,导致皮肤和黏膜上形成水泡。诊断依赖于病灶活检的组织病理学,以及病灶周围活检组织的直接免疫荧光结果。2022年6月22日,梅奥医学中心Julia S.Lehman博士为通讯作者,在病理学知名期刊《Human Pathology》(IF值为3.526分)上发表题为“Histopathology of autoimmune bullous dermatoses: what’s new?”的综述性文章,详尽阐述了自身免疫性大疱性皮肤病的组织病理学特点。下面笔者将该综述全文编译如下,供相关医师参考。

摘要
自身免疫大疱性皮肤病的特征,是患者体内存在与组织结合,且可进入血液循环的致病性自身抗体,这些抗体靶向破坏皮肤、黏膜结构,从而造成皮肤、黏膜损伤。自身免疫大疱性皮肤病的诊断检查,包括多步骤过程,其中光学显微镜检查,是关键检查之一。本综述是根据主要组织病理学特征的分类方案,即上皮内组织分离水平,以及炎症浸润的细胞组成。总的来说,该综述的目标,是帮助病理学家总结该组疾病诊断的组织病理学要点。
简介
自身免疫大疱性皮肤病(AIBD),是一种广泛的皮肤疾病类别,具有多种临床和免疫病理学特点。这些疾病的共同点,是存在针对皮肤、粘膜结构成分(如桥粒或半桥粒),且存在体液循环的致病性自身抗体。棘层松解,是免疫大疱性疾病中上皮内组织分离的机制,是指细胞间连接的破坏。上皮下水疱,是在基底膜区(BMZ),免疫介导的细胞内分离。
免疫大疱性疾病的诊断检查,包括多个步骤,包括皮肤病学检查、组织学、直接和间接免疫荧光显微镜检查,以及使用酶联免疫吸附测定(ELISA)或蛋白质印迹法对特定循环自身抗体进行血清学检测。建议对早期、未侵蚀或未溃疡的病变进行活检,以便上皮再生或继发性变化,不会影响免疫病理学检查结果。进行直接免疫荧光(DIF)检查时,应取材未溃疡、未起泡的发炎皮肤。常规光学显微镜检查,结合全身检查和免疫检测结果,仍然是免疫大疱性疾病检查的基本步骤,并用于指导进一步治疗。
在处理疑似免疫大疱病病例时,需要考虑几个注意事项。首先,一些患者在初次就诊时,可能不会出现水疱或大疱。其次,愈合病变中的上皮再生,可能影响组织层次。DIF检查有一定的局限性,也需要加以考虑。一项研究发现,在没有皮肤病或光敏性的成年人的日光暴露皮肤中,存在非特异性免疫反应物沉积,这表明在从日光暴露的身体区域取材的皮肤,出现DIF阳性结果时,要避免过度诊断。此外,来自发炎皮肤的活检标本,可能与假阴性结果有关,这可能是由于免疫沉积物的降解造成的。来自下肢的皮肤组织,也有可能与错误结果相关。考虑到这些注意事项,为本次文献更新选择的分类方案,基于两个对免疫大疱性疾病分类至关重要的光学显微镜特征,即组织分离水平和炎症浸润的细胞组成(表1)。
表 1.本综述中使用的分类方案概要
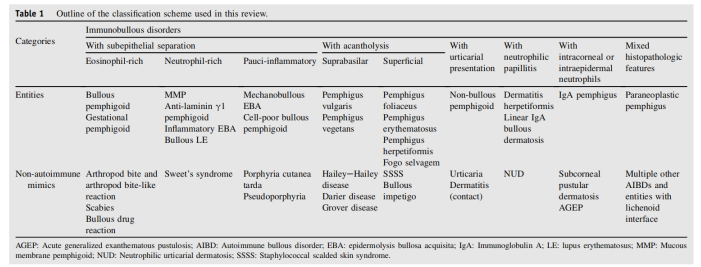
Ⅰ 伴上皮下分离的免疫大疱性疾病
根据炎症浸润的细胞成分,上皮下免疫大疱性疾病可分为三个不同的亚组:(1)嗜酸性粒细胞增多型,(2)嗜中性粒细胞增多型, (3)少炎症细胞型。在上皮下免疫大疱性疾病的DIF检查中,可以观察到沿BMZ呈线性模式的免疫沉积物,C3沉积的强度较IgG高。与获得性大疱性表皮松解症(EBA)和大疱性系统性红斑狼疮(SLE)相比,具有强度更高的C3沉积,更常见于大疱性类天疱疮(BP)、粘膜类天疱疮(MMP)和妊娠类类天疱疮(系统性红斑狼疮)。免疫反应物的线性沉积模式的分析,已被一些专家提议,作为附加诊断技术。具体而言,在EBA和大疱性SLE中,常见u型锯齿状沉积,其特征是尖峰或指状结构在沿BMZ的线性沉积内伸入上皮细胞。其他上皮下免疫大疱性疾病,呈n型锯齿状沉积。总体而言,锯齿状模式分析,已被证明对EBA的诊断高度敏感,尽管由于各种潜在原因,这种辅助技术尚未被广泛采用。
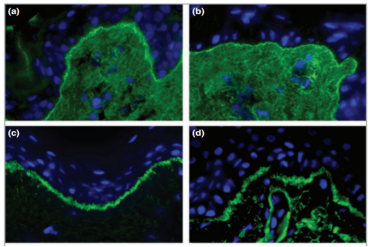
图.(a和b)n型锯齿状沉积;(c和d)u型锯齿状沉积。图片源自于DOI 10.1111/bjd.12308
另一种可以使用的诊断方法,是应用盐裂皮肤间接免疫荧光(IIF-SSS),检测抗基底膜带抗体。用1 MNaCl孵育正常人皮肤基质,会导致BMZ透明层亚区下部发生裂解,BMZ是一种由不同亚区组成的层状结构(图1)。在间接荧光(IIF)显微镜下,免疫沉积物定位于EBA患者SSS的真皮侧,而它们通常定位于BP患者的表皮侧。在患有罕见类天疱疮亚型(包括p200、p105或层粘连蛋白332类天疱疮)的患者中,可能会观察到混合模式。IV型胶原蛋白免疫组织化学染色,已成为上皮下免疫大疱性疾病鉴别诊断的另一种潜在辅助手段。在BP病例中,通常在大疱底部,观察到IV型胶原蛋白免疫反应性,而在EBA和大疱性SLE病例中,IV型胶原蛋白定位于水疱顶部。这种差异,归因于BMZ内IV型胶原蛋白的定位(图1)。
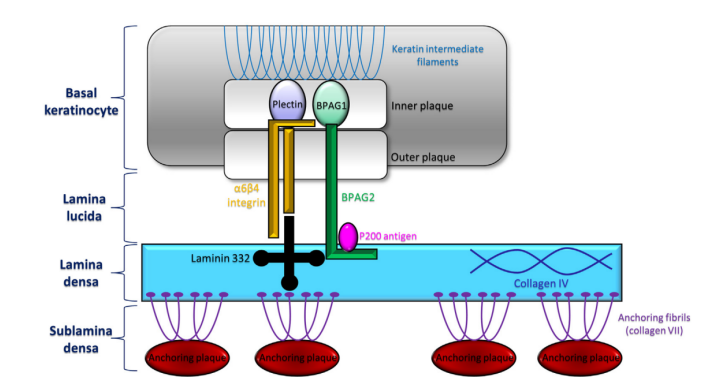
图1.基底膜区的示意图。与免疫大疱性疾病相关的靶抗原描绘在大致的解剖位置。BPAG1:大疱性类天疱疮抗原1;BPAG2:大疱性类天疱疮抗原2。层粘连蛋白332也称为epiligrin或层粘连蛋白5。
①富含嗜酸性粒细胞的上皮下免疫大疱性疾病
(1)大疱性类天疱疮(BP)及其变体
BP是最常见的AIBD,年发病率高达百万分之23。它通常影响老年人,然而,很少累及儿童 。值得注意的是,有许多研究表明,BP与神经系统疾病(例如帕金森病和脑血管疾病)以及精神疾病(例如精神分裂症和双相情感障碍)之间存在关联。发病机制尚不完全清楚,尽管可能涉及交叉反应性免疫反应。药物诱发的BP,在文献中也有大量报道,超过50种独特的药物与BP的出现有关。它的发病率正在上升,可能是由于免疫检查点抑制剂和二肽基肽酶IV抑制剂等药物的使用增加所致(图2)。在BP中,存在对两种自身抗原的联合细胞和体液反应,即BPAG1的上皮亚型,也称为BP抗原230或BP230,以及BPAG2,也称为BP抗原180或BP180(图1)。
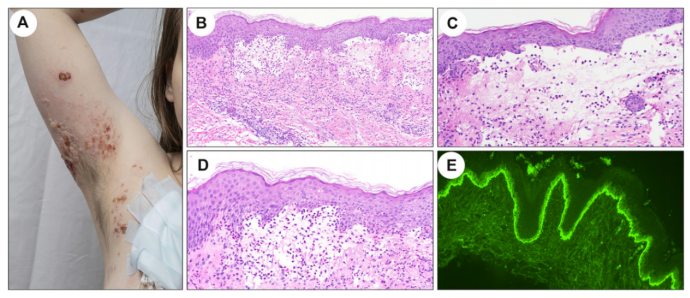
图2.药物引起的大疱性类天疱疮。A.临床照片显示一名年轻女性的非荨麻疹皮肤出现广泛的大疱性病变。B (HEx100),C(HEx200),D(HEx200)。表皮下大疱伴有大量嗜酸性粒细胞。E.在直接免疫荧光检查中,在基底膜区域呈线性模式的显着阳性C3沉积。
临床上,大疱之前,会出现持续数周或数月的湿疹或荨麻疹性病变。具有相对非特异性皮肤表现的顽固性瘙痒,是一种前兆表现。值得注意的是,多达五分之一的患者在诊断时没有起泡。BP的大疱期特征是,正常或红斑皮肤上出现紧张、剧烈瘙痒的大疱,并伴有湿疹或荨麻疹斑块(图2A)。通常不存在疤痕,这对于区分BP、MMP和EBA,至关重要。
目前已发现了BP的几种临床变体,包括可能定位于某些解剖部位的变体,例如肢端或外阴区域 。出汗性BP,表现为肢端皮肤上的瘙痒性水疱和大疱,可能是出血性或紫癜性的,与出汗性湿疹相似。结节性类天疱疮是一种公认的变体,其中结节性痒疹的临床特征,与BP的临床特征重叠。增殖性天疱疮是一种罕见实体,已知与炎症性肠病 (IBD) 相关,表现为间擦区的植物性或乳头状斑块,伴脓疱形成。天疱疮扁平苔藓,结合了BP和扁平苔藓的特点。水泡可以在先前存在的苔藓样病变,或未受累的皮肤内形成,而在大疱性扁平苔藓的情况下,它们仅出现在先前存在的扁平苔藓病变内。
BP的组织病理学特点,取决于病变在其演变过程中所处的阶段。早期病变的特点是血管周围浸润嗜酸性粒细胞和嗜酸性海绵状基质。从具有红斑基底获得的活组织检查显示,上皮下水疱在真皮上部和水疱腔中,具有富含嗜酸性粒细胞的浸润(图2B-D)。天疱疮扁平苔藓,往往表现为由淋巴细胞和嗜酸性粒细胞组成的多形性浸润,基底层偶尔有Civatte小体形成。
DIF检查在大多数情况下,观察到IgG、C3沿BMZ呈线性和连续沉积(图2E)(表2)。有时,C3可能是BP患者的唯一免疫反应物,尤其是在早期阶段。 SSS-IIF检测中,循环抗BMZ自身抗体,通常在表皮侧发生反应,但是,偶尔可以看到表皮-真皮联合模式。BP180可以通过ELISA结合BP230的血清学检测,得出结果,BP患者中的敏感性为90%。
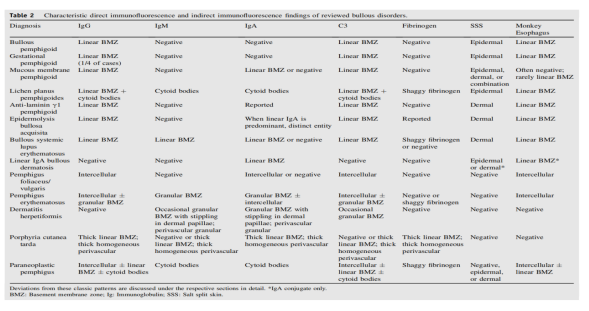
表 2.大疱性疾病的特征性直接免疫荧光和间接免疫荧光发现
(2)妊娠类天疱疮
妊娠性类天疱疮,也称为妊娠类天疱疮,在较早的文献中称为妊娠疱疹,是一种水泡大疱性皮疹,每 50,000至60,000例妊娠中约有1例受到影响。妊娠性类天疱疮中的致病性自身抗体,是具有针对BP180的补体结合活性的IgG1抗体,然而,一项针对10例病例的研究表明,IgG4占优势。
临床上,荨麻疹性丘疹和斑块最初出现在脐周区域。初始斑块随后在形态学上,与BP相似(图3A-C)。一些学者认为,妊娠性类天疱疮是BP的一种变体。与BP相比,妊娠性类天疱疮的典型组织学表型更为常见,例如明显的真皮乳头水肿、局灶性海绵化和坏死的基底角质形成细胞。妊娠期类天疱疮的DIF结果,与BP的不同之处在于,在前者中,C3的线性沉积存在于所有病例中,并且更可能是唯一的观察结果(图 3D)。然而,仅在大约四分之一的妊娠期类天疱疮患者中,检测到IgG的线性沉积。使用补体增强的 IIF 研究,几乎所有妊娠性类天疱疮病例,都存在循环抗BMZ抗体。抗BP180IgGELISA显示,对妊娠性类天疱疮的诊断,具有大于90%的敏感性和特异性,可用于监测疾病活动。
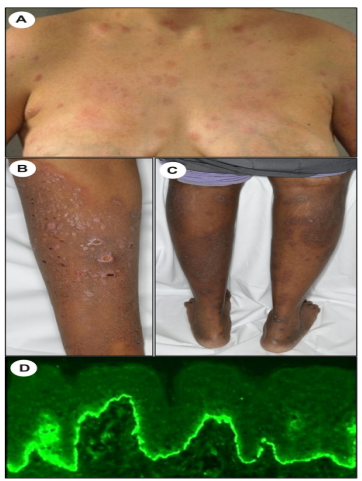
图3.妊娠类天疱疮。A.胸部出现荨麻疹样病变。B.四肢出现皮炎样病变,继发浅表溃疡。C.通过直接免疫荧光在基底膜区形成强连续线性C3模式。
(3)非自身免疫性显微模拟物
在组织学上,节肢动物咬伤,可表现为明显的乳头状真皮水肿和伴有嗜酸性粒细胞的水疱形成,因此与BP相似。血液系统恶性肿瘤,尤其是慢性淋巴细胞白血病(CLL),可能与节肢动物叮咬过度或昆虫叮咬样反应有关,但没有节肢动物叮咬史。
②富含中性粒细胞的上皮下免疫大疱性疾病
(1)黏膜类天疱疮(MMP)
MMP,在较早的文献中也称为瘢痕性类天疱疮,常见黏膜受累,具有慢性化和瘢痕形成的趋势。目前。已经发现了几种该病相关的自身抗原,例如α6β4整合素的β4亚基、BP180、BP230和层粘连蛋白332(以前称为epiligrin或层粘连蛋白5)。越来越多的证据表明,MMP与恶性肿瘤风险增加有关,尤其是上呼吸道及消化系统。
临床上,MMP可累及任何黏膜部位。结膜和口腔黏膜,是最常见的受累部位,后者在病程中近 90% 的病例中受累。大约四分之一到三分之一的患者存在皮肤受累,典型的病变是大疱和有疤痕倾向的红斑。据报道,儿童MMP存在局限于外阴的罕见病例。MMP的Brunsting-Perry变体的特征是,头部和颈部区域有疤痕病变,很少有黏膜受累。
MMP的组织病理学特点,取决于病变在其演变过程中所处的阶段。早期病变以中性粒细胞浸润为主,可有真皮乳头状中性粒细胞微脓肿。随着病变年龄的增长,炎症浸润变得更加混合和多变,嗜酸性粒细胞和淋巴细胞逐渐取代嗜中性粒细胞。在超过80%的病例中,DIF显微镜下可见IgG 、C3沿BMZ呈线性沉积。线性沉积还延伸到皮肤附件结构 。一项相对较新的研究表明,重复活检,可提高DIF诊断MMP的敏感性。
(2)抗层粘连蛋白γ1类天疱疮
抗层粘连蛋白γ1类天疱疮(以前称为抗p200类天疱疮),是一种具有独特特征的表皮下水疱病。有学者认为,由于重叠特征和诊断挑战,许多病例可能被误诊为BP或EBA。事实上,最近的一项研究发现,抗层粘连蛋白γ1类天疱疮是最常见的类天疱疮疾病,在SSS上具有真皮结合自身抗体。自身抗原是一种200 kDaBMZ蛋白,已被鉴定为层粘连蛋白的γ1链。它具有多形性临床表现,在大多数情况下,以糜烂、水疱和/或紧张性大疱以及红斑和荨麻疹斑块为特征。
抗层粘连蛋白γ1类天疱疮的组织病理学特征,是上皮下水疱形成,伴有中等至致密的真皮炎症浸润。炎症的性质与BP的不同之处,在于它在大多数情况下以中性粒细胞为主。DIF最常见的模式是IgG和C3的线性沉积,而IgG、C3和IgA的同时沉积在部分病例中得到证实。在SSS-IIF检测中,自身抗体通常标记在真皮侧。目前,市场上没有成熟的相关ELISA试剂盒。
(3)炎性大疱性表皮松解症(IEBA)
IEBA是一种罕见的非遗传性大疱性疾病,最常见于成人。它是由靶向胶原蛋白VII的非胶原结构域的自身抗体引起的,后者是锚定原纤维的主要成分。经典形式模仿遗传性大疱性表皮松解症类型,也称为机械性大疱性EBA。IEBA代表异质性类别,临床上与线性IgA大疱性皮肤病(LABD)、BP、MMP或大疱性SLE类似,其特征是上皮下水疱伴浅表真皮炎性浸润,通常以中性粒细胞为主,混有不同程度的嗜酸性粒细胞。可存在真皮乳头状嗜中性微脓肿。因此,光学显微镜检查结果,可能无法与BP或DH的检查结果区分开来。在DIF上,可见典型的IgG和C3的线性沉积。许多报道都描述了IgA介导的IEBA,更常见的是与炎性EBA样临床表现和粘膜瘢痕形成相关。由于临床和组织病理学的非特异性,IEBA的诊断具有挑战性。诊断标准由国际制定Bullous Diseases Group,强调IEBA的确诊需要常规组织病理学、DIF、IIF和其它辅助测试,例如胶原VII特异性抗体ELISA、IIF胶原VII抗体测试或电子显微镜评估。
(4)大疱性系统性红斑狼疮
原发性皮肤红斑狼疮中,明显的界面炎症,可导致SLE情况下的大疱性病变。然而,大疱性系统性红斑狼疮是一个术语,通常用于描述具有中性粒细胞真皮浸润的特定上皮下水疱病症,在大多数情况下,由针对VII型胶原蛋白的自身抗体介导。它通常出现在年轻女性身上,在红斑或正常皮肤上有紧张的水疱和/或大疱。值得注意的是,大疱性SLE ,是儿童和青少年SLE的初始表现。大疱性SLE可能与精神疾病和肾炎有关。
大疱性系统性红斑狼疮的特点,是上皮下脱离伴真皮上层嗜中性粒细胞浸润,有形成乳头状微脓肿的倾向。白细胞破碎是一种常见的表现,可以帮助区分大疱性SLE、DH或LABD 。在病灶周围DIF上,可见典型的IgG、C3、IgM和/或IgA沿BMZ的线性沉积。
③少炎性上皮下免疫大疱性疾病
(1)机械疱性大疱性表皮松解症
机械性大疱性EBA,也称为经典或非炎症性EBA,表现为在遭受重复性创伤的区域皮肤上,出现皮肤脆弱和大疱。病变愈合后会形成疤痕和粟粒疹。在光学显微镜下,机械大疱性EBA的特征是,非炎症性或微炎性上皮下大疱,腔底部有纤维蛋白沉积。确定的病变伴随粟粒形成和真皮瘢痕形成。免疫病理学的特征是IgG和C3呈线性沉积。
(2)非自身免疫模拟物
机械性大疱性EBA的主要非自身免疫性类似物是PCT和假卟啉症。PCT是尿卟啉原脱羧酶活性降低的结果。患者出现与皮肤脆弱相关的糜烂、水泡大疱性病变和色素沉着异常,这些病变位于手和前臂的背面。假卟啉症的临床表现与PCT非常相似;然而,患者的尿卟啉原脱羧酶活性正常。最常见于慢性肾病患者接受透析和/或接受光毒性药物治疗,例如非甾体类抗炎药(尤其是萘普生钠)、利尿剂(尤其是速尿)或抗生素。
PCT中起泡皮肤的组织病理学检查显示,非炎症性或少量炎症性表皮下分离,与保留和指状硬质真皮乳头向上突出到水泡腔相关,这被称为“花彩”。PAS阳性抗淀粉酶糖蛋白在血管壁上的沉积,被认为与PCT 的许多组织病理学发现有关,包括花彩和“基底膜/毛虫体”,它们被描述为覆盖水疱的表皮中的线性或分段嗜酸性结构。这些是PCT的相对具体特征,但并非在所有情况下都能观察到。在PCT和假卟啉症中,DIF检测可见IgG、IgM、C3和/或纤维蛋白原在基底膜区和上真皮血管周围的均匀沉积,具有重要意义,这是由于透明物质对免疫反应物的非特异性摄取造成的。血清IIF检测呈阴性。
与少炎性上皮下免疫大疱性疾病相鉴别的另一个重要疾病,是大疱性糖尿病,其特征是在长期糖尿病患者的非发炎肢端皮肤,突然和自发地出现紧张水泡。皮肤分离的部位,可能位于表皮下或表皮内,这取决于病变的年龄和再上皮化的程度。组织病理学检查,可能会发现轻度炎症以及微血管病变的变化,例如真皮乳头状血管壁增厚。免疫荧光通常呈阴性。
Ⅱ、伴有棘层松解症的免疫大疱性疾病
上皮内自身免疫性大疱性疾病分为两大类。在寻常型天疱疮(PV)中,分离更深,通常在基底细胞层上方,而在落叶型天疱疮(PF)中,分离更浅,分离位于颗粒层。从概念上讲,这种分离水平的差异,与桥粒芯糖蛋白1和3在上皮细胞中的作用和差异表达有关(图4)。重要的是,依赖于典型的上皮内棘层松解水平,作为唯一的诊断线索,可能会产生误导,因为PV可以显示上皮细胞上部的棘层松解,而PF也可以出现基底上层的分离。
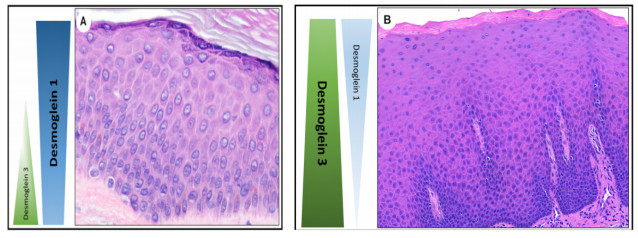
图 4.桥粒芯糖蛋白1和桥粒芯糖蛋白3在皮肤(A)和黏膜(B)中差异表达的示意图。在皮肤表面,桥粒芯糖蛋白1在整个表皮的角质化细胞间表达,但在表层更为突出。相反,桥粒芯糖蛋白3表达主要在基底层和基底层上(A)。在粘膜表面,桥粒芯糖蛋白1和桥粒芯糖蛋白3均在整个鳞状上皮细胞中表达,然而,与桥粒芯糖蛋白3表达相比,桥粒芯糖蛋白1的细胞间表达强度较低(B)。
①伴有基底上上皮内分离的免疫大疱性疾病
(1)寻常型天疱疮(PV)
基底上分离的自身免疫性大疱性疾病的原型是PV,它是大多数国家最常见的天疱疮亚型。在大多数患者中,PV最初表现为疼痛的粘膜糜烂,这种糜烂往往会持续存在(图5A和B)。特征性皮肤损伤,是在正常外观或红斑皮肤的背景上发展的糜烂和松弛性水疱。水泡很脆弱,很容易破裂,导致裸露和结痂区域(图5C)。
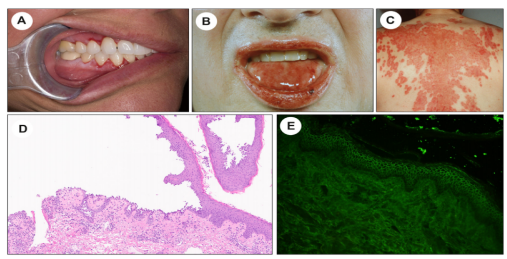
图5.寻常型天疱疮(PV)。(A)早期脱屑性牙龈炎。(B)唇炎伴有弥漫性红斑和舌头发白。(C)红斑、环状糜烂,趋向于汇合,覆盖背部大面积表面积。(D)富含中性粒细胞的基底上层分离,基底层角质形成细胞类似于“墓碑”(X100)。(E)直接免疫荧光检查IgG细胞间沉积,类似“鱼网”。
PV的组织病理学特征,取决于病变在其演变过程中所处的阶段。在最早阶段,桥粒粘连的丧失,表现为下层上皮细胞间水肿。随着病变的发展,棘层松解变得更加明显,通常会导致基底上水泡。基底角质形成细胞失去侧向连接,但仍通过完整的半桥粒附着在下面的BMZ上,形成“墓碑样”的外观(图5D)。自由漂浮的毛干和皮脂腺细胞,也可能出现在水泡腔内,表明附件受累。棘层松解延伸至附件,可能与表皮棘层松解同时存在,或孤立出现。值得注意的是,附件棘层松解,可累及毛囊以及皮脂腺、外分泌腺和大汗腺。传统上认为,附件棘层松解,被认为是有助于区分PV和PF的发现。然而,最近的一项研究发现,附件棘层松解,在PV和PF中均可发生。
PV的经典DIF表现,可见C3的IgG细胞间沉积,呈“鱼网”或“格子”样改变(图5E)。值得注意的是,DIF检测也可以在根鞘完整的拔毛上进行,可见IgG在 PV中沿着外根鞘在细胞间沉积。在大约90% 的活动性PV病例中,通过IIF检测,可观察到循环抗上皮细胞表面抗体。BIOCHIP是一种新的多重IIF技术,在天疱疮诊断中具有潜在用途。通过ELISA对自身抗体进行血清学检测,是一种高度敏感和特异的诊断技术,可用于多种免疫大疱性疾病,包括PV。除了血清学诊断外,该检测方法还可以用于监测PV的活动和治疗决策的制定。事实上,在2020年发布的国际天疱疮诊断和管理建议中,桥粒芯糖蛋白3自身抗体的ELISA,被推荐为疾病活动血清学监测的主要工具;如果ELISA不可用,则使用IIF。
——未完待续——
点此下载原文献






















共0条评论