[导读] 译者:陈旭
导读
女性生殖道中,中肾管病变并不常见,起源于上生殖道的病变,比发生于下生殖道的病变(中肾管增生和癌)少得多。最常见的上生殖道病变,包括网状囊肿/囊腺瘤和Wolffian起源的女性附件肿瘤 (FATWO)。STK11附件肿瘤,通常与Peutz-Jeghers综合征相关,通常具有涎腺源性肿瘤形态特点,但来源不明。“中肾管样”腺癌,是一种与中肾管癌具有相似性的恶性肿瘤,组织学特点类似FATWO和STK11附件肿瘤。2022年8月,美国芝加哥大学医学院的J A Bennett教授和麻省总医院病理科E Oliva医师,在病理学知名期刊《Histopathology》上发表了题为“The complex and often confusing history, histology and histogenesis of mesonephric, STK11 adnexal tumour and mesonephric-like neoplasms of the upper female genital tract (including broad ligament)”的综述性文章,详尽总结了这几种肿瘤的临床病理特点。下面笔者将这篇综述全文编译如下,供相关医师参考。

摘要
女性生殖道中,中肾管病变并不常见,起源于上生殖道的病变,比发生于下生殖道的病变(中肾管增生和癌)少得多。最常见的上生殖道病变,包括网状囊肿/囊腺瘤和Wolffian起源的女性附件肿瘤 (FATWO)。FATWO的形态学、免疫组织化学和分子遗传学具有独特特点。STK11附件肿瘤,通常与Peutz-Jeghers综合征相关,通常具有涎腺源性肿瘤形态特点,但来源不明。“中肾管样”腺癌,是一种与中肾管癌具有相似性的恶性肿瘤,但目前,基于其与其他苗勒管肿瘤和分子遗传学特点,而被认为是苗勒管衍生的肿瘤,并且组织学特点类似FATWO和STK11附件肿瘤。在这篇综述中,作者阐述了女性上生殖道中肾增生的历史概述,并讨论了中肾病变、STK11附件肿瘤、中肾样腺癌和类似病变。
简介
关于中肾管肿瘤的认知,是一个不断发展的过程。1939年,Schiller W博士在期刊《Am.J. Cancer》发表了一篇具有历史意义的文章,题为“ Mesonephroma ovari”,描述了八种起源于中肾管的肿瘤。然而,这项研究很快受到质疑。1959年,Teilum博士经研究发现,Schiller博士报告的肿瘤中,5种为卵黄囊肿瘤。在1939年Schiller博士的研究中,阐明了发生在老年患者的剩余肿瘤的性质。在这些肿瘤中,通常具有明显透明细胞质的细胞为特征。Barlow博士和Scully博士在1967年,最终证明了它们的Müllerian管性质,它们现在被称为“透明细胞癌”。
在1939年至1967年期间,尽管存在良性中肾管成分,特别是在阔韧带、宫颈和阴道中的良性中肾管成分的存在已得到充分证实,但对中肾管来源的肿瘤,关注有限。鉴于阔韧带中可见中肾残余(MR) ,一些妇科病理学家认为,该区域的一部分肿瘤可能属于中肾管类型。Scully博士于20世纪60年代,花费10年,收集了一系列中肾(Wolffian)衍生的阔韧带肿瘤,并于1973年报告了这些肿瘤。在该项研究中,Kariminejad博士和Scully博士描述了九种不同的肿瘤。此类肿瘤起源于阔韧带或输卵管,在组织学上与苗勒管、性索间质或间皮起源不相容,形态学上类似于MR,并将它们命名为“Wolffian管起源的女性附件肿瘤”(FATWO)。在这篇开创性文章发表后,对这种罕见肿瘤的更多形态学、免疫组织化学和分子研究,有助于支持这些肿瘤的中肾起源。
在20世纪70年代,Scully博士根据他在阔韧带肿瘤方面的经验,观察到具有相同形态的卵巢肿瘤,并开始做出卵巢Wolffian肿瘤的诊断,并于1983年报道了11例肿瘤。在随后的几年中,一些妇科病理专家认为,某些输卵管子宫内膜样癌与FATWO具有相似性,应称为“中肾样”腺癌,该肿瘤主要发生于子宫内膜和卵巢,尽管与真正的中肾肿瘤有一些相似之处,但更倾向于Müllerian管源性,最近的STK11附件肿瘤,目前没有明显的起源。
本综述的目的,是全面讨论上妇科管道中肾病变,包括MR、囊肿/囊腺瘤和FATWO,然后讨论STK11附件肿瘤和中肾样腺癌。
中肾残余物
在胚胎发育7周时,生殖道处于初级阶段,由中肾管(Wolffian)和苗勒管(paramesonephric)管组成。在没有睾酮和苗勒管抑制物质的情况下,中肾管退化,苗勒管发育,形成阴道、子宫和输卵管;然而,中肾管可能作为MR,在这些器官的外部持续存在。MR分为上下两区,各具特色。高位MR包括卵巢门中的卵巢网和阔韧带/输卵管系膜内的残余小管,而低位区域残余物,包括子宫颈(最广泛)、体部和阴道的外侧壁(3点钟和9点钟方向)中的残余物。除了卵巢网,高位和低位的MR在形态上相似,由内衬平淡立方细胞的小管组成,通常含有管腔内嗜酸性分泌物(图 1A、B)。然而,中肾小管通常较小,被上部区域的同心平滑肌层包围。极少数情况下,该位置的残余物可能会呈现附睾样外观,其特征是较大的小管内衬假复层柱状上皮和静纤毛(图 1D)。卵巢网由不规则的吻合小管组成,内衬平淡的立方细胞并被卵巢间质包围,整体外观与睾丸网类似,但发育程度较低(图 1C)。

图1.子宫颈(A)、输卵管系膜(B)和卵巢门(即卵巢网)(C)中的中肾残余。具有附睾样分化的上中肾残余物(D)。
有更多的研究关注低位MR的免疫组织化学特征,而不是高位MR,并且后者的研究集中在卵巢网(表 1)。MR通常对AE1/AE3、CAM5.2、Vimentin和CK7呈阳性,尽管后者通常在低位MR中呈弥漫性,在卵巢网中局灶状表达,并且在阔韧带/输卵管系膜残余物中,没有得到很好的研究。EMA在阔韧带/输卵管系膜和下 MR中,呈阳性表达,但在卵巢网中很少表达。大多数MR为CD10阳性;下方MR显示顶端/管腔(+/-细胞质)表达,而上方MR的染色仅限于细胞质。较低的MR inhibin表达阴性,而卵巢网中的表达水平较高。一项研究显示,大多数MR和卵巢网calretinin表达阳性,而阔韧带/输卵管系膜calretinin表达阴性。尽管未进行广泛研究,低位MR和卵巢网雄激素受体(AR)表达阳性,但雌激素受体(ER)和孕激素受体(PR)表达阴性。GATA3在低位MR中,呈中度至强阳性表达,有时呈“弥漫性”表达,位于阔韧带和卵巢网的MR,GATA3呈现局灶阳性,一些研究中呈现阴性表达。低位MR是PAX8表达阳性,p16表达局灶弱阳性,野生型p53和TTF-1表达阴性。相比之下,睾丸网通常表达CK7、PAX8、WT1、calretinin和AR,一小部分表达ER。
表 1.高位、低位中肾残余物的免疫组织化学差异
良性中肾管高位病变
网状囊肿/囊腺瘤是最常见的中肾管良性病变,经常诊断为浆液性囊腺瘤。它分布的年龄范围较广(23-80岁,平均=59岁)。临床表现通常是非特异性的,但一小部分患者具有雄激素表现,最常见的是男性化。肿瘤直径从1到24(平均=8.7)cm,13%病例是双侧的。大体上,囊肿是薄壁的,含有透明或黄色液体。在显微镜下,它们位于卵巢门中,但可能延伸到髓质中,并且通常显示出波浪状的轮廓,沿其内表面有不规则的裂缝(图 2A、B)。它们由扁平、立方和/或柱状细胞排列,无异型性、有丝分裂或纤毛。门细胞通常以带状方式围绕囊肿,通常被平滑肌包围。
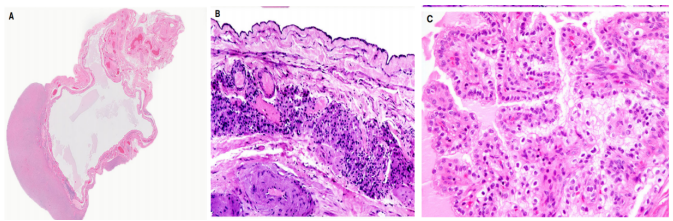
图2.网状囊腺瘤(A),囊壁有不规则的裂隙、门细胞和平滑肌(B)。透明细胞乳头状囊腺瘤(C)。
伴有透明细胞的乳头状囊腺瘤是罕见的,多数是散发性的,是Von Hippel-Lindau综合征的一种表现。虽然在附睾中更常见,但它也发生在输卵管系膜/阔韧带和卵巢中,并且起源于中肾管。镜下,病变显示管状乳头状生长和温和的立方细胞,细胞质透明或嗜酸性,通常CKP、EMA、CK7和CD10呈阳性,但ER和PR呈阴性(图 2C)。其他良性中肾高位病变包括腺瘤和卵巢网腺瘤性增生,两者都极为罕见,而且通常是偶然的显微镜发现。
女性Wolffian起源的附件肿瘤
临床特点
大多数FATWO好发于50岁和60岁女性之间,但目前发现,发病年龄范围更为广泛(19-83岁)。大多数肿瘤是偶然发现,患者偶尔出现腹痛或异常子宫出血。只有少数FATWO与术前血清雌激素水平升高相关。
大体观察
FATWO常见于阔韧带/输卵管系膜,很少发生在卵巢或腹膜后。肿瘤的大小范围很广(平均5.3-10厘米),通常边界清楚。极少数情况下,它们可能带有附在输卵管浆膜或输卵管系膜上的柄或蒂。当涉及卵巢时,它们通常会取代它,并且具有更大直径(平均值=11.5厘米)。在阔韧带中,它们的切面是实性、囊性或囊实性,实性区域呈灰黄色或棕褐色,坚硬、砂砾状、橡胶状到柔软易碎。囊肿含有浆液性、凝胶状或出血性液体。可见钙化、出血和/或坏死。在一项研究中,11例中有6例为实性和囊性,3例为模糊的分叶状切面。
微观特征
FATWO至少由三种主要架构模式中的一种组成——管状、实心或筛状,但通常是混合的(图 3和图4)。小管通常紧密堆积、细长且有时分叉,排列着立方形或柱状细胞,缺乏明显的顶端边界,且细胞核极化。密集排列的小管可能模仿固体生长,但网状染色突出了单个小管。有时小管可能会获得腺瘤样形态。在实心区域,细胞成片生长,通常具有轻微的纺锤形外观。筛状图案显示不同大小和形状的囊肿,内衬低立方形到扁平的细胞,偶尔具有鞋钉状外观。在这种模式中,很少有乳头状或肾小球样结构。腔内嗜酸性、分泌物PAS染色阳性。细胞显示出稀少的苍白细胞质,和圆形至卵圆形的细胞核,染色质细腻,核仁不明显,核分裂不常见 [每10个高倍视野(HPF)≤4个]。偶尔有散在的高级别非典型病灶(包括与高级别癌并列的一个)和活跃的核分裂,坏死和淋巴管侵犯不常见。 FATWO位于卵巢中心时,可显示胶原条带,呈现结节状或分叶状外观;偶尔观察到基质玻璃样变,基质成分少。

图3.女性Wolffian起源的附件肿瘤,伴筛状(A)、管状(B)和实性(C)生长和低度异型细胞学(D)。

图4. Wolffian起源的女性附件肿瘤,显示嗜酸性管腔分泌物(A)、透明间质(B)和腺瘤样外观(C)。Wolffian起源的恶性女性附件肿瘤 (FATWO)(D)显示经典特征(左)与高级别癌(右和插图)并列。
免疫组织化学
FATWO的免疫组织化学特征具有非特异性,因为它们可以表达上皮和性索间质标记物,以及激素受体。大多数肿瘤对CKP、Vimentin和CD10呈阳性,而约80%病例表达CK714-16 , 但不到20%的肿瘤显示局灶性EMA阳性。性索间质标记物,如calretinin、WT1和抑制素,分别以大约75%、60%和50%的不同程度表达。已对9个肿瘤进行了FOXL2评估,其中6个报告为阳性(通常为局灶性,强度未指定),而SF-1阳性率在研究中,差异很大(范围:0-73%)。ER和PR的表达不尽相同,而AR在78%的肿瘤中呈阳性(仅在一个系列中进行了研究)。 PAX8和GATA3通常为阴性(很少为局灶性/弱阳性),TTF-1始终为阴性,PAX2的表达丢失。在所研究的16个FATWO中,c-KIT在六个(五个细胞质/膜,一个核)中呈阳性;但是,尚未检测到CKIT突变。
分子特征
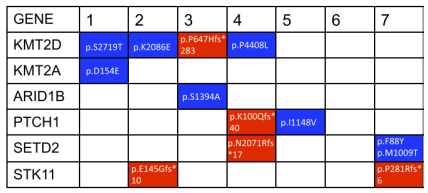
图. Wolffian管起源的女性附件肿瘤中复发性单核苷酸变异和拷贝数改变全部。蓝色表示错义突变。 红色方块表示移码突变。白色方块表示在该病例/基因中未鉴定到单核苷酸变异。图片源自于Mirkovic J,Dong F,Sholl LM et al.Targeted genomic profiling of female adnexal tumors of probable Wolffian origin (FATWO). Int.J. Gynecol.Pathol.2019;38;543–551.
应用NGS测序技术,研究了有限数量的肿瘤,常见的突变基因及对于疾病如下:中肾/中肾样腺癌(KRAS、NRAS)、子宫内膜样癌(PIK3CA、ARID1A)、性索间质瘤(FOXL2、DICER1)和间皮瘤 ( BAP1 , NF2 )。STK11是唯一检测到的复发突变,这组肿瘤后来被命名为STK11附件肿瘤,曾经归类为 FATWO。 Mirokovic在一项研究中描述了KMT2D突变,但经过进一步研究,发现只有p.P647Hfs位点的突变,具有致病性影响。同样,根据公开可用的数据库,Cossu发现了PIK3CA p.I391M、MET p.E168D、 TP53 p.P72R位点突变,致病的可能性较小。而检测到其他变体(CTNNB1 p.S33C、BRAF p.V600E、 CDKN2Ap.Y129*) ,可以影响蛋白质功能,它们在FATWO中是非特异性的,也可以在其他妇科肿瘤中检测到。在上述研究中,查看所提供的显微照片,无法明确确诊FATWO;因此,在进行更多研究之前,必须谨慎解释这些发现。Bennett于2017年发现了带有APC突变的FATWO ,和带有MBD4突变的FATWO。妇科APC突变通常局限于微囊性间质瘤,根据形态学和免疫组织化学,可以很容易地将其与FATWO区分开来,MBD4女性生殖道的改变并不常见。
恶性特征
确定FATWO中的恶性成分具有挑战性,因为以往文献中包含的肿瘤,并不是真正的FATWO,因为没有显示明确的典型区域。分类为恶性FATWO的肿瘤,许多代表STK11具有异常特征的附件肿瘤,或子宫内膜样癌(EC)。然而,我们根据显微照片和注意到典型区域存在的显微描述,发现有三个病例是恶性FATWO。在第一个患者中,可见结肠浆膜转移。肿瘤由与高级别癌并列的常规FATWO组成,每10个HPF和淋巴血管浸润高达16个,而转移大部分是坏死的。在第二个患者中,可见阔韧带肿瘤和网膜转移。肿瘤主要是实性的,区域间有小管和腺体;还有类似筛子的结构。细胞中度非典型,每10个HPF有多达8个有丝分裂;转移沉积物在形态上相似。最后一个患者,可见阔韧带中肿块,该肿块在3年后局部复发。复发显示与FATWO一致的外观。
鉴别诊断
FATWO的主要鉴别诊断包括STK11附件肿瘤、中肾样腺癌(MLA)、EC、性索间质瘤和间皮瘤。表2突出显示了FATWO、STK11肿瘤和MLA之间的关键形态学、免疫组织化学和分子差异。
表2.FATWO、STK11附件肿瘤和中肾样腺癌的临床病理特征
*很少表现为灶状阳性
EC,尤其是那些具有不寻常特征的EC,有时会与FATWO混淆。与FATWO类似,EC类似于FATWO(图 5),显示出多种结构模式,但通常显示小的、紧密堆积的、平庸的细胞的固体生长,这些细胞被许多从小到局部囊性的管腔刺穿。可见致密的嗜酸性分泌物和局灶性纺锤体。此外,这些EC通常位于输卵管腔内,而不是附件软组织。具有梭形细胞EC可能显示出分叶状外观、肿瘤细胞的同心轮生和偶发的嗜酸性管腔分泌物,在某种程度上类似于FATWO。虽然在输卵管内有报道,但它们通常起源于卵巢,梭形细胞通常占肿瘤的≥50%。最后,EC模仿性索间质瘤可能类似于FATWO,如果它显示出明显的管状生长。然而,模仿性索间质瘤的EC通常也出现在卵巢中。一般而言,所有EC变体都表现出独特的结构良好的腺体成分,同时可以看到子宫内膜异位症、腺纤维瘤、鳞状分化和腔内粘蛋白;因此,抽样是关键。免疫组织化学也可能有帮助,因为EC通常广泛为PAX8、EMA和claudin-4(在FATWO中最多呈局灶性阳性)阳性,可能显示PTEN或ARID1A丢失,抑制素呈阴性表达(2%的EC呈阳性),并且在ARID1A、PTEN、PIK3CA、KRAS和/或CTNNB1中存在突变。

图5.输卵管子宫内膜样癌,类似于Wolffian起源的附件肿瘤,伴管腔(A)和粘膜生长(B),圆形至扩张的小管,伴有嗜酸性管腔分泌物(C)。
性索间质瘤,包括支持细胞瘤、成人颗粒细胞瘤和性索间质瘤,NOS是FATWO的鉴别诊断。因为卵巢外很少有性索间质肿瘤的报道。临床病史可能有助于区分支持细胞瘤和FATWO,高达45%的患者存在高雄激素血症。病理学特点,包括分叶状且通常为棕褐色至黄色的切面、结节状结构伴有水肿但非粘液样背景,以及Leydig细胞和/或异源成分,通常被视为具有致密腔内嗜酸性分泌物的肠型腺体。同样,大约30%的支持细胞瘤(雌激素大于雄激素)患者存在激素表现,它们主要由中空至实心小管组成。
成人颗粒细胞瘤的一些模式,与FATWO类似,但细胞核通常呈“咖啡豆”形,具有明显的核沟,并且可能存在Call-Exner小体或其他特征模式。最后,性索间质瘤,NOS是一种必须谨慎进行的排除性诊断。一般来说,免疫组织化学,对区分性索间质瘤和FATWO没有帮助,因为它们都可能对WT1、calretinin和CD10呈阳性,但对PAX8和EMA呈阴性(或最多局部阳性)。抑制素在大多数性索间质瘤中显示广泛染色,但在FATWO中可能呈局部阳性;然而,弥漫性染色已被报道。FOXL2在80%的性索间质瘤中呈阳性,在九个FATWO中进行了研究(67%呈阳性)。同样,强烈而弥漫的SF-1表达,是大多数性索间质肿瘤的特征,而FATWO则表现出可变的表达。在难以分类的肿瘤中,分子检测可能会有所帮助,因为FATWO中没有FOXL2和DICER1突变。
恶性间皮瘤也是FATWO的鉴别诊断。肿瘤分布可能有所帮助,因为与FATWO相比,间皮瘤通常表现为弥漫性或斑块样生长;然而,已有局部间皮瘤的报道。在组织学上,这两种肿瘤都表现出多种结构模式,但除了少数显示“腺瘤样”区域外,恶性间皮瘤的特征性乳头状和管状生长,在FATWO中很少甚至不存在。这两种肿瘤都经常表达WT1和calretinin,而BAP-1丢失(据报道对恶性间皮增生具有高度特异性),存在于55-67%的腹膜间皮瘤中,它尚未在FATWO中进行研究。电子显微镜检查可能对具有挑战性的肿瘤最有益,缺乏糖萼的细长顶端微绒毛、核周张力丝束和长桥粒,是间皮瘤的诊断依据。
点此下载原文献






















共0条评论