[导读] 本文作者:阳仔
患者男性,48岁,2020年4月出现上腹部隐痛不适,烧灼样疼痛,饭前明显,自行服用奥美拉唑、阿莫西林、铝碳酸秘、克拉霉素后,症状稍有好转,10天后在当地医院就诊,上腹部CT增强显示:胃窦部稍厚,胃镜:胃溃疡伴增生,病理活检示:(胃窦)中-低分化腺癌。血液学检查:甲胎蛋白(AFP) 253.06ng/ml明显升高,癌胚抗原(CEA)15.73ng/ml,遂行远端胃癌根治术(毕1式)。
病理检查
巨检:远端胃切除标本一个,大弯长14cm,小弯长8cm,距上切端6cm、下切端2cm,于胃窦小弯侧见一溃疡型肿物,大小4.5x4x1cm,切面灰白实性质硬。镜检:肿瘤细胞主要由2种成分组成,第一种为经典型管状腺癌,中至低分化,约占胃肿瘤的10%,位于肿瘤边缘浅表处。第二种为管状、乳头状形态,细胞呈柱状或立方状,胞质透明,核中度异型,核分裂象易见,可见小核仁,约占胃肿瘤的90%,可见少量坏死,血管内见癌栓,神经未见癌侵犯,淋巴结7/38见有癌转移,转移成分同前。所有切缘均阴性。免疫组化:胞浆透明的肿瘤细胞呈SALL4(+)、AFP(+)、CDX-2(+)、HER-(2+)、Ki-67(90%+)、P53(-)、Glypican3(-),提示这些肿瘤细胞既表达胚胎性蛋白,又表达肠上皮标志物,符合胚胎性肠上皮分化的特点。FISH检测HER-2基因有扩增。
病理诊断:(胃窦)伴有肠母细胞分化的胃腺癌,血管内见癌栓,神经未见癌侵犯,浸润至肌层,各切缘均未见癌组织累及;淋巴结7/38见有癌转移。
患者术后即行SOX(奥沙利铂+替吉奥)方案化疗,共6个疗程,后在当地服用中药(具体成分不详),术后2年内,每3个月在当地医院复查一次,影像学及胃镜检查未见异常,复查甲胎蛋白和癌胚抗原均恢复正常,患者恢复良好。
讨论
伴有肠母细胞分化的胃腺癌(Gastric cancer with enteroblastic diferentiation,GAED)是一种少见的产甲胎蛋白胃癌(AFPGC)变体,AFP最初于1956年被发现,是一种白蛋白超家族蛋白,主要由胎儿肝脏、卵黄囊和胃肠道组织合成,出生1年后,AFP迅速消失,健康成人血清中检测不到,成人AFP表达升高通常与肝细胞癌或卵黄囊肿瘤有关,它已被用作检测这些肿瘤的重要诊断工具,以及肿瘤复发或转移的早期预测因子。AFPGC是指排除肝炎、肝硬化、肝癌、卵黄囊瘤等产生AFP的疾病,经病理组织学证实伴有AFP升高的一类异质性肿瘤,可由多种不同病理亚型的胃腺癌构成,根据组织形态学将其分为4种类型:胞质透明的高分化乳头状癌或管状腺癌、肝样腺癌、伴有肠母细胞分化的腺癌、卵黄囊瘤样癌。肿瘤特征如下:(1)柱状或立方状的癌细胞主要以微管乳头状和腺体型生长;(2)胞浆中含有丰富的糖原颗粒,胞浆透亮、清晰,但无粘蛋白产生,基底侧有椭圆形核;(3)胞浆透明的癌细胞周围可见散在分布的潘氏细胞;(4)癌细胞产生AFP、CEA等癌胚蛋白; (5)从超微结构上看,癌细胞有发育良好的微绒毛,有核心丝,其根部形成偶见的终末网,与胎龄内的肠道吸收上皮相一致[1]。GAED好发于老年男性,多位于胃中部或下部,占胃癌的1.3-5.4%,常伴随血清AFP升高,与传统分化腺癌相比,具有更高的淋巴结浸润率(76%:41%)、脉管浸润率(72%:31%)、肝转移率(31%:6%),预后差,故应引起病理医生的重视,避免将其诊断为高分化的乳头状腺癌或中分化的管状腺癌[2]。
一、发病机制
目前,GAED的发病机制尚不明确。1829年提出的癌症起源的胚胎休眠假说表明成熟组织中存在胚胎样细胞 ,癌症可能是由胚胎发生后残留在器官中的胚胎细胞发展而来的 ,而这些胚胎细胞就是肿瘤干细胞(cancer stem cells,CSCs)。越来越多的肿瘤包括精原细胞瘤、卵黄囊瘤、胚胎性癌、畸胎瘤、胃癌、肝癌、恶性黑色素瘤等表达胚胎细胞标记物,如HCG、CEA、Oct-4、SALL4、AFP、Glypican3,提示肿瘤可能是由细胞分化不同阶段的祖细胞样细胞发展而来。SALL4是维持干细胞多能性的核心核因子,在胚胎干细胞中,SALL4与Oct4、Nanog和Sox2形成核心转录网络,以驱动胚胎干细胞自我更新。在癌细胞中,SALL4与核小体重塑脱乙酰酶相关联,以沉默肿瘤抑制基因[3]。在胚胎分化发育过程中,消化系统器官均来自内胚层,胃和肝由胚胎的前肠衍生而来,向周边延续与卵黄囊相接[4],因此,AFPGC中各组织学亚型之间免疫组化标记类似且分化均较初级。GAED与幽门螺杆菌(HP)感染的关系尚未确定,在以往的报道中,部分GAED患者为HP阳性,但也有病例是在根除感染治疗后发生的,基于这些情况,我们对幽门螺旋杆菌感染在GAED的发展中是否发挥作用保持疑问。
二、组织学特征及鉴别诊断
显微镜下,GAED由立方状或柱状肿瘤细胞组成,胞质透明,糖原丰富,但无粘蛋白产生,椭圆形细胞核位于基底部,类似胎儿早期发育第2-4个月的原始肠上皮形态,可显示多种组织学模式,包括管状、腺状、囊状、乳头状、实体小巢状,无严重的间质反应[2]。免疫组化,肿瘤细胞常表达胚胎标记物SALL4、Glypican3、AFP(阳性率分别为83%、72%、45%)及肠上皮标记物CD10、CDX2、Villin,粘液蛋白MUC6多为阳性,而MUC2、MUC5AC多为阴性。AFP的产生通常被认为是肿瘤细胞逆向分化为能够产生AFP的胎儿细胞的结果,提示GAED出现逆分化,然而有些GAED不具备产生AFP的能力,GAED与AFP之间的联系还不清楚, 血清AFP值>292ng/mL,与更多的淋巴结转移和较晚的临床分期相关,血清AFP值>1000ng/mL,提示肝转移,术后血清AFP升高强烈表明肿瘤残留、转移或复发,当血清AFP>300ng/mL时,患者1年、3年和5年生存率显著降低[5]。需要指出的是,在大部分GAED病例中,表层黏膜层都被传统的管状腺癌覆盖,癌细胞从粘膜层较深的部分产生并通过静脉侵入粘膜下层,粘膜下层无明显间质反应,提示普通型腺癌向深层浸润和增殖的同时可能逆分化为伴肠母细胞分化的腺癌,并因此获得了产生AFP的能力。由于活检标本只能采集浅表黏膜层组织,我们认为不能通过活检标本检查来诊断GAED。但近来陆续有病例报告通过内镜黏膜下剥离术诊断纯肠胚细胞分化的GAED,呈实体和小梁状生长,周围未发现经典腺癌成分[6],提示病理医师尽管单纯的GAED非常罕见,但也不能排除其出现在早期癌症的活检标本中,因为我们无法排除经典腺癌成分在肿瘤侵袭和增殖过程中消失或GAED从粘膜层开始生长的可能性。少部分GAED病例在侵袭过程中可出现肝样腺癌、绒毛膜癌成分。
鉴别诊断:①胃肝样腺癌:肿瘤由多角形嗜酸性肝细胞样肿瘤细胞组成,胞质内可见嗜酸性小体,D-PAS染色阳性,呈梁索状、巢状、实体状排列,SALL4、CDX2多呈局灶性、强弱不等阳性,强表达AFP、Arginase-1、Glypican3、HepPar-1,而CD10、MUC2、MUC5AC、MUC6阴性。②胃卵黄囊瘤样癌:肿瘤细胞排列方式多样,包括微囊状、网状、内胚窦样、管状、实性等,常见内胚窦样小体和红染的玻璃小球,但此病极为罕见,诊断需谨慎。③肾透明细胞癌:组织学形态相似,但不表达胚胎及肠上皮标记物。④中/高分化腺癌:尽管经典腺癌也可排列成管状或乳头状方式,但无具有透明或空泡状的胞质,免疫组化也不表达胚胎标记物。
三、分子特征
癌症基因组图谱确定了胃癌的四种亚型,爱泼斯坦-巴尔病毒感染(EBV)、微卫星不稳定性(MSI)、基因组稳定(GS)和染色体不稳定(CIN)肿瘤类型,GAED为染色体不稳定型。GAED常表现为大片段基因杂合性缺失(LOH),LOH常见于17p(100%)、13q(88%)、3p(87%)、5q和9p(80%)、11q(70%)、18q(58%)等,其中染色体13q上的LOH在肝细胞癌中也经常出现同样的缺失,而肝细胞癌通常表现为血清AFP值升高[7]。最近一项针对105名AFPGC患者的全外显子测序分析显示,有许多潜在靶向基因改变,包括TP53(69%)、ERBB2(31%)、CCNE1(29%)、MYC(22%)、CSMD3、CCND1、FPR1、MCL1、FLT1、ERBB3、AURKA、AXL等[8]。其中,TP53作为肿瘤抑制因子,在保持基因组稳定性方面发挥着重要作用,其突变与癌基因扩增、抑癌基因缺失和核苷酸突变有关,AFPGC中TP53反复出现的错义突变R273H/C、R272M和R282W与GC中常见的突变TP53 R175H/G分布不同,而GC中频繁突变的驱动基因PIK3CA、KRAS、APC罕见发生于AFPGC[9]。ERBB2与CCNE1的高表达与肿瘤分期晚、淋巴结转移、脉管浸润、肝转移率有关,提示靶向基因的改变有助于肿瘤进展,ERBB2与CCNE1的阳性状态及肝转移是AFPGC的独立预后因素。CSMD3作为免疫调节剂,参与肺癌和肝癌的肿瘤发生和增殖。FPR1(甲酰肽受体1)参与上皮间质转化、血管生成、炎症、免疫反应[10]。作为仅存在于正常胃组织、胃腺癌及其转移灶中的高度特异性紧密连接成分,AFPGC中CLDN18.2显著降低,与患者术前血清AFP水平呈负相关[11]。DNMT3A是胚胎发生过程中建立的特定DNA甲基化模式,不仅在生殖细胞发育建立遗传印迹,而且在肿瘤发生中起关键作用,被认为是难治性癌症亚型潜在的基因治疗靶点,DNMT3A过表达与肠母细胞分化、高频淋巴管血管侵犯 、淋巴结及肝转移、腹膜扩散及复发有关[12]。总体而言AFPGC潜在的基因改变明显高于GC,这些潜在的分子靶点或许可为日后的精准治疗提供依据。
四、治疗与预后
AFPGC没有既定的治疗指南,目前通常遵循胃癌治疗规范,以手术和化疗为主,其中根治性手术仍具有重要意义,其中,无淋巴血管侵犯的早期粘膜内GAED,经内镜黏膜下剥离术可治愈。FLEP、SOX、5-FU+紫杉醇等化疗方案显示出良好的反应率,针对ERBB2与CCNE1扩增或过表达的靶向药物曲妥珠单抗和AZD5438(细胞周期抑制剂)可发挥抗肿瘤作用,佐贝妥昔单抗联合多柔比星、奥沙利铂和卡培他滨可显著改善晚期CLDN18.2阳性胃癌患者的无进展生存期,虽然仅在约20%的病例中发现CLDN18.2阳性,明显低于GC,但至少小部分患者目前是获益的[13],尽管该病具有侵袭性生物学行为,但适当的治疗仍是预后的重要因素。综上所述,GAED进展迅速,发现时大多处于晚期,常发生肝脏、淋巴结、脉管转移,故病理医师有必要了解这种罕见且高度恶性的癌症的临床病理学特征,早期发现这一疾病对患者来说非常重要。
参考文献
[1]WHO Classification of Tumours Editorial Board.WHOclassification of tumours.Digestive system tumours[M].5th ed. Lyon:IARC Press,2019.
[2]杜明占,郭凌川,王玉红.伴有肠母细胞分化的胃腺癌并肝转移1例[J].中华病理学杂志,2022,51(8):768-770.
[3]Bee Hui Liu,Chacko Jobichen,et al.Targeting cancer addiction for SALL4 by shifting its transcriptome with a pharmacologic peptide[J].2018,115(30):E7119-E7128.
[4]赵宏颖,石中月,谷雨妹等.伴肠母细胞分化的胃腺癌临床病理学及分子特征及c—myc在其表达的意义[J].诊断病理学杂志,2021,28(7):518-522.
[5]Matsumoto K,Ueyama H,Matsumoto K,et al.Clinicopathological features of alpha-fetoprotein producing early gastric cancer with enteroblastic differentiation[J].World J Gastroenterol,2016,22(36):8203-10.
[6]Rin Yamada,Shin-Ichiro Horiguchi,Tomoko Onishi,et al.Early Gastric Cancer with Purely Enteroblastic Differentiation and No Conventional Adenocarcinoma Component[J].Case Rep Pathol,2018,28:3620293.
[7]H Fujii,K Ichikawa,T Takagaki,et al.Genetic evolution of alpha fetoprotein producing gastric cancer[J].J Clin Pathol,2003,56(12):942-9.
[8]Jun Lu,Yongfeng Ding,Yanyan Chen,et al.Whole-exome sequencing of alpha-fetoprotein producing gastric carcinoma reveals genomic profile and therapeutic targets[J].Nat Commun,2021,12(1):3946.
[9]Zuhua Chen,Wenwen Huang,Tiantian Tian,et al.Characterization and validation of potential therapeutic targets based on the molecular signature of patient-derived xenografts in gastric cancer[J].J Hematol Oncol,2018,11(1):20.
[10]N Prevete,F Liotti,C Visciano,et al.The formyl peptide receptor 1 exerts a tumor suppressor function in human gastric cancer by inhibiting angiogenesis[J].Oncogene,2015,34(29):3826-38.
[11]Weiwei Weng,Meng Zhang,Shujuan Ni,et al.Decreased expression of claudin-18.2 in alpha-fetoprotein-producing gastric cancer compared to conventional gastric cancer[J].J Gastrointest Oncol,2022,13(3):1035-1045.
[12]Kataoka I,Funata S,Nagahama K,et al.DNMT3A overexpression is associated with aggressive behavior and enteroblastic differentiation of gastric adenocarcinoma.Ann Diagn Pathol,2020,44:15 1456.
[13]Weihua Gong,Dawei Shou,Ping Gong.Extremely high expression of serum alpha-fetoprotein level of gastric adenocarcinoma:a rare case with an unexpected well-prognosis[J].Springerplus,2016,5(1):2056.
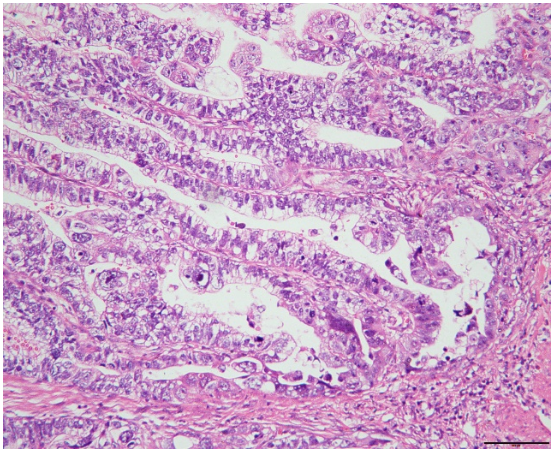
图1.肿瘤细胞胞质透明,呈管状、乳头状排列
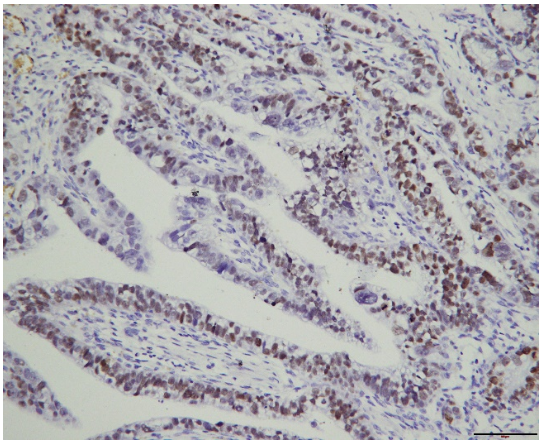
图2.肿瘤细胞SALL4(+)免疫组化
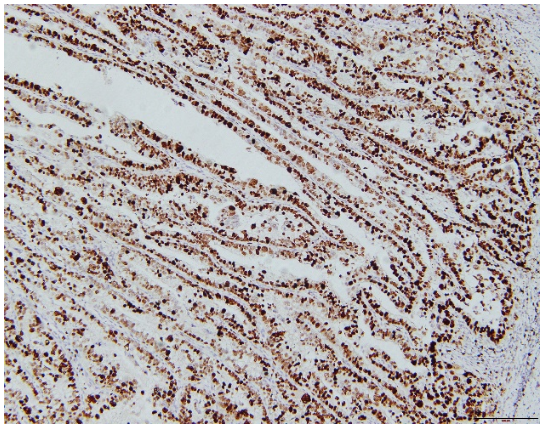
图3.Ki67增殖指数90%免疫组化
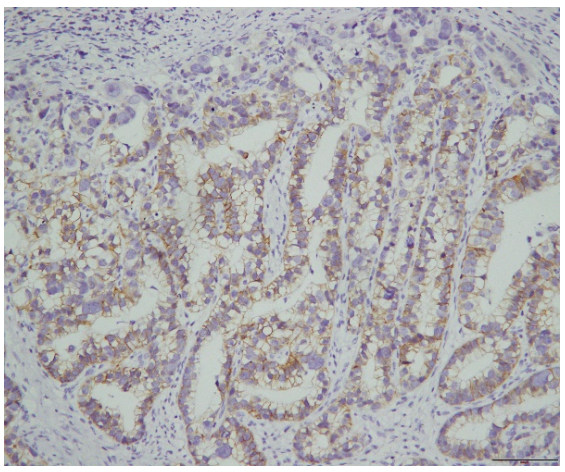
图4.肿瘤细胞HER-2(+)免疫组化
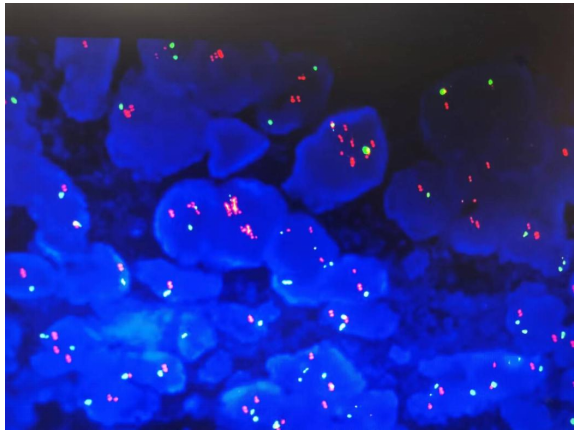
图5.FISH检测HER-2基因有扩增


















共0条评论