[导读] 本文作者:陈旭
往期回顾:
外周T细胞及自然杀伤细胞淋巴瘤的临床病理特点(一)
肠病相关T细胞淋巴瘤(EATL)
EATL是肠上皮内T细胞淋巴瘤,好发于CD个体中,并显示细胞多形性,通常是炎症成分。这种疾病在西方人群中更为普遍。据报道,亚洲人几乎不存在EATL,但最近在韩国、中国和其他亚洲国家进行的一项流行病学研究表明,其流行率接近MEITL。该疾病发病的中位年龄超过60岁,男性好发。EATL通常发生在CD或RCD患者中,但多达一半的患者没有既往史。HLA-DQ2等位基因的纯合性缺失和年龄较大,是高危因素。EATL表现为胃肠道症状,通常导致肠穿孔、腹膜炎或梗阻。EATL最常影响小肠,很少影响大肠或胃;病变通常是多灶性的。偶尔,EATL可能出现在胃肠道之外(例如,皮肤、脾脏或CNS),尤其是从RCD-II 演变而来的病例。该病预后较差,中位生存期为7个月。
形态学和免疫表型
EATL表现为伴有或不伴有狭窄的溃疡性病变,或肿瘤肿块(图3)。肠系膜浸润和淋巴结受累很常见。肿瘤可以是单形的或多形的,形态学范围从具有突出核仁的中等到大细胞,到间变性型或奇异的多核细胞。血管中心性和血管浸润,导致广泛坏死和高有丝分裂率是常见的。富含嗜酸性粒细胞、浆细胞和组织细胞的多形性炎症浸润很常见,有时会掩盖淋巴瘤细胞。肿瘤细胞可播散至远处肠上皮或黏膜。CD的组织病理学特征可见于肿瘤外。
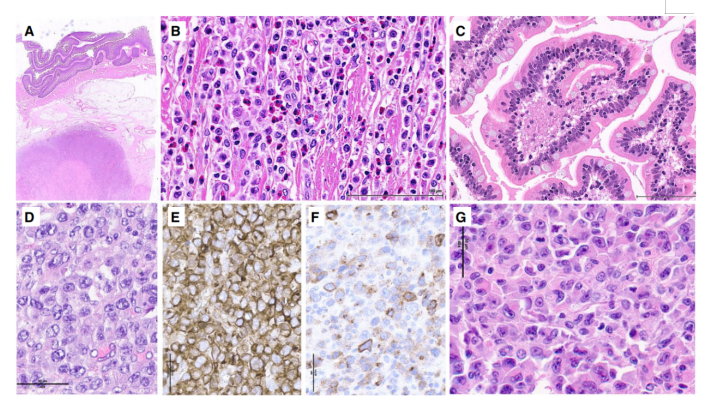
图3.肠病相关的T细胞淋巴瘤。A–C该EATL包括(A)带有坏死区域的大浸润性肿块,(B)包括一个富含嗜酸性粒细胞和多形性非典型淋巴样细胞的多形浸润;远处黏膜(C)显示绒毛保留但IEL增加。(D–F)EATL由(D)具有间变性特征的大淋巴细胞组成,并且是(E)强CD30阳性和(F)穿孔素阳性。(G)肿瘤性淋巴细胞与许多组织细胞混合。
EATL细胞通常是CD2+、CD3+、CD4-、CD5-、CD7+、CD8-和CD56-,并表达细胞毒性标志物(TIA1、颗粒酶B和/或穿孔素)。高达50%的EATL表达CD8 。大多数大细胞CD30阳性,ALK和EBV呈阴性。大多数病例表达CD103并且TCR表达阴性(“TCR-沉默”);大约25%病例是TCRαβ+或表达细胞质TCRβ链,而TCRγ链很少表达。在许多情况下可以看到p53的过度表达。
分子和遗传特征
在大多数情况下,可以检测到克隆TCR基因重排。EATL表现出多种染色体失衡:9q增益和16q12.1缺失;染色体7、1q和5q的增益;染色体缺失涉及8p22-23.2、16q21.1、11q14.1-q14.2和9p21.2-p21.3 。EATL的突变与RCD-II的突变重叠,并且在RCD-II病例中的突变相似。因此,EATL的特征,是JAK/STAT 通路中高度复发的激活突变,最常见于JAK1(在p.c1097 热点)和STAT3,很少出现在JAK3、STAT5B、TYK2或SOCS1. 其他突变发生在NFκB基因(TNFAIP3)、参与表观遗传调控和基因表达的基因 ( KMT2D、BCOR、DDX3X )、丝裂原活化蛋白激酶 (MAPK) 通路基因(KRAS、NRAS、BRAF)和TP53 。
鉴别诊断
如果在肿瘤外未发现肠病特征,则在没有CD病史的患者中,确定EATL的诊断可能很困难。如果病理特征提示或符合EATL,特别是存在CD103过表达,则应建议诊断并进行血清学检测和HLA基因分型。在没有CD的情况下,诊断为肠T细胞淋巴瘤的诊断,NOS更合适。
在小肠外诊断EATL,可能具有挑战性。在CD患者中,任何T细胞LPD,即使是在肠道外,都应考虑EATL或RCD的诊断。
EATL可能是弥漫表达CD30,类似于ALCL,具有细胞毒性标志物表达和T细胞抗原的丧失。原发性肠道ALK阴性ALCL很少见,只有在彻底的临床鉴别,排除潜在的CD后才应考虑这种诊断。CD7和CD103可能有帮助,因为它们通常在EATL中表达,而在ALCL中表达为阴性或下调 。
单形性上皮性肠T细胞淋巴瘤(MEITL)
MEITL是一种罕见的与CD无关的原发性肠道T细胞淋巴瘤,定义为由中等大小的细胞组成的肿瘤,细胞核圆形,边缘呈淡色细胞质,典型表现为肠上皮显着浸润,缺乏EATL的炎症和坏死特征。MEITL主要影响老年人。它发生在世界各地,是亚洲的主要ITCL,男性好发。
大多数患者出现急性症状,主要与浸润性肿瘤块引起的肠穿孔、梗阻有关。MEITL通常累及小肠,有时伴有结肠病变。在结肠或胃中的表现很少见。可能会播散至区域淋巴结和远处器官。很少涉及骨髓。该病预后较差,中位总生存期为7-15个月。
形态学和免疫表型
虽然大多数病例由形态单一的中小型淋巴细胞组成,染色质分散,核仁不明显(图4),但少数病例显示细胞多形性、较大的细胞大小、水泡状染色质和/或突出的核仁,或者具有高具有丰富的细胞凋亡和星空外观的级形态模式(图5)。一些病例有远离溃疡表面的坏死和血管壁的侵袭。与EATL不同,通常没有明显的炎症浸润。瘤周黏膜表现出显着的上皮性,黏膜下层和固有肌层受累较少。远处黏膜可能含有斑片状病灶,IELs增加而无绒毛萎缩 。
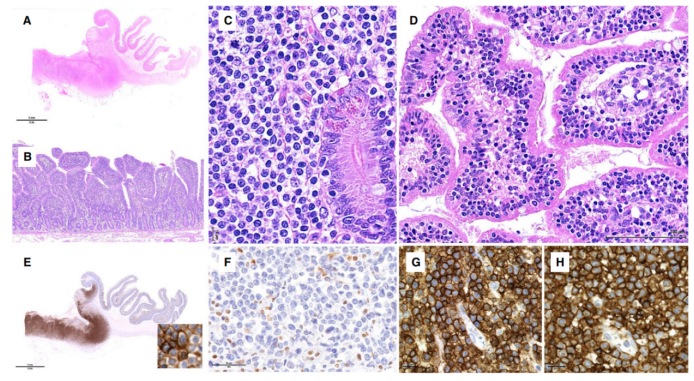
图4.单形性上皮性肠T细胞淋巴瘤。(A–B)典型的低倍镜下显示(A)为透壁溃疡性肿瘤,(B)侧向黏膜扩散;(C)典型的MEITL细胞形态,由小到中等大小的细胞组成,细胞核圆形,细胞质透明,(D)上皮内扩散至邻近黏膜;(E-H)常见的MEITL免疫表型,其特征是(E)表达CD103,强而弥漫,(F)缺乏H3K26me3,以及表达(G)CD8和(H)CD56。
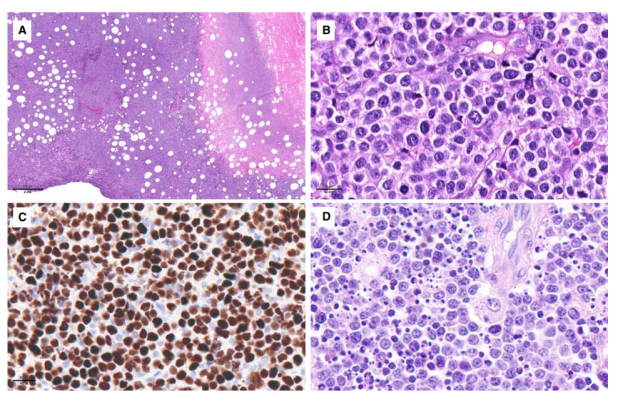
图5.具有非典型特征的单形性上皮性肠 T 细胞淋巴瘤。(A–C)非典型MEITL,(A)远离表面溃疡的大面积坏死,(B)多形性中等至大细胞细胞形态,(C)强p53表达(和基因组分析的TP53突变);(D)非典型MEITL由具有爆炸性外观、大量凋亡和星空图案的细胞组成。
免疫组织化学染色显示,MEITL细胞通常为CD8+和CD56+、CD2+、CD3+、CD4-、CD5-、CD7+和CD30-. 具有非典型形态的病例具有相似的免疫表型。大多数情况是TIA1+ ; 颗粒酶B或穿孔素的表达是可变的,但大多数病例具有活化的细胞毒性表型。CD20或其他B细胞抗原的异常表达,见于约20%的病例中。通常表达 TCR,TCRγδ,比 TCRαβ更常见;有些病例是TCR阴性的,很少同时表达两种TCR同种型。MATK的表达具有特征性。大约三分之一的病例表达MYC,部分反映了MYC基因位点的改变。EBV可见于散在的B细胞中,但在肿瘤细胞中始终不存在EBV表达。
分子和遗传特征
大多数病例显示,TCR基因的单克隆重排。与EATL共同的拷贝数改变,包括9q、1q和7q的增益。MEITL 中8q的丢失或增益明显高于EATL,并且MYC基因位点改变存在于20%的病例中。大多数病例包含编码赖氨酸甲基转移酶的SETD2的破坏性突变或缺失,导致组蛋白H3(H3K36me3) 中赖氨酸 36 的三甲基化减少或缺失。大多数病例还存在JAK-STAT 通路基因,或其负调节因子的突变,最常见的是STAT5B (>60%)和/或JAK3 (35–50%)。与EATL相比,观察到影响MAPK通路(BRAF、KRAS、NRAS)的互斥变化更为频繁,共同发生在约 80%的病例中。据报道,编码鸟嘌呤核苷酸结合蛋白亚基的GNAI2突变占9–21%。SETD2以外的表观遗传调控因子(包括CREBBP组蛋白乙酰转移酶、EP300、EZH2和ARID1)的突变并不常见。
鉴别诊断
MEITL的形态和免疫表型与EATL不同(表3)。尽管在MEITL中可以看到远离肿瘤的IEL增加,但通常不存在绒毛萎缩。CD56的表达可能提示ENKTCL的诊断,但MEITL为EBV阴性。在某些情况下,B细胞标志物的表达可能导致考虑B细胞淋巴瘤。
肠T细胞淋巴瘤,非特殊型(ITCL,NOS)
ITCL,NOS是一种排除诊断,用于排除其他T细胞淋巴瘤(如 ENKTCL、ALCL或HTLV-1相关成人T细胞),在肠道受累后,不符合EATL或MEITL条件的原发性胃肠道淋巴瘤淋巴瘤/白血病的情况下使用。当活检质量不足(太小、取样不足)而无法正确评估时,也可以使用该名称。
这组肿瘤仅代表一小部分ITCL。ITCL、NOS似乎常影响结肠或胃,约50%的患者在诊断时,已经患有III/IV期疾病。大多数ITCL、NOS是CD4-/CD8-或CD4+并表达TCRβF1(图6)。它们可能表达细胞毒性分子和CD30。有些病例中,EBV呈阳性反应。遗传学研究很少,但在ITCL,NOS中,已经报道了与MEITL和EATL 中改变的基因重叠的基因突变(JAK3,JAK1,STAT5B,DNMT3A,SETD2) 。
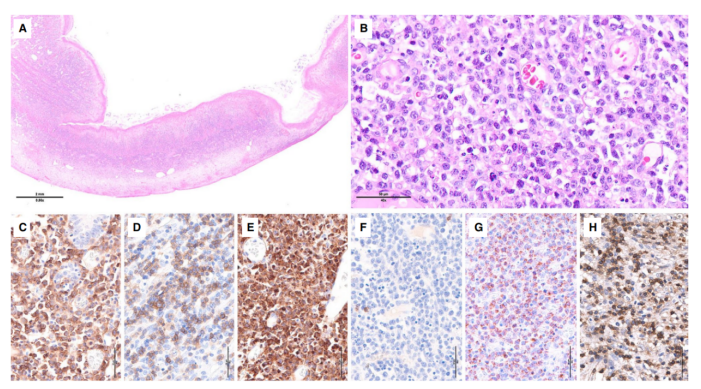
图6.肠道T细胞淋巴瘤,非特殊型。A小肠切片的全景图显示有穿孔的透壁肿瘤;B高倍镜下肿瘤由大的多形性细胞组成,可见大量有丝分裂;C-H免疫组织化学染色,肿瘤细胞是C CD4 +、D CD5 +/-、E CD7 +、F CD8 -、G TIA1 +和H TCRbetaF1 +/-
胃肠道惰性克隆性T细胞淋巴增生性疾病
胃肠道惰性T细胞LPD ,作为2017年WHO分类中,作为临时疾病分类被引入,并在2022年ICC中升级为新的疾病分类,并增加了术语“克隆”,以加强确定克隆性的重要性,这可以用于诊断,并将其与非克隆反应性疾病区分开来。
黏膜受累通常是多灶性的,好发于小肠和结肠。肠系膜淋巴结肿大。症状包括腹泻、呕吐、腹胀和腹痛。部分患者被误诊为RCD;其他患者有炎症性肠病、自身免疫或感染病史。这种疾病通常遵循一个慢性的、惰性的过程。大多数患者在经过几年的随访后,仍然患有疾病,偶尔有完全缓解的报道。然而,已经有病例,报道了疾病扩散到肝脏、淋巴结、扁桃体、骨髓和外周血,据报道,一些患者在诊断后10-27年因疾病进展而死亡。因此,该疾病也被一些作者称为“惰性肠道T细胞淋巴瘤”。
形态学和免疫表型
内镜检查显示结节、黏膜息肉、裂隙和糜烂。组织学上(图7),黏膜含有非破坏性的小型单形淋巴细胞增生,可浸润黏膜肌层或黏膜下层。有丝分裂和凋亡不明显;无血管侵犯和坏死。肠隐窝增生,但绒毛萎缩并不常见,尽管可能会遇到IEL。可见散在的肉芽肿、淋巴滤泡或混合嗜酸性粒细胞。转化病例具有非典型细胞,类似于PTCL。
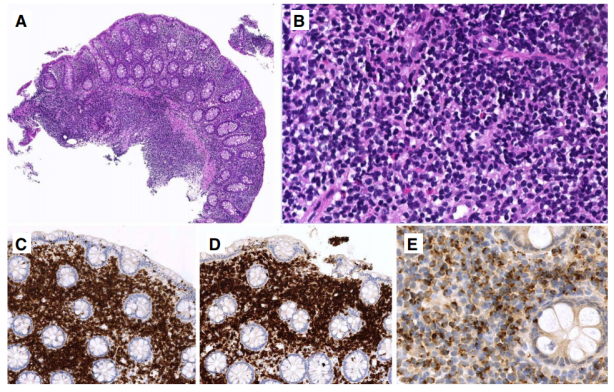
图7.胃肠道惰性克隆性T细胞淋巴增殖性疾病。A结肠内镜活检显示黏膜和黏膜下层有弥漫性和致密的嗜碱性细胞浸润;B浸润细胞由小的、温和的淋巴样细胞组成;C-E免疫组化淋巴细胞为C CD3 +、D CD8 +和E TIA1 +。
胃肠道惰性克隆T细胞LPD中,CD3 +、CD2 +和TCRβF1 +。在一些病例中,显示CD5和/或CD7的下调或缺失。大多数病例为CD4 +,较少见CD8 +,或有时为双阴性 (CD4 -/CD8 -) 或双阳性(CD4 +/CD8 +)。它们缺乏T滤泡辅助细胞标志物,t-bet和GATA-3表达不稳定。CD8 +的病例表达TIA1。CD103可以表达;CD56通常为阴性,与EBV无关。Ki67增殖指数非常低(<5%)。在一些病例中,可以观察到CD20的异常表达。转化的病例可能表达 MUM1/IRF4、CD30、CD25、穿孔素和颗粒酶B。
分子和遗传特征
遗传学研究很少,但表明CD4 +和CD8 +病例的发病机制是不同的。在一部分CD4 +病例中,发现了复发性STAT3::JAK2融合。携带STAT3::JAK2融合的病例显示STAT5磷酸化,可能对JAK抑制剂敏感。STAT3突变和SOCS1缺失,代表了主要在CD4 +病例中发现的其他复发性改变 。其他异常,包括表观遗传修饰基因的功能丧失突变(TET2、DNMT3A、KMT2D) ,以及CD8 +病例中IL2基因的结构改变。
鉴别诊断
胃肠道的惰性克隆T细胞LPD应与炎症性疾病和肠道淋巴瘤相鉴别。正确诊断的线索,包括病变的表面性质、是否有肿块形成、破坏性生长模式、细胞学检查、克隆TCR基因重排和低增殖指数。
胃肠道惰性NK细胞淋巴增殖性疾病
胃肠道惰性NK细胞LPD是一个新术语,包括NK细胞肠病或淋巴瘤样胃病的病例。在这些病例中,具有体细胞突变,可支持其肿瘤性质和分类。
截至目前,记录在案的病例不到50例,大多数患者无症状或出现轻度非特异性胃肠道症状。大多数病例累及胃或十二指肠、几个上消化道部位,或同时涉及上消化道和下消化道黏膜。几例胃部病例伴有幽门螺杆菌感染。尽管在一些患者中,进行了长达数年的各种治疗,但病变可能会自发消退或持续存在。没有进展为侵袭性疾病。然而,腹部淋巴结、阴道和胆囊也有类似病变的报道。
形态学和免疫表型
内镜下,黏膜呈红斑、扁平或息肉样病变、浅表糜烂或溃疡(图8A)。组织学上(图8B-F),固有层可见中至大淋巴细胞的非典型弥漫性浸润扩大,细胞质透明或略呈嗜酸性,染色质细腻,核仁不明显。浸润呈现上皮性,伴有腺体破坏,但缺乏血管中心性和坏死。非典型细胞具有CD2 +/-、cCD3 +、CD4 -、CD5 -、CD7 +、CD8 -/+、CD56 +NK细胞免疫表型,具有激活的细胞毒性特征,EBV是阴性的。Ki67增殖指数是可变的。
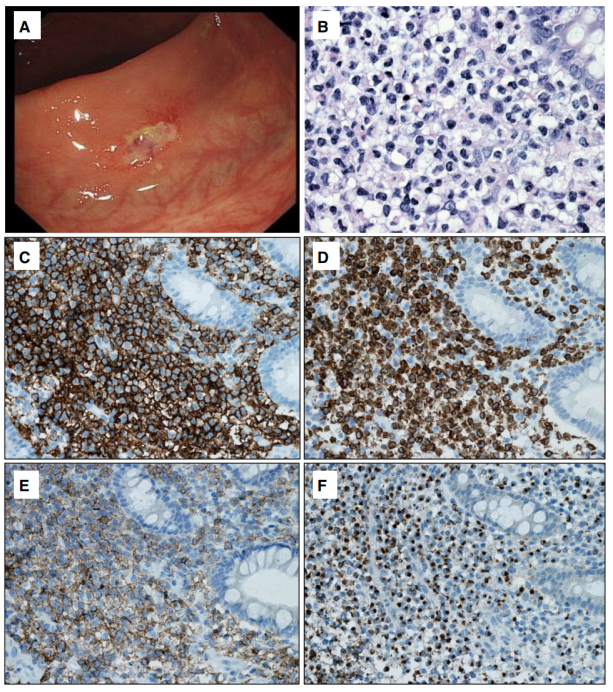
图8.胃肠道惰性NK细胞淋巴增殖性疾病。A胃的内窥镜视图,显示溃疡病灶;B高倍镜下黏膜有中等大小的非典型淋巴细胞浸润;C-F免疫组化,细胞是C CD3 +,D CD7 +,E部分 CD8 +,和F TIA1 +。EBV为阴性(未显示)
分子和遗传特征
所有病例都缺乏克隆TCR重排。在一项研究中,在3/10的病例中,发现了体细胞JAK3突变,这可能表明,某些患者存在潜在的治疗靶点。在其他病例中,发现了涉及PTPRS、AURKB、AXL、ERBB4、IGF1R、PIK3CB、CUL3、CHEK2、RUNX1T1、CIC、SMARCB1和SETD5的非复发突变。
肝脾T细胞淋巴瘤(HSTCL)
HSTCL非常罕见,仅占PTCL的1-2%。HSTCL具有独特的临床病理特征,肿瘤细胞分布于脾脏、骨髓和肝脏的血窦中,无淋巴结受累。大多数病例来自γδ T细胞,而较小的亚群来自αβT细胞。它们具有非活化的细胞毒性表型。
大多数患者是年轻人(中位年龄,35岁),男性常见。高达40%的病例发生在慢性免疫抑制的情况下,特别是在实体器官移植受者,或患有自身免疫性疾病的患者中,最常见的是用硫嘌呤或抗TNF药物治疗的克罗恩病。在血液肿瘤和恶性疟原虫感染患者中,也有HSTCL的报道。患者通常表现为脾肿大和肝肿大,无外周淋巴结肿大,并伴有B症状和血细胞减少,尤其是血小板减少。该疾病对基于蒽环类药物的化疗具有抗药性,大多数患者在诊断后两年内死亡。
形态学和免疫表型
在脾脏中,HSTCL广泛累及鼻窦,并在不同程度上累及红髓索,白髓则萎缩。HSTCL细胞通常中等大小,核圆形或稍不规则,染色质浓缩,核仁不明显。细胞质苍白无颗粒。已经报道了具有更小或更大/多形性细胞或胚样形态的病例,特别是在进展期间。肝浸润呈正弦状,有或无门静脉聚集物(图9A-E)。骨髓一直受累(图9F–G),并且大多数诊断都是在骨髓样本上进行的。骨髓窦浸润是高度特征性的,通过免疫组织化学染色可以诊断,因此是重要的诊断标准。
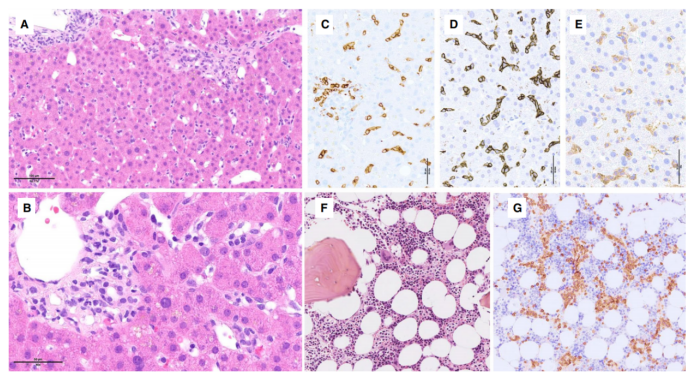
图9. 肝脾T细胞淋巴瘤。A–E与HSTCL相关的肝活检显示,A–B轻度非典型淋巴细胞轻度浸润,散在或小聚集在血窦和门静脉;免疫组织化学染色,C-E细胞对C CD8、D TCR delta和E CD56呈阳性。F–G骨髓活检显示F细胞增加,G CD3 免疫染色突出大量T细胞
分子和遗传特征
HSTCL中,最常见的遗传异常是7q等臂染色体(80%的病例),与αβ/γδ谱系无关。虽然这不是HSTCL特有的,但这些异常支持诊断。7号染色体失衡,与ABCB1、RUNDC3、PPP1R9A和CHN2基因的过表达有关,这可能是HSTCL细胞内在耐药性的原因。
HSTC的基因组改变包括SETD2的功能缺失突变和其他染色质修饰基因(INO80、TET3、SMARCA2)的突变。信号基因如STAT5B、STAT3和PIK3CD的突变也是常见的改变类型,少数病例含有TP53、URB5或IDH2的突变。
鉴别诊断
脾脏和骨髓的主要鉴别诊断(表4)是T细胞大颗粒淋巴细胞白血病 (T-LGLL):一种具有不同临床和实验室表现的慢性惰性LPD,以及侵袭性NK细胞白血病(ANKCL):一种累及脾脏、肝脏和骨髓的疾病,也出现在具有暴发性临床病程的年轻患者中。ANKCL的显着特征是在大多数情况下与EBV相关、NK细胞来源和通常的白血病表现。在骨髓活检中,ANKCL细胞以弥漫性间质模式浸润。
表4 肝脾T细胞淋巴瘤(HSTCL)、T细胞大颗粒淋巴细胞白血病(T-LGLL)和侵袭性NK细胞白血病(ANKCL)的鉴别诊断

乳房植入物相关的间变性大细胞淋巴瘤(BIA-ALCL)
BIA-ALCL在临床上,定义为由乳房植入物引起,并且在形态学和免疫表型上类似于全身性ALK阴性ALCL。它是2017年WHO分类中的一个临时分类,并根据其独特的基因组和分子特征,升级为2022年ICC中新的疾病类型。
BIA-ALCL发生在女性(或很少男性)中,大多数患者出现假体周围积液,可通过囊切除术即可治愈。少数病例表现为浸润性肿瘤肿块,伴有或不伴有积液,或不常见的局部淋巴结肿大,这两者都代表不良预后因素。
形态学和免疫表型
BIA-ALCL细胞大,细胞核不规则,核仁明显,胞质丰富,有时呈空泡状。包膜切除标本含有大的间变性细胞,包埋在包膜表面的蛋白质和纤维蛋白物质中(图10),并且可能显示不同程度的包膜浸润。浸润到乳房可能与明显的炎症、嗜酸性粒细胞增多、坏死或硬化有关 。淋巴结受累通常是部分的,可以表现为窦状、滤泡周围、弥漫性或霍奇金样模式,通常伴有纤维化。
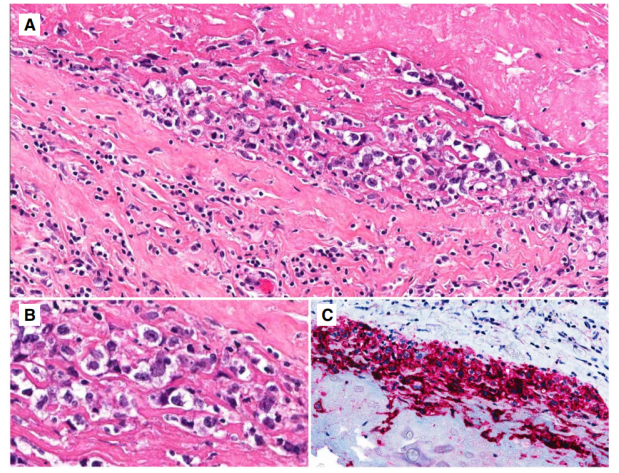
图10.乳房植入物相关的间变性大细胞淋巴瘤。A胶囊表面的低放大倍数显示嵌在纤维蛋白中的大型非典型细胞;B;大的间变性细胞;C、CD30表达阳性
根据定义,BIA-ALCL细胞具有强烈且弥漫性的CD30+和ALK-。大多数病例表达CD2、CD4、CD43、CD45 和EMA;CD3和CD15在<50%的病例中表达CD7和CD5通常为阴性。少数是CD8+。大约三分之二具有活化的细胞毒性表型。已经报道了FOXP3、CD25和PD-L1的表达。EBV为阴性。
在疑似恶性种植体周围积液的情况下,实践指南建议,获得至少 10-50 ml 的液体,用于涂片、细胞块制备以及免疫组织化学和分子研究。应广泛采集包膜切除标本以评估包膜浸润和边缘,并建议使用肿瘤-淋巴结-转移 (TNM) 分期系统,因为进一步治疗以包膜浸润和切除的完整性为指导。
分子和遗传特征
BIA-ALCL携带单克隆TCR基因重排,可能有助于支持诊断。BIA-ALCL缺乏ALK、DUSP22和TP63的重排。已经报道了各种拷贝数改变,特别是特征性染色体20的丢失,部分病例中具有PDL1改变。BIA-ALCL的基因组改变包括JAK/STAT激活突变(最常见的是STAT3或JAK1,不常见的是STAT5B、SOCS3、SOCS1和PTPN1)和表观遗传修饰物的功能丧失改变,特别是编码H3K4甲基转移酶的KMT2C和KMT2D ,以及CHD2、CREBBP、TET2和DNMT3A。
鉴别诊断
在乳房植入物的情况下发生的大多数积液都是反应性的。CD30可变阳性细胞通常存在于反应性积液中,但通常很少见且缺乏异型性。
罕见的惰性EBV阳性大B细胞淋巴瘤与BI相关,被认为是慢性炎症相关或纤维蛋白相关DLBCL的一种特殊形式。这些病例有大的肿瘤细胞,可能类似于BIA-ALCL,通常表达CD30,但属于B细胞谱系,并且EBV阳性。
乳房植入物患者的全身性ALCL可能累及乳房;因此,分期和临床病史,对于区分BIA-ALCL与全身性 ALCL累及乳房至关重要。BIA-ALCL的浸润形式,在形态上可能与霍奇金淋巴瘤相似,但霍奇金淋巴瘤在结外部位很少见,并且具有不同的谱系和免疫表型。
总结
结外组织中T细胞和NK细胞淋巴瘤及淋巴组织增殖性疾病的诊断,依赖于形态学评估,并辅以免疫表型和分子遗传学检测。病理依据必须与临床特征、年龄和种族以及相关症状相结合,才能提供最终诊断。最近表征的突变,显示出大量重叠改变,但也有不同的变化,一些突变位点,可以用于疾病的诊断。
点击此处查看原文献






















共0条评论