[导读] 作者:王学利
子宫血管周上皮样细胞肿瘤临床病理学特征综述
1 前言
血管周上皮样细胞肿瘤(perivascular epithelioid cell tumor,PEComa) 又称肌黑色素肿瘤(myolomelanocytic tumor)。1991年Pea等观察到一种胞质透明或嗜酸性上皮样肿瘤细胞,电镜观察到胞质内含有前黑色素小体;1992年Bonetti等首先应用双重免疫标记技术证实血管周上皮样细胞(perivascular epithelioid cells,PECs)的概念,1996年Zamboni等进一步提出PEComa这一概念,该肿瘤细胞具有上皮样特征、透明或嗜酸性胞质、血管周分布等形态学特点及表达黑色素免疫标记物,包括肾血管平滑肌脂肪瘤(Angiomyolipoma,AML)、肺透明细胞糖瘤(Clear cell sugar tumor,CCST)、淋巴管平滑肌瘤病(Lymphangioleiomyomatosis,LAM)、镰状韧带/圆韧带透明细胞肌黑色素细胞肿瘤(clear cell myo-melanocytic tumor,CCMMT)及发生其他少见部位有相似组织学和免疫组化特征非特殊类型PEComa(PEComa-NOS)。WHO(2013)软组织和骨肿瘤中PEComa定义为具有血管周上皮样细胞分化的肿瘤,即一种由组织学形态和免疫组化表型上有独特表现的血管周上皮样细胞构成的一组间叶性肿瘤,而WHO(2014)女性生殖系统肿瘤中仍沿用子宫PEComa命名,定义为一种具有血管周上皮样细胞分化的间叶源性肿瘤,肿瘤细胞局灶与血管壁有关,并常表达色素细胞和平滑肌标记物。新版WHO相关内容变化不大。
2 临床特征
临床上非常少见,子宫PEComa一般发生在40-75岁(平均年龄为49岁),目前文献报道最年轻患者仅为9岁,临床上多数患者因腹痛、盆腔肿块或不规则阴道流血等前来就诊,也无明显症状而由体检时发现,相较发生在其它部位PEComa,只有少数患者伴有结节硬化病(Tuberous sclerosis complex,TSC),TSC是一种常染色体显性遗传病,与TSC1及TSC2基因突变有关。目前无影像学诊断特征,易诊断为子宫平滑肌瘤。子宫PEComa大多发生于宫体,罕见于宫颈、外阴、阔韧带等部位。
3 病理学特征
肿瘤多为单发呈结节状,切面呈棕黄色至灰白色,质实且富有弹性,少数表现为胶冻状,可伴有囊性变、出血及坏死,无包膜,常见于宫体肌壁间及浆膜下,多数界限清楚。恶性肿瘤边界不清呈浸润性生长,直径常>5cm,切面常伴出血、囊性变甚至坏死。PEComa在细胞学水平确诊困难,2013年由Stone JL首先报道1例,第2例传统宫颈涂片法诊断于2015年报道。
组织学特点肿瘤由巢状或弥漫排列的上皮样细胞和短束状或巢状排列的梭形细胞构成,有非常明显纤细血管网,部分病例可见透明变性的厚壁血管,肿瘤细胞多围绕血管分布,部分区域可呈放射状分布,肿瘤细胞胞质透明至弱嗜酸性颗粒状,核圆形至卵圆形,有时可见小核仁,核分裂象多少不等,部分可见多核巨细胞和蜘蛛细胞,肿瘤边界清楚或呈“舌状”浸润性生长。Vang等曾将其分为两组:A组肿瘤界限不清呈舌状浸润性生长,类似子宫内膜间质肉瘤,主要由成巢或成片透明细胞组成,肿瘤细胞呈多边形,上皮样,偶见色素;B组肿瘤境界清楚,镜下透明细胞较少,肿瘤细胞质丰富红染。
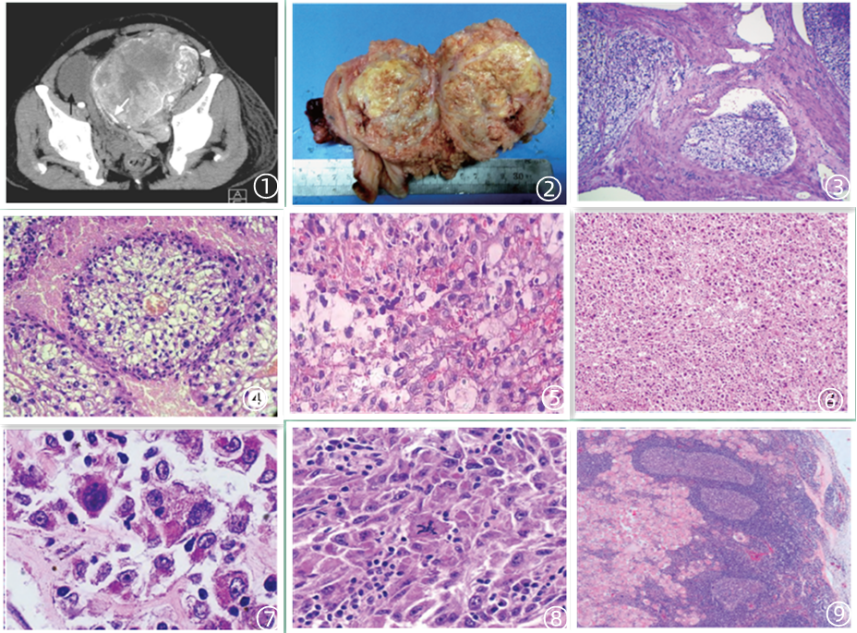
图1 影像学提示子宫占位;图2 肿瘤大体;图3 肿瘤低倍镜下呈巢状分布;图4 肿瘤细胞胞质透明围绕血管生长;图5 肿瘤细胞胞核圆形至卵圆形,核分裂象罕见;图6 恶性肿瘤细胞呈片状浸润性分布;图7 肿瘤细胞异型性明显,核仁明显;图8 肿瘤细胞核分裂象可见;图9 盆腔淋巴结可见恶性肿瘤细胞转移;
免疫学表现为特征性联合表达肌源性和黑色素生成标记物,表达黑色素标记物HMB45(92%)、Melan-A(72%)和MiTF(50%)等,同时表达肌源性标志SMA(80%) 和desmin(36%)等,少数肿瘤还可表达ER/PR、S-100、CD117、TFE3等。肿瘤细胞增殖指数Ki-67对良恶性子宫PEComa诊断及转移有一定价值。Schoolmeester 等发现在PEComa中HMB-45及TFE-3均为弥漫强阳性时,Melan-A通常表现为局灶弱阳性或阴性,而在HMB-45或Melan-A斑片状阳性时,TFE-3通常呈局灶弱阳性或阴性。电镜下瘤细胞胞质内含有黑色素小体或前黑色素小体。
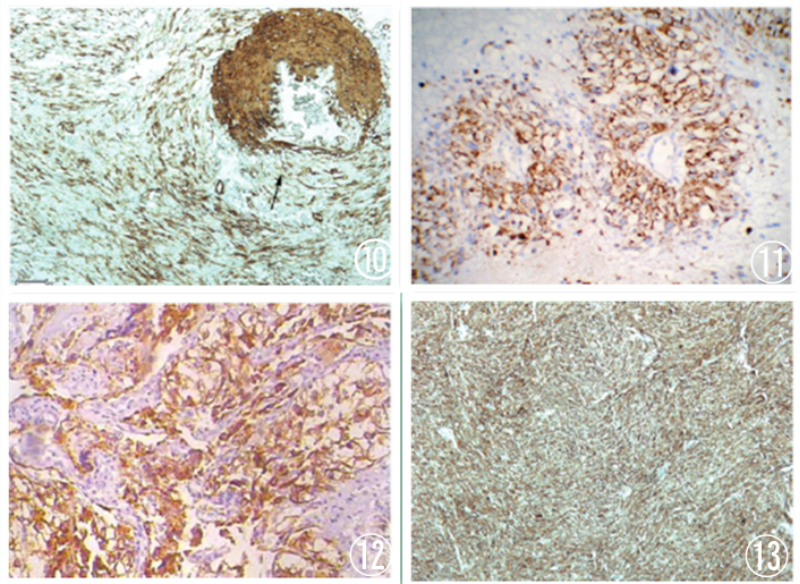
图10 肿瘤细胞SMA弱阳性;图11 肿瘤细胞Desmin弱阳性;图12 肿瘤细胞HMB45弥漫强阳性;图13 肿瘤细胞Melan-A弥漫强阳性;
图片来自于参考文献,如有侵权,请联系删除。
多数散发性和综合征相关性病例有TSC1或TSC2基因失活,导致哺乳动物雷帕霉素靶蛋白(mTOR)旁路活化。部分病例检测到含有TSC2基因19号染色体16p缺失。目前已有从临床病理学、免疫组化和分子特征方面探讨PEComa与转录因子E3(translocation facor E3,TFE3)基因间关系报道,Agaram等研究发现9例PEComa患者伴有TFE3 基因易位融合,且伴有TFE3扩增者侵袭性强,临床预后差。总之PEComa发病机制目前尚不清楚,需要更进一步的研究。
顺便提一下TFE3基因易位融合形成的肿瘤称为TFE3相关性肿瘤,目前国内外对此类肿瘤报道相对少见,主要见于以下几种肿瘤:①腺泡状软组织肉瘤(alveolar soft part sarcoma,ASPS);②Xp11.2易位/TFE3基因融合相关性肾细胞癌;③伴TFE3基因融合的上皮样血管内皮瘤(epithelioid hemangioendothelioma,EH);④伴TFE3基因融合的血管周上皮样细胞肿瘤(perivascular epithelioid cell tumor,PEComa)等。
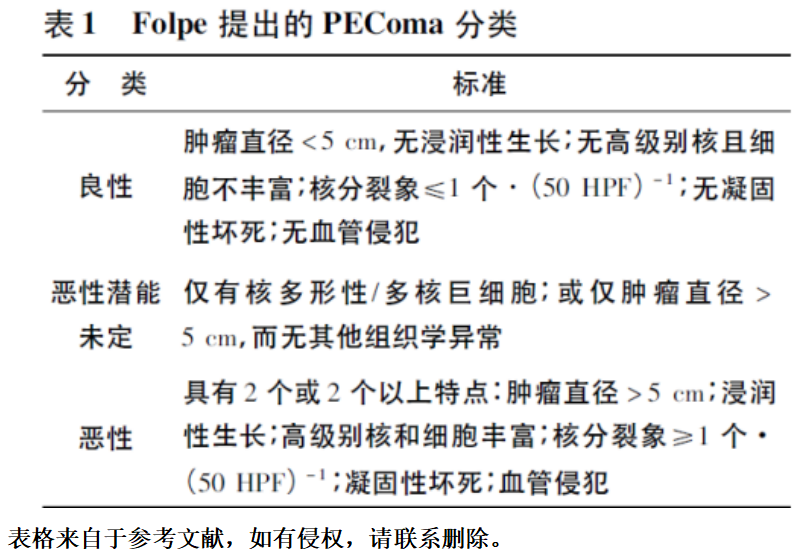
该肿瘤良恶性诊断:WHO将子宫PEComa分为良性PEComa和恶性PEComa两种并有对应ICD-O编码(分别为8714/0和8714/3) ,但因为病例数及随访资料少,目前工作中多采用由Folpe标准。Folpe等于2005年提出PEComa良恶性诊断标准:肿瘤最大直径<5cm,无其他异常组织学表现,则为良性PEComa;肿瘤最大直径>5cm,核分裂象>1/50HPF,肿瘤个数≥2个,浸润性生长,凝固性坏死,血管浸润,此6项中具有2项以上者为恶性PEComa;表现在良恶性之间者为恶性潜能未定,详见表1。同时肿瘤细胞增殖指数Ki67对于判断PEComa转移情况可能有参考意义,一般来说Ki67阳性率>5%就有可能出现肿瘤转移。
4 鉴别诊断
①低级别子宫内膜间质肿瘤(Low-grade endometrial stromal sarcoma,LESS):LESS由一致的子宫内膜间质型的卵圆到短梭形细胞组成伴胞浆稀少,细胞核分裂象极少,泡沫细胞和蜕膜样反应可见,血管结构独特,由类似于正常子宫内膜的螺旋小动脉和薄壁血管组成,有些病例可出现血管周玻璃样变,有些病例可发生局灶平滑肌分化,多数肿瘤边缘呈浸润性,与PEComa舌状浸润肌层时相类似,但免疫组化标记物HMB45阴性,而CD10阳性可鉴别。值得注意的是雌孕激素受体均为阳性,而PEComa仅部分表达。
②恶性黑色素瘤(Malignant melanoma,MM):子宫原发者罕见,多为转移性,免疫组化HMB45阳性但S-100为阳性及肌源性标记物SMA阴性可鉴别。
③转移性肾透明细胞癌:肿瘤可呈腺泡状排列方式,细胞质丰富透明,血窦样毛细血管丰富,免疫组化HMB45及SMA为阴性,上皮源性标记物CK呈阳性。
④上皮样平滑肌瘤(Epithelioid leiomyoma,EL):平滑肌瘤一种特殊类型,以上皮样细胞为主,约1/4为透明细胞呈圆形、梭形或多边形,胞浆呈嗜酸性;局灶可见典型的梭型平滑肌细胞及独有的形态特征。无网络状薄壁血管,HMB45常阴性表现,而SMA全部阳性表达。但文献报道个别HMB45可阳性表达,且肿瘤细胞数量较少。
5 临床治疗与预后
手术一般是子宫PEComa首选治疗方案,手术方式包括单纯肿瘤病灶切除术、全子宫切除术、全子宫+双侧附件切除术等。目前全子宫+双附件切除术是主要手段,对复发转移患者同时使用放疗和化疗并无明确疗效。近年来有学者尝试用mTOR抑制剂(西罗莫司)治疗恶性PEComa,部分病例有临床缓解效果但仍需大量临床研究和随访。
Bleeker 等提出子宫PEComa患者术后复发相关因素包括:瘤体直径≥5cm,核分裂象>1个/50HPF。最常见转移部位为肺,其次为肝、骨、肾,也可见累及卵巢、阴道及结直肠等部位,复发和转移多见于术后3年内,PET-CT在患者后期随访有一定价值。
6 小结
综上所述子宫PEComa是一种罕见且生物学行为暂不能确定的间叶性肿瘤,临床表现无特异性,多为体检时偶然发现。术前诊断困难,病理联合免疫组化为其诊断金标准。手术是最有效的治疗手段,且手术范围多根据术者的临床经验进行选择,对于手术治疗后患者是否进行相关的辅助治疗目前争议较大。因其恶性潜能目前不能确定,因此长期随访是及时发现其复发转移并及时治疗关键。
分析误诊原因分析误诊原因首先在于子宫PEComa并无诊断性临床特征,其次目前发病率极低,缺乏大规模数据统计,辅助检查项目无法为其术前诊断提供参考依据;诊断主要依据病理免疫组化结果,同时需经验丰富的病理科医师进行诊断,故术前及术中确诊的可能性较低。
参考文献:
[1]杨雅洁,刘霞,孙艳花,许美权.子宫血管周上皮样细胞肿瘤的临床病理分析[J].现代医学,2019,47(05):596-599.
[2]刘广涛,张新,高岩.子宫血管周上皮样细胞肿瘤一例并文献复习[J].国际妇产科学杂志,2016,43(01):92-93+122.
[3]戈瑶,贾妍,杨淑莉,崔满华.子宫血管周上皮样细胞肿瘤七例误诊临床分析[J].临床误诊误治,2020,33(01):11-16.
[4]潘地铃,马宏,吴荔香,王成有,陆婷,陈光荣.子宫血管周上皮样细胞肿瘤临床病理分析[J].海峡药学,2016,28(01):79-82.
[5]陈筱莉,蹇顺海,杨慧敏,李丽,王小林.伴TFE3基因易位的子宫颈PEComa 1例并文献复习[J].重庆医学,2020,49(21):3569-3573.
[6]陈娟,冯俊明.TFE3相关性肿瘤的研究进展[J].癌症进展,2019,17(04):395-398.
[7]张晓兴,万择秋,倪冬梅,曹单,张闻雯.恶性子宫血管周上皮样细胞肿瘤1例并文献复习[J].温州医科大学学报,2020,50(01):71-72+80.
[8]牛多山,姚丰,杨杰,夏巧凡,徐美林.子宫恶性血管周上皮样细胞肿瘤2例报道[J].诊断病理学杂志,2021,28(05):398-401.
[9]陆夏良,赵光明,汤颖,展瑞.子宫体血管周上皮样细胞肿瘤3例临床病理分析[J].安徽医学,2022,43(02):204-207.
[10]吴晓彤,王玲,徐志红,张肖肖,韩丽英.子宫血管周上皮样细胞肿瘤1例报道并文献复习[J].现代肿瘤医学,2018,26(01):106-108.
[11]邢澄,陈文静,陈娜,廖燕霞,张江宇.子宫血管周上皮样细胞肿瘤3例临床病理分析[J].临床与实验病理学杂志,2020,36(02):212-214.DOI:10.13315/j. cnki.cjcep.2020.02.021.
















共0条评论