[导读] 译者:薛德彬
四、卵巢杂类肿瘤
01. 9110/0 卵巢网囊腺瘤、腺瘤和腺癌
定义
卵巢网囊腺瘤、腺瘤和腺癌是起源于卵巢网(对应于睾丸网)的良性和恶性肿瘤。
ICD-O编码
9110/0 卵巢网腺瘤
9110/3 卵巢网腺癌
ICD-11编码
2F32.Y XH3SX7 卵巢的其他特指型良性肿瘤&卵巢网腺瘤
2F32.Y XH71B5 卵巢的其他特指型恶性肿瘤&卵巢网腺癌
相关命名
无
亚型
分割性性腺母细胞瘤;未分化性腺组织
部位
通常位于卵巢网附近。
流行病学
很罕见,发病率没有足够数据,囊腺瘤最常见。
病因学
未知
发病机制
未知
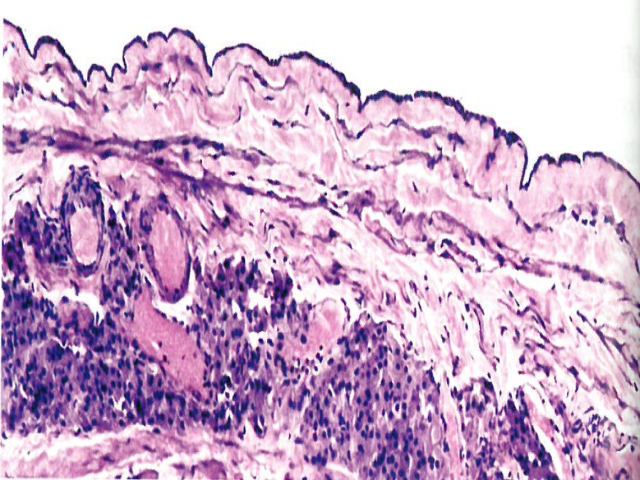
图1.129 卵巢网囊肿。囊内壁显示不规则分布的裂隙,衬覆简单的立方形细胞,无纤毛。注意囊壁有带状Leydig细胞。
临床特征
卵巢网囊肿(囊腺瘤)常见于绝经后妇女,可能表现为盆腔/腹腔不适或因血清睾酮升高而导致的男性化迹象。卵巢网腺瘤通常是更年期或绝经后妇女的偶然发现。据报道,1名51岁妇女发生了卵巢网腺癌,表现为腹胀和不适。
大体检查
卵巢网囊肿通常位于卵巢门部,单侧,但也可能双侧。大小不一(平均9cm),可为单房或多房,壁薄,内壁光滑,内充透明液体。卵巢网腺瘤可为边界清楚的白色海绵状病变,位于卵巢门的中央。唯一的1例卵巢网腺癌形成了巨大的双侧肿块,有实性和囊性区域。
组织病理学
卵巢网囊肿的特征是沿着囊内壁不规则分布的裂隙,衬覆细胞呈扁平至立方形细胞,胞质稀少,嗜酸性至透明(少见),轻微的核复层。细胞异型性和核分裂象罕见或无。囊壁周边,门细胞成带分布。邻近也可能看到卵巢网。卵巢网腺瘤位于卵巢门的中央,边界清楚,由密集的小的、拉长至圆形的、扩张的小管组成,部分管腔内有局灶的、不同复杂程度的乳头。衬覆细胞呈立方形至轻微柱状,有很少的嗜酸性至淡染胞质,通常没有细胞异型性和核分裂象。间质稀少,其中可能含有Leydig/黄素化细胞。报道的卵巢网腺癌具有分支状小管、囊肿、乳头和实性生长,有细胞异型性和核分裂象活性。
细胞学
无临床相关性。
诊断性分子病理学
无临床相关性。
必要标准和理想标准
必要:卵巢网囊腺瘤:位于卵巢门,囊内壁裂隙,无纤毛,囊壁伴或不伴Leydig细胞。卵巢网腺瘤:位于卵巢门,边界清楚,小而密集的小管,无细胞异型性。卵巢网腺癌:位于卵巢门,细胞异型性,核分裂象—这是排除性诊断。
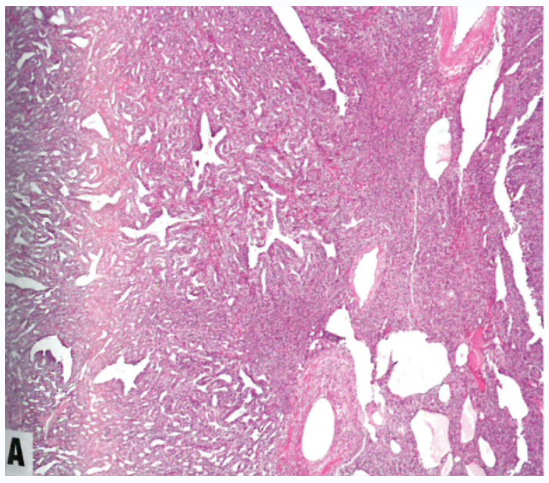
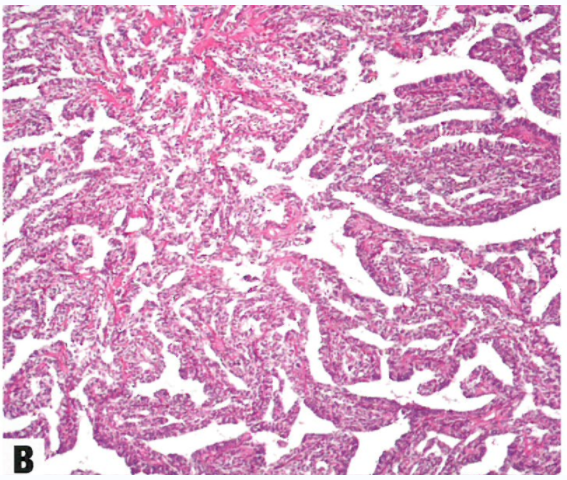
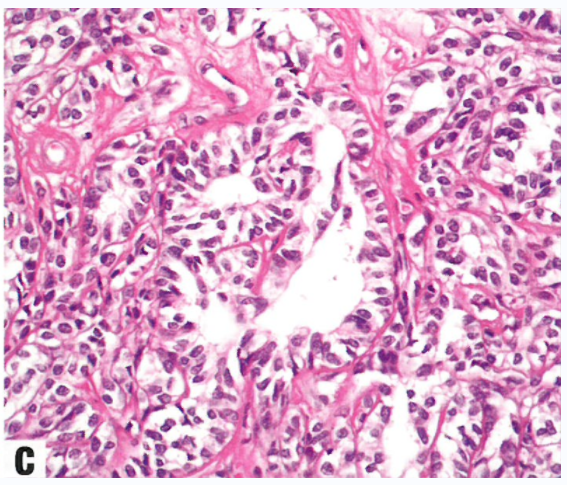
图1.130 卵巢的午菲管肿瘤。A 实性、网状和裂隙模式的混杂。B 网状模式显示拉长、分支的小管,形态学类似卵巢网。C 高分化小管衬覆柱状细胞,较高倍显示无核异型性。
分期
根据国际癌症控制联盟(UICC)TNM分类(见卵巢、输卵管和原发性腹膜TNM分期)和FIGO分期系统进行分期。
预后和预测
卵巢网囊腺瘤和腺瘤是良性,文献中卵巢网腺癌呈侵袭性过程。
02. 9110/1 卵巢的午菲管肿瘤
定义
午菲管肿瘤是一种罕见的独特的上皮性肿瘤,为午菲管起源。
ICD-O编码
9110/1 午菲管肿瘤
ICD-11编码
2C72.Y & XH2WJ5 子宫韧带、子宫旁和子宫附件的其他特指型恶性肿瘤&中肾肿瘤NOS
相关命名
可接受:午菲管附件肿瘤;可能午菲管起源的女性附件肿瘤;午菲管腺瘤;网状型午菲管腺瘤
亚型
无
部位
大多数附件午菲管肿瘤位于阔韧带和输卵管中段。仅20%见于卵巢,位于门部,靠近卵巢网。
流行病学
自1973年首次报道后,文献中共有100多例。
病因学
未知
发病机制
根据肿瘤位于阔韧带、输卵管中段和卵巢门部(邻近卵巢网),这些部位是中肾残迹可能出现的地方,认为肿瘤起源于午菲管。肿瘤似乎起源于午菲系统上区的中肾残迹,不同于宫颈中肾残迹。后者呈EMA、GATA3和PAX8阳性,而前者呈inhibin阳性而PAX8、GATA3和EMA阴性。
几项免疫组化研究证实有限数量的病例呈KIT(CD117)强至弱阳性;然而,KIT基因的外显子9、11、13或17,或PDGFRA的外显子12或外显子18,均无突变。3例NGS突变分析显示遗传学异质性,致病性错义突变位于不同基因,分属不同分子途径:1例为CTNNB1和MET,第2例为PIK3CA,第3例为BRAF和CDKN2A。该肿瘤的发病机制似乎没有特异性分子机制。最近,7例靶向基因组分析谱发现4例生物学意义不明的KMT2D突变和2例STK11移框突变,后2例中,其一为PJ综合征患者,另一伴有ARID1B突变。未发现KRAS/NRAS、DICER1或FOXL2突变。
临床特征
患者年龄范围18-83岁(平均45.4岁)。大多数肿瘤(60%)为偶然发现。少见情况下,患者表现为腹痛、腹腔肿块或阴道出血。
大体检查
大小范围0.8至25cm。大多数肿瘤呈实性,但囊性为主也不少见。切面灰白色,分叶。体积大的病变可能出血或坏死。
组织病理学
常见边界清楚的病变,由四种独特模式按不同比例组成:(1)弥漫或实性模式,特征是梭形细胞群;(2)小管模式,特征是不同大小和形状的小管,部分小管衬覆柱状细胞,核位于基底,受挤压的小管有裂隙样腔隙,衬小的立方形细胞;(3)网状(筛状)模式,特征是拉长、分支状小管形成网,偶见筛状排列;(4)多囊模式,特征是大小不一的囊腔,衬单层立方形细胞。核形态温和,无核仁,核分裂象计数低(<1/mm2,相当于<3/10HPF,每HPF视野直径0.55mm,面积0.24mm2)。偶尔多达3-4/mm2,相当于<7-9/10HPF,每HPF视野直径0.55mm,面积0.24mm2。小管和囊腔内可能见到胶样、PAS阳性分泌物。间质程度不一,从分隔实性小管的由网状纤维组成的纤细网络,显示实性增殖其实是小管模式,到大面积透明变性的胶原,有时伴钙化。
免疫组化,广谱CK(AE1/AE3)和vimentin弥漫阳性,CK7通常局灶阳性。EMA、ER、PR阴性或仅局灶阳性,而AR较弥漫表达。Valretinin、inhibin、FOXL2和WT1通常阳性,尽管为局灶性阳性。CD10显示腔缘显色模式。GATA3在宫颈和输卵管的中肾残迹和宫颈路遥癌显示阳性,而附件午菲管肿瘤通常阴性或仅为局灶弱阳性。PAX8和SF1通常不表达。
附件午菲管肿瘤应区分卵巢中肾样腺癌。有助于诊断中肾样腺癌的特征包括异型性、高核分裂象计数、GATA3和TTF1阳性,以及分子学研究证实KRAS/NRAS突变。也要区分子宫内膜样癌,EMA、ER、PR和PAX阳性以及存在鳞状、粘液性和纤毛化生,符合苗勒起源的癌。性索肿瘤,如Sertoli-Leydig细胞瘤和Sertoli细胞瘤,与午菲管肿瘤的区分,在于前者表达inhibin、FOXL2和WT1。而SF1阴性、无Leydig细胞成分以及无体细胞性DICER1突变,是午菲管肿瘤的特征。
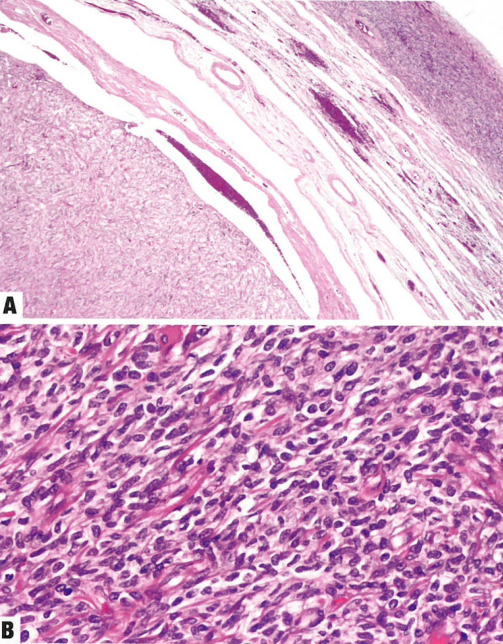
图1.131 卵巢午菲管肿瘤。A 边界清楚的结节,位于卵巢门。B 实性模式,由梭形细胞组成,无核异型性。
细胞学
无临床相关性。
诊断性分子病理学
无临床相关性。
必要标准和理想标准
必要:边界清楚的病变,四种独特成分(弥漫/实性的梭形细胞、小管、网状、多囊)按不同比例组合;核温和,无核仁,核分裂象活性低;小管和囊腔内胶样、PAS阳性分泌物;不同程度的间质,从网状纤维形成纤细的网至大面积透明变性胶原。
分期
恶性肿瘤根据国际癌症控制联盟(UICC)TNM分类(见卵巢、输卵管和原发性腹膜TNM分期)和FIGO分期系统进行分期。
预后和预测
大多数附件午菲管肿瘤为良性,然而,1/5病例伴有较强侵袭性行为,后者约半数表现为复发或残留肿瘤,1/4患者死于疾病。盆腔局部复发,以及肝和肺转移,已有报道。细胞多形性、核分裂象数目增多和肿瘤破裂与恶性行为有关,但轻微异型性和低核分裂象计数的病例也可能复发,提示附件午菲管肿瘤应视为低度恶性潜能。
03. 8452/1 实性假乳头状肿瘤
定义
实性假乳头状肿瘤是起源于卵巢网(对应于睾丸网)的良性和恶性肿瘤。
ICD-O编码
8452/1 实性假乳头状肿瘤
ICD-11编码
2F32.Y XH3FD4 卵巢的其他特指型良性肿瘤&实性假乳头状肿瘤
相关命名
可接受:实性和假乳头状的肿瘤
亚型
无
部位
卵巢
流行病学
罕见,发病率没有足够数据。仅有少数病例报道。
病因学
未知
发病机制
CTNNB1突变见于大多数肿瘤。
临床特征
症状与出现的附件肿块相关。
大体检查
肿瘤大小不一,大多数>5cm(最大25cm),外表面完整。切面呈特征性囊实性;囊性区域质脆易碎,黄色至褐色。可有出血区域。
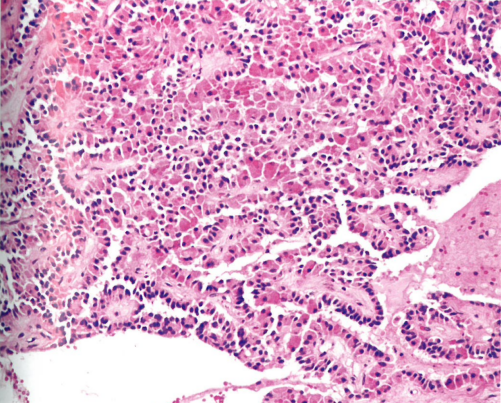
图1.132 实性假乳头状肿瘤。细胞失粘附,形成假乳头状结构,并有很多胞质内透明小球
组织病理学
有三种主要模式:实性(有时外围囊肿)、巢状(由间质分隔,间质可能明显透明变性)和假乳头(退变所致;有时有粘液样至透明变性的轴心)。细胞呈多角形,胞质多变,从嗜酸性至淡染泡沫状,常有核旁空泡。可能见到细胞内和细胞外透明小球。核圆形(有时有核沟),温和。核分裂象活性轻微或无。核在乳头基底部可能呈正好相反的分布。间质可能含有细的分支状血管。肿瘤细胞通常呈vimentin、CD10、CD56、CD99、WT1、β-catenin(核和胞质)、α1-抗胰蛋白酶阳性,cam5.2(有时呈核旁点状阳性)、PR、Syn和KIT(CD117)可能阳性。CgA、calretinin和inhibin阴性。膜E-cadherin表达缺失。
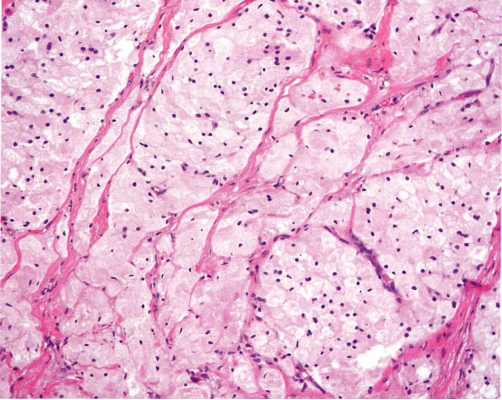
图1.133 实性假乳头状肿瘤。细胞可有丰富的泡沫状胞质。
细胞学
无临床相关性。
诊断性分子病理学
无临床相关性。
必要标准和理想标准
必要:实性和假乳头模式的混杂。
理想:嗜酸性透明小球。
分期
无临床相关性。
预后和预测
肿瘤局限于卵巢且为良性,有罕见例外。
04. 卵巢的小细胞癌,高血钙型
定义
卵巢网囊腺瘤、腺瘤和腺癌是起源于卵巢网(对应于睾丸网)的良性和恶性肿瘤。
ICD-O编码
8044/3 小细胞癌,高血钙型
ICD-11编码
2C73.0Y XH8ZR8 卵巢的其他特指型癌&小细胞癌,高血钙型
相关命名
无
亚型
小细胞癌,大细胞变异型
部位
卵巢。
流行病学
罕见,在卵巢肿瘤中占比<1%。几乎总是发生于育龄期妇女和儿童(中位年龄25岁)。家族性病例(罕见)发病更早。
病因学
未知
发病机制
几乎所有肿瘤检测到SMARCA4体细胞性突变或胚系突变。
临床特征
大多数患者表现为盆腔肿块相关症状。2/3病例有副肿瘤综合征。
大体检查
通常体积大,平均15cm(范围6-26cm)。实性,肉样,褐色至白色、灰色,常有出血、坏死和囊性变。家族性病例更常见双侧性。
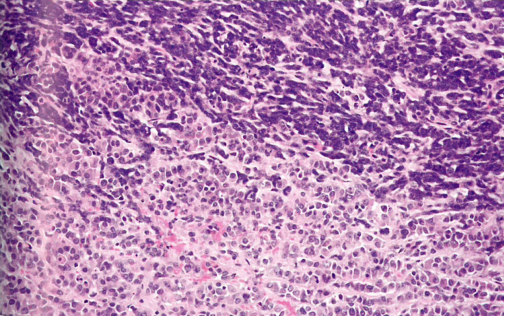
图1.134 卵巢的小细胞癌,高血钙型。小细胞成分呈巢状生长和局灶梭形细胞形态,与大细胞并列。大细胞有丰富的嗜酸性胞质,部分核偏位。
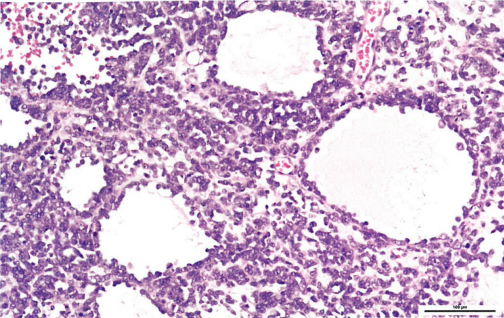
图1.135 卵巢的小细胞癌,高血钙型。常有滤泡样腔隙。
组织病理学
肿瘤细胞通常成片、成巢、条索状和小梁状生长,常有很少的分隔性间质。常见散在的滤泡样腔隙伴嗜酸性或嗜碱性分泌物。细胞核呈单一的圆形、卵圆形或偶尔梭形,空泡状染色质,小核仁,胞质稀少,核分裂象活跃。半数肿瘤出现大细胞(比例不一),如果大细胞为主(罕见),则称为“小细胞癌,大细胞变异型“。大细胞核偏位,有明显核仁和丰富的嗜酸性胞质,有时呈现横纹肌样外观。约15%的肿瘤含有很少的粘液成分,后者通常由良性腺体或囊肿组成,罕见由恶性成分组成,包括印戒细胞样细胞。
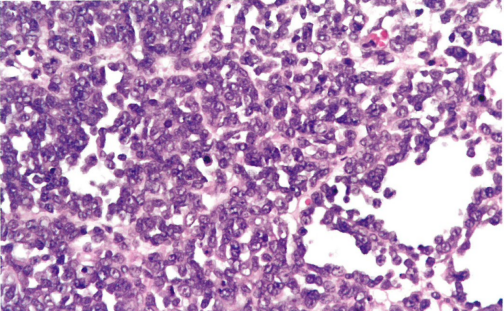
图1.136 卵巢的小细胞癌,高血钙型。肿瘤主要为单一形态的小细胞,胞质稀少,松散粘附。

图1.137 卵巢的小细胞癌,高血钙型。免疫组化SMARCA4阴性。
免疫组化,几乎所有肿瘤无SMARCA4(和SMARCA2),且弥漫性表达WT1、p53、p16,不同程度地表达claudin-4、SALL4、CK、所有神经内分泌标记物和PTHrP。Inhibin和TTF1阴性。
细胞学
无临床相关性。
诊断性分子病理学
无临床相关性。
必要标准和理想标准
必要:未分化肿瘤;单一形态的小细胞和滤泡样腔隙为主,伴或不伴大细胞成分;不伴表面上皮性癌
理想:SMARCA4缺失。
分期
根据国际癌症控制联盟(UICC)TNM分类(见卵巢、输卵管和原发性腹膜TNM分期)和FIGO分期系统进行分期。
预后和预测
尽管手术和强化疗,预后仍差。分期是最重要的预后因素,IA期肿瘤患者仅1/3术后无病存活。有利预后因素包括年龄>30岁、血钙水平正常、肿瘤<10cm且无大细胞。
05. 8960/3 Wilms瘤
定义
卵巢的Wilms瘤是由胚芽、上皮性和间充质成分按不同比例混合而成的肿瘤,就像肾的Wilms瘤。
ICD-O编码
8960/3 Wilms瘤
ICD-11编码
2C73.Y XH5QN3 卵巢的其他特指型恶性肿瘤&肾母细胞瘤NOS
相关命名
无
亚型
无
部位
卵巢
流行病学
有3例报道,年龄分别为16岁、36岁和未知年龄。
病因学
未知
发病机制
卵巢的纯Wilms瘤可能起源于持续存在的中肾导管残迹或起源于具有持续胚胎发生潜能的细胞;畸胎瘤样Wilms瘤(Wilms瘤和畸胎瘤的组合,其中异源性成分超过50%)似乎起源于错位的全能肾源性胚芽。
临床特征
通常表现为腹痛/肿块或闭经。罕见病例因深部静脉血栓而腓肠肌疼痛,或发热。
大体检查
纯Wilms瘤单侧发生,囊实性肿块,往往>10cm;畸胎瘤样Wilms瘤可能是畸胎瘤的一小部分。
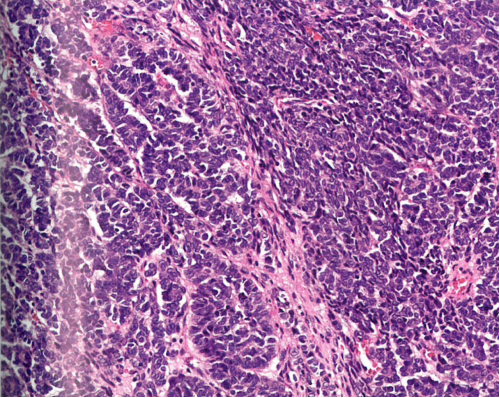
图1.138 卵巢的Wilms瘤。上皮和p胚芽成分。
组织病理学
Wilms瘤通常显示组合的胚芽、上皮性和间充质成分;然而,有些肿瘤仅显示一种或两种成分。胚芽成分由密集的小-中等细胞组成,胞质稀少,核染色质粗糙,大量核分裂象和凋亡小体,排列成不同模式(实性、蜿蜒、结节或基底样)。上皮成分包括菊形团样和肾小球样结构、不同分化程度的小管和囊腔或乳头状结构衬覆柱状或立方形细胞伴深染核。间充质成分包括梭形细胞、横纹肌或平滑肌、脂肪、软骨或骨。免疫组化,胚芽和上皮成分表达WT1、PAX8、cam5.2和CD56,上皮细胞表达CK。胚芽细胞可能表达desmin但不表达myogenin或MyoD1。Wilms瘤不表达Syn、CgA、calretinin和inhibin。
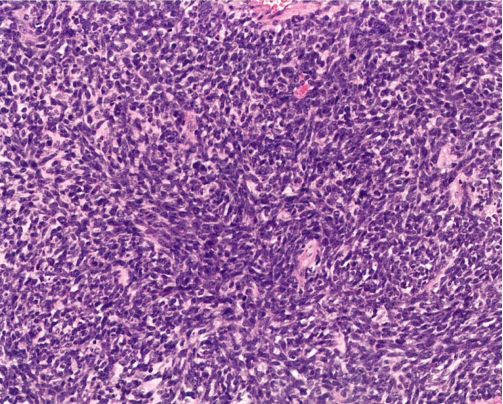
图1.139 卵巢的Wilms瘤。梭形细胞成分。
细胞学
无临床相关性。
诊断性分子病理学
无临床相关性。
必要标准和理想标准
必要:胚芽、上皮和间充质成分按不同比例混合的卵巢肿瘤,无肾肿块。
分期
美国Wilms肿瘤研究会认为所有肾外Wilms瘤均为至少II期;因此,所有病例均需化疗。
预后和预测
经验有限;然而据报道,随访范围3-108月,未记录死于疾病,即使进展期疾病患者或术后短期复发患者也是如此。


























共0条评论