[导读] 作者:王学利
1、引言
子宫内膜息肉样腺肌瘤(polypoid adenomyoma,PA)亦称腺肌瘤样息肉,是一种非常罕见息肉样子宫肿瘤,占子宫内膜息肉1.3%-8.0%,是一种上皮和间叶混合性良性肿瘤,属于混合性苗勒管肿瘤,根据腺体有无典型性增生可分为典型性子宫内膜息肉样腺肌瘤(typical polypoid adenomyoma,TPA)和非典型性息肉样腺肌瘤(atypical polypoid adenomyoma,APA)。TPA外被腺上皮,中间是平滑肌组织而非单纯纤维结缔组织,腺体无非典型性,因发病率低,临床缺乏大样本研究报道。TPA病灶腺体也可轻度增生,当腺体出现不典型性增生时则诊断为APA,有一定恶变率,因此目前临床关注较多。
1981年Mazur最先描述了APA,随后Longacre等于1996年正式将这种由子宫内膜不典型增生的腺体及平滑肌间质组成肿瘤命名为APA,最初被认为“区别于癌的良性疾病”,但近年来研究报道APA同时合并子宫内膜复杂型不典型增生(complex atypical endometrial hyperplasia,CAH)病例,而CAH为Ⅰ型子宫内膜癌癌前病变,且目前已有报道显示APA进展为子宫内膜癌及合并子宫内膜癌情况。APA应被视为“区别于良性疾病的癌前病变”。2014版WHO女性生殖器官肿瘤分类将其归为混合性上皮-间叶肿瘤,定义为由纤维肌性间质及其内腺体构成的肿瘤,这些腺体具有细胞学非典型性且结构复杂。
2、 发病机制
APA致病原因尚不明确,目前普遍认为APA发生与雌激素水平升高相关, 部分患者合并子宫肌瘤、肥胖、多囊卵巢综合症,认为其肌性间质是由子宫内膜间质前体细胞在长期的雌激素刺激下由具有平滑肌细胞分化能力的子宫内膜间质前体分化而来。McCluggage等研究发现APA基质细胞通常表现出SATB2阳性,而SATB2阳性多出现在与子宫内膜增生性病变密切相关鳞状细胞桑葚体。因此APA可能与子宫内膜癌有相同的发病机制,如MLH-1启动子超甲基化、微卫星不稳定等。也有学者统计APA患病部位概率最高的是子宫后壁及宫底,其次是子宫前壁,因而推论宫腔操作导致子宫内膜损伤可能会诱导发病。
有研究证实绝经后妇女BMI与其机体内长期雌激素水平呈正相关,绝经后妇女体重的增加及体脂分布的异常可能导致体内合成相对较高水平的雌激素,临床APA多见于绝经前女性,主原因可能为:①围绝经期雌激素水平下降影响下丘脑摄食中枢及神经元,引起食欲增加、代谢率降低、内脏器官脂肪堆积,易导致雌激素合成增加及糖脂代谢异常;②卵巢功能减退、肥胖导致胰岛素抵抗等因素均可引起排卵障碍,使患者子宫内膜长期受单一雌激素作用。前者对围绝经期患者均可产生影响,而后者主要影响绝经前患者,如果绝经前两项因素同时存在,则APA发生概率可能随之增加。
3、 临床表现及诊断
文献报道TPA通常发病于绝经前女性,但亦可发病于绝经后女性,发病年龄为17-73岁。典型临床表现为异常阴道出血及不孕症,也可表现为阴道分泌物增多、盆腔疼痛等。宫腔镜下大体形态与黏膜下子宫肌瘤相似,故易误诊。见单发或多发的息肉突向宫腔,基底较窄,表面被覆的子宫内膜呈黄白色或灰白色污秽,血运丰富,并可见异型血管,提示有恶性可能。
在B超下表现为边界清晰的宫腔内占位,通常单发位于子宫下段,有时占位内可见多个外形规则的小无回声区,这是腺体增生、腺腔扩大超声表现,这一特征对绝经前患者诊断TPA有一定帮助,而绝经后腺腔扩大经常出现,假阳性率较高。由此可见PA可无典型临床症状,对围绝经期及绝经期妇女,尤其是体重异常的人群,应提倡定期进行妇科检查,提高TPA检出率。胡香英等按超声特征将其归为4类:致密网络状高或稍高回声型;散在大小不等小无回声区型;小无回声区较均匀分布低回声型;无小无回声区型占位回声高或稍高。Nakai等分析APA在磁共振成像中的特点:其在T1加权像呈等信号,T2加权像呈高信号、类似于肌纤维组织强度,增强后呈不规则强化,程度常高于子宫内膜癌,较大息肉中心内可见囊变,常无子宫肌层侵及。磁共振在鉴别APA与肌侵子宫内膜癌时仍有一定困难,需结合患者一般临床情况协助诊断。
4、病理形态学特征
典型细胞学改变有助于APA诊断。Horita等报道1例患者在术前行细胞学检查时发现不典型柱状细胞伴有增生梭形间质细胞,术后证实为APA合并复杂子宫内膜非典型增生。大体上常见于子宫底及子宫下段,也可见于宫颈,肿瘤多呈息肉样突向宫腔,体积较大者似粘膜下肌瘤,切面灰白色质韧,部分质稍硬。3种生长方式:有蒂类似于息肉;广基无蒂类似于粘膜下平滑肌瘤;生长在肌壁间多与肌层及周围组织分界清楚。
APA镜下有明显特征性改变,低倍镜下显示息肉样背景,肿瘤由平滑肌、纤维组织间质及密集子宫内膜腺体组成,典型APA纤维肌性间质明显,腺体周围被呈树枝状分布的混合平滑肌和纤维间质包围,分隔成小叶状或丛状分布,缺乏子宫内膜样间质,间质中核分裂象少见。子宫内膜腺体增生紊乱,结构复杂并存在一定非典型性,局灶可出现共壁、“背靠背”现象,细胞轻中度异型,核仁可见,类似高分化子宫内膜腺癌表现;多伴见桑椹状鳞状上皮化生呈多灶鳞化伴完全角化。间质厚壁血管增生偶伴中心坏死。1996年Longacre等提出当含分枝出芽等复杂结构腺体成份≥30%属高度结构异型指数APA(a high architecture index,APA-H),<30%属低度结构异型指数APA(alow architecture index,APA-L)。APA-H易复发,反复发作有恶变风险,若有子宫浅表肌层浸润倾向时,则属低度恶性APA,部分可发展为子宫内膜癌。由于病理实践中不好把握及会给临床医生带来疑惑,该名称没有得到广泛运用。目前有学者建议将APA中存在典型高分化癌区域病变诊断为APA内癌变,有利于临床医师制定更佳诊疗方案。
5、 鉴别诊断
①子宫内膜腺癌:子宫内膜腺癌多见于绝经后女性,病灶多位于子宫上段,腺体密集,结构复杂,可呈筛状实性,腺体异型性更明显,核分裂象多见,周围有促纤维性反应,缺乏APA特有增生性平滑肌细胞,而APA中平滑肌为内膜间质的化生形成,存在特征性树枝状结构,通常见于年轻女性,腺体较稀疏,细胞异型性轻中度,可见鳞化,免疫组化方面CD10可帮助鉴别。
②子宫内膜息肉:低倍镜下息肉间质中常出现成簇的厚壁血管,间质呈纤维性,无平滑肌成分,多数CD10阳性表达;APA腺体结构复杂且细胞异型性明显,间质常见平滑肌成分,CD10阴性。
③腺肉瘤或癌肉瘤:腺肉瘤间质可出现平滑肌肉瘤分化,间质可聚集于腺体周围,核分裂像>2个/10HP,而APA平滑肌间质缺乏异型性,核分裂象<2个/10HP。癌肉瘤腺体和间质成分都呈恶性表现。
6、治疗及预后
对于有生育要求者,保守治疗手术方法包括诊刮、经阴道病灶切除或经宫腔镜病灶完整切除,但术后较易复发。手术是目前治疗APA有效方法。手术应结合患者年龄、症状、是否有生育要求及腺体异型性等进行个体化处理。早在2005年Mazzon等提出宫腔镜三步切除APA病灶,即第1步完整切除APA病灶,第2步切除病灶周围部分内膜,第3步切除病灶处浅肌层组织。近年来有学者在此基础上提出第4步,即对其他部位子宫内膜做多点活检,全面评估宫腔内膜情况。故对APA患者推荐采用宫腔镜进行诊断及治疗。“四步诊治法”不仅完整地切除病变,且有效避免根蒂部残留而导致疾病复发弊端。同时这种方法全面评价子宫肌层有无浸润及是否同时合并子宫内膜病变,对进一步手术治疗有指导作用。如患者无生育要求,或存在年龄大和细胞异型性高等高危因素,有发展为癌风险时可行子宫切除术。
根据“四步诊治法”确定是否需进一步药物辅助治疗,尤其对不孕症患者治疗具有重要指导意义。对于单纯药物保守治疗,目前缺少相应使用规范,多用于术后辅助治疗。对于有生育需求APA患者术后给予孕激素辅助治疗具有重要作用:一方面孕激素可以拮抗雌激素,在一定程度上能抑制子宫内膜增生,具有转化内膜作用;另一方面孕激素在一定程度上可改善APA患者内分泌水平,有助于提高妊娠率。近年应用GnRHa治疗逐渐增多,其作用机制为与GnRH特异性受体结合,抑制垂体,使黄体生成激素(LH)及卵泡刺激素(FSH)分泌减少,降低雌二醇至绝经水平,直接抑制子宫内膜增生。
APA具有局部侵袭性,但临床病程进展缓慢,如治疗不彻底,病变可持续或复发。Heatley对136例APA进行系统回顾,APA复发率为 30.1%,合并存在或发展为子宫内膜癌概率为8.8%,且近年来陆续报道APA进展为子宫内膜癌或伴发子宫内膜癌病例,APA及子宫内膜不典型增生和子宫内膜癌的发生可能是同一谱系,而APA与复杂型不典型增生均可进展为癌或与癌的发生密切相关。王昀等报道14例APA患者中4例APA内癌变,并建议如果病变直径超过4cm,多发息肉,组织形态学出现大量腺体融合、筛状结构、坏死及显著异型性,结合超声检查显示血流信号丰富,应警惕癌变可能性。
7、小结
总之APA可无典型临床症状,多发生于围绝经期及绝经后女性,尤其是超重或肥胖患者。TPA诊断需依据病理,临床预后良好。有研究报道 APA 患者在术后患子宫内膜样腺癌或与其相关卵巢侵袭性子宫内膜样癌,有恶变可能,目前提倡宫腔镜“4步法”彻底切除病灶,依据患者年龄、是否有生育要求及腺上皮非典型程度决定保守治疗或切除子宫治疗,对保守治疗的患者进行长期密切随访是非常必要的。
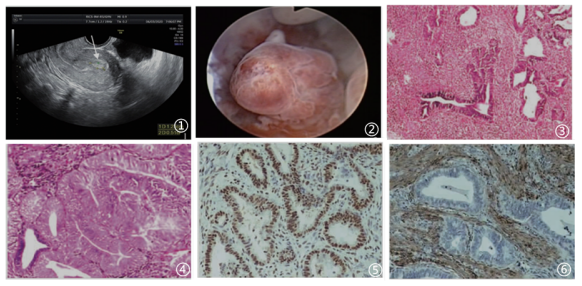
图1影像学示宫腔占位;图2宫腔镜大体;图3低倍镜下示息肉样背景,肿瘤由平滑肌、纤维组织间质及密集子宫内膜腺体组成;图4子宫内膜腺体增生,结构复杂并非典型性,局灶可出现共壁,细胞轻中度异型,类似高分化子宫内膜腺癌表现;图5腺体ER弥漫强阳性;图6间质SMA阳性;以上图片来自于参考文献,如有侵权,请联系删除;
参考文献:
[1]任健,吴霞.子宫内膜非典型性息肉样腺肌瘤诊治进展[J].临床军医杂志, 2018,46(03):373-375.DOI:10.16680/j.1671-3826.2018.03.43.
[2]董珍珠,林婷婷,许淑霞,许沐,刘达宾,孙蓬明.子宫非典型息肉样腺肌瘤九例临床分析及文献复习[J].国际生殖健康/计划生育杂志,2017,36(04):295-299 +353-354.
[3]任健,吴霞,张立芳.典型性子宫内膜息肉样腺肌瘤27例临床分析[J].中国医学创新,2018,15(15):123-126.
[4]张丽娟,吴霞,盛洁.宫颈非典型息肉样腺肌瘤10例临床分析[J].中国医刊, 2020,55(07):734-736.
[5]任健,周琦,张丽娟,李婷.宫腔镜治疗子宫内膜息肉样腺肌瘤48例临床分析[J].国际妇产科学杂志,2020,47(06):637-641.
[6]王欣,金佟,郭银树.子宫非典型息肉样腺肌瘤49例临床分析[J].中国微创外科杂志,2020,20(10):887-890.
[7]王宝,金凤斌.子宫非典型性息肉样腺肌瘤的临床病理分析[J].中国医药指南,2017,15(28):79.DOI:10.15912/j.cnki.gocm.2017.28.062.
[8]陆晓青,王诚,刘素贞.子宫内膜非典型息肉样腺肌瘤6例临床病理分析[J].浙江实用医学,2018,23(01):47-49.DOI:10. 16794/j.cnki.cn33-1207 /r.2018. 01.018.
[9]周巧云,刘玉环,夏恩兰.子宫内膜非典型息肉样腺肌瘤24例临床分析[J].国际妇产科学杂志,2017,44(02):167-170+242.
[10]李文敏.子宫内膜非典型息肉样腺肌瘤的诊治进展[J].中国城乡企业卫生,2016,31(04):25-27.DOI:10.16286/j.1003-5052.2016.04.009.
[11]魏宝宝,刘辉.子宫内膜非典型性息肉样腺肌瘤的临床分析[J].中华妇幼临床医学杂志(电子版),2020,16(04):417-422.














共0条评论