[导读] 译者:慧海拾穗
历史背景
副神经节的概念最早是由Alfred Kohn在1903年提出的。Bertholdus Werner在1857年的早期研究表明,在铬酸盐的存在下[2],肾上腺髓质呈现棕色,但后来Kohn创造了“嗜铬反应”和“嗜铬细胞”的术语来指代这些反应细胞。利用嗜铬反应,Kohn在腹部和腹膜后的肾上腺外位置发现了与交感神经和神经节相关的类似组织,他证实了颈动脉体中的细胞也表现出嗜铬反应,这是Stilling之前报道的[2,3]。Kohn的统一假设是,这些不同的细胞类似于神经节,来自交感神经节前体,受交感神经轴突支配,类似神经元但不是神经元,因此称为“副神经节”[1]。
随后的研究对Kohn的建议提出了异议,因为其他研究人员发现,颈动脉体通常不能证明嗜铬反应,而且它是受舌咽神经支配的。
随着时间的推移,副神经节被分为嗜铬类和非嗜铬类,部分为混合型。当发现颈动脉小体是化学受体时,命名变得更加混乱,提出的术语化学感受器“chemodecton”(来自希腊语dechesthai,接收)和“chemodectoma”表示副交感神经副神经节及其肿瘤。
现代医学在很大程度上恢复了科恩最初的概念,认识到与交感神经和副交感神经有关的副神经节与控制其功能的许多刺激和化学途径之间的区别,并没有以前认为的那么明显。
特别是,检测氧浓度变化的能力是成年人颈动脉体的一项主要功能,它是由腹部副神经节和胎儿时期发育的肾上腺嗜铬细胞完成的[4,5]。
这方面的区别是基于解剖背景的。颈动脉体分泌儿茶酚胺的细胞在向中枢神经系统传递信息的回路中发挥作用,而腹副神经节在神经回路建立之前直接将儿茶酚胺释放到循环中。
第一例嗜铬细胞瘤患者的报告,包括临床表现和双侧肾上腺肿瘤的大体描述,可能是由Charles Sugrue在1800年报道的[6]。
第一份组织学报告是Felix Fraenkel的一篇论文,他描述了一位名叫Minna Roll的年轻女性双侧肾上腺肿瘤的典型体征和症状。她突然死亡后,鲁道夫·迈尔教授进行了尸检,马克斯·肖特利乌斯教授进行了组织学检查。他描述了肾上腺肿瘤在接触含铬酸盐的穆勒固定剂后呈棕色外观。Frankel假设肿瘤分泌一种化学物质,导致患者高血压和心肌梗死[7]。
同样具有历史意义的是圣母玛丽·约阿希姆的案例,她是一位天主教修女,1927年在梅奥诊所成功切除了第一例嗜铬细胞瘤。这种疾病可能与历史有关,因为它可能是艾森豪威尔总统血压不稳定的原因,也可能是导致麦科伊家族不和的原因,导致了30年的哈特菲尔德-麦科伊家族不和。
解剖学和胚胎学
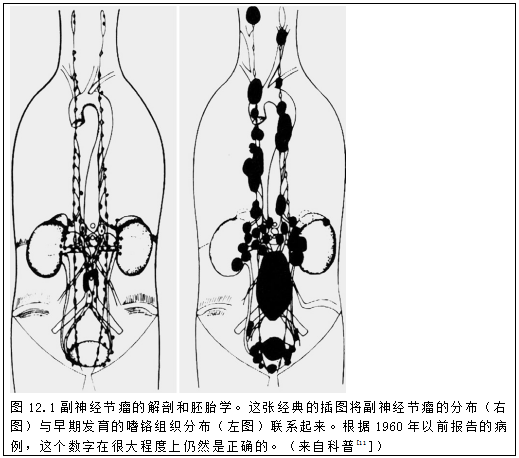
Rex教授在他1965年的经典著作《嗜铬细胞的自然史》中形象地记录了正常副神经节在发育过程中的分布与成年期副神经节瘤之间的关系,他的经典图表[11]基本上是正确的(图12.1)。
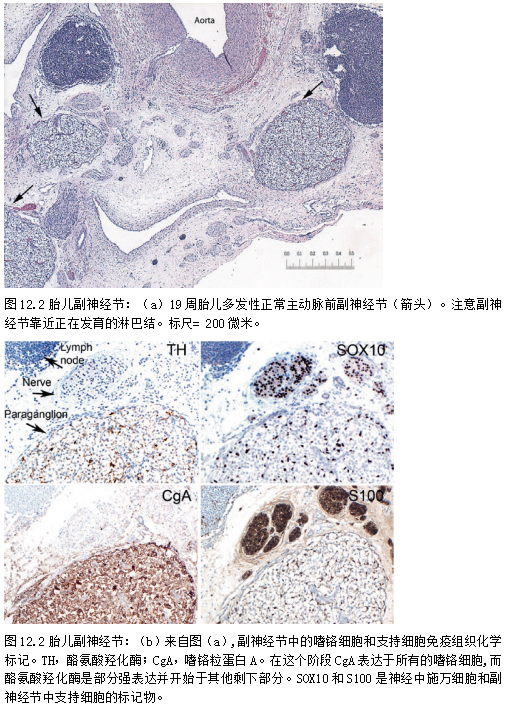
在胎儿发育期间,副神经节与几乎所有交感神经系统神经节的近轴神经纤维有关(图12.2),主要与头颈部的迷走神经和舌咽神经分支有关。交感副神经节多见于主动脉前神经丛附近[11]。这些正常副神经节大多数要么错综复杂,要么不容易在成人中发现,因为它们很微小。然而,副神经节瘤发生在正常副神经节发育期间发现的任何地方,并且最常见的是在图上分布最密集的地区。它们可能出现在整个躯干以及头颈部的许多部位,最常见的是肠系膜下上动脉和腹腔丛附近[12-16]。
最大的单个胎儿副神经节是位于肠系膜下动脉起源处的Zuckerkandl器官,也是唯一一个不是显微镜下才可见的。这个结构最初是由Emil Zuckerkandl发现的,现在以他的名字命名,最初被认为是一个不寻常的淋巴结[17]。这种早期的错误识别引发了一个当前的临床问题:由于腹部和盆腔副神经节与淋巴结在椎前和椎旁的位置相同,时至今日,副神经节瘤在影像学上经常被误认为淋巴结病变。
虽然有报道称副神经节瘤发生在四肢[12,18],但副神经节通常不发生于四肢。这种肿瘤的组织发生仍然是个谜,有些报告可能是基于不正确的诊断。
副神经节神经内分泌细胞来源于神经前体,尽管最近的研究表明这些前体的起源比以前认为的要复杂得多。虽然它们的血统最终可以追溯到神经嵴,但这在很大程度上是通过间接途径实现的。
根据目前的概念,首先在背根神经节中形成的晚期神经嵴祖细胞沿着感觉轴突移动,与从脊髓产生的节前交感轴突连接,然后在这些轴突的引导下到达发育中的副神经节[19-21]。副神经节的神经内分泌细胞均表达突触素和嗜铬粒蛋白等神经内分泌标志物[14,22],其主要激素产物为儿茶酚胺。与其他上皮性神经内分泌细胞不同,它们不表达角蛋白。
一般来说,发生在肾上腺髓质的这些细胞的肿瘤被称为“嗜铬细胞瘤”(来自希腊语phaios,暗色+色度,颜色),指的是在嗜铬反应中引起的颜色变化,而功能相似的肾上腺外肿瘤被归类为副神经节瘤[23]。
这种主观区分最初是1950年《美军病理研究所肿瘤病理学图谱:肾上腺肿瘤》提出,对众说纷纭的命名体系[24]进行了排序。虽然对肾上腺髓质的划分命名是否正确尚存争议,但普遍认为肾上腺髓质具有明显的生物学特征。这包括晚期发育(图12.2)和专门生产肾上腺素的能力。它也是MEN2综合征患者嗜铬细胞瘤/副神经节瘤发生的几乎唯一部位。

流行病学
嗜铬细胞瘤和副神经节瘤每年2~8例/百万人;它们在高血压患者中更常见,约占0.1%的患者[26]。大约3%的肿瘤发生在头颈部的[27],但这在所有系列的[28]中并没有被证实;他们被认为代表不到1%的头颈部癌症[27]。
值得注意的是,虽然术语“副交感神经副神经节瘤”和“头颈部副神经节瘤”经常互换使用,但这种用法并不严格正确。副神经节瘤可与颈交感神经链和颈上神经节有关。睫状神经节被认为是罕见的眶副神经节瘤[29]的起源,它混合了交感神经和运动成分。
副交感神经副神经节起源于舌咽神经和迷走神经。超过一半的头颈部副神经节瘤是颈动脉体瘤[27],发生在颈动脉分叉的上方[12,14,15,30];生活在高海拔地区(海拔2000米以上)的人群颈动脉体瘤的发病率较高。
第二常见部位是中耳,起源于多发性颈静脉和鼓室副神经节,称为“颈静脉球囊”和“鼓室球囊”[12,22]。其他部位包括喉部和沿迷走神经的路径,因为迷走神经穿过锁骨下通道,在大血管基底附近或在肺内和心隔处支配肺和心脏。
交感神经副神经节瘤最好发于腹部。最常见的部位是在肾上腺髓质,这是最大的交感副神经节。其次是Zuckerkandl器官附近,它本身在生命的最初几年就会渐次复杂。
发生在不寻常位置的副神经节瘤经常被误诊[12]。它们可以发生在鞍区类似垂体神经内分泌肿瘤,在鼻窦被误诊为嗅觉神经母细胞瘤,在甲状腺和甲状旁腺,它们可以类似髓样癌或甲状旁腺肿瘤。
它们发生在纵隔、心脏和肺部,在那里它们经常被误诊为转移性神经内分泌肿瘤。相反,在喉部,原发性上皮性神经内分泌肿瘤被误诊为副神经节瘤,这可能是该位置[32]副神经节瘤异常侵袭行为的原因。胆囊、肝脏、肠道、胰腺和肠系膜的罕见病例也常被误认为原发性或转移性上皮性神经内分泌肿瘤。
肿瘤分类与形态学
副神经节瘤的临床特征通常是由于儿茶酚胺过量,当他们是交感神经型[33];副交感神经副神经节瘤被认为是临床无功能;然而,它们可能分泌多巴胺或其代谢物甲氧基酪胺[34,35]。
儿茶酚胺过量可导致阵发性心动过速、高血压、面色苍白、头痛和焦虑。一个不寻常的表现是由膀胱副神经节瘤引起的排尿引起的发作。副神经节瘤也可表现为肿块。
在这种情况下,不建议进行活检,因为活检可能引发高血压危象,从而导致中风和/或死亡。建议任何患有肾上腺肿块或疑似副神经节瘤的肿块病变的患者,应通过测量尿和血浆中肾上腺素和使用功能配体(如123I-MIBG或标记的生长抑素类似物[36])进行筛查。
嗜铬细胞瘤大小和重量各不相同,具有独特的红褐色或出血性外观(图12.3)。大的肿瘤压迫肾上腺皮质,使肾上腺皮质变薄。这些肿瘤很少呈亮黄色,类似于皮质腺瘤;这些不寻常的肿瘤在VHL综合征患者中有报道,他们的副神经节瘤[37]有脂质变性。副神经节瘤从颈鼓室区域的小肿瘤到腹膜后和膀胱的大肿块不等(图12.4)。

镜下,嗜铬细胞瘤和副神经节瘤由纤维血管间质中的细胞巢组成,称为“细胞球(Zellballen)”(图12.5)。
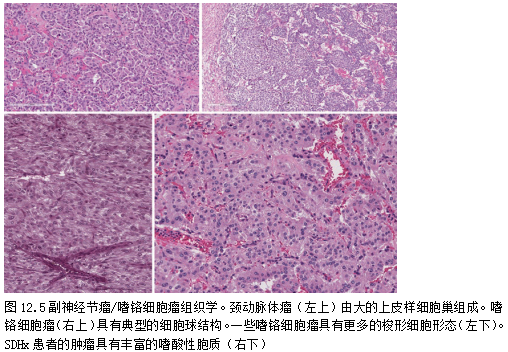
巢内肿瘤细胞种类不同,从大的多角形神经样细胞,丰富的颗粒状嗜碱性细胞质,到圆形嗜酸性、嫌色或嗜双色上皮样细胞。少数情况下为拉长和纺锤形。
肿瘤细胞核呈圆形,核仁明显;一些肿瘤具有核异型性,包括奇异的大核和/或多核细胞。核分裂通常不明显,也不常发现坏死。据报道,一些肿瘤[38]中存在透明滴和淀粉样间质,偶见嗜铬细胞瘤有局灶性炎症浸润。
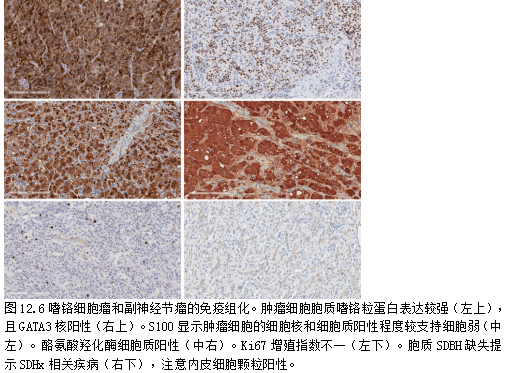
免疫组化证实了神经内分泌分化,胞质中嗜铬粒蛋白(图12.6)和突触素阳性。与上皮性神经内分泌肿瘤(NETs)不同,副神经节瘤通常角蛋白呈阴性。它们表达核转录因子GATA3[39-44](图12.6)。
儿茶酚胺、多巴胺、肾上腺素和去甲肾上腺素[45]的免疫定位由于缺乏可重复性而不被普遍使用;然而,参与儿茶酚胺合成的酶可以定位为功能标记物[15,33,36,46]。
生物合成途径的第一步是由酪氨酸羟化酶驱动的,这种酶将 L-酪氨酸转化为L-DOPA。因此,酪氨酸羟化酶免疫定位(图12.6)已被作为诊断[47]的一个有价值的工具。交感神经副神经节瘤通常强烈阳性,而副交感神经副神经节,特别是头部和颈部的,可能只是局灶阳性或完全阴性。
在2015年的一项研究中,32%的头颈部副神经节瘤显示酪氨酸羟化酶阳性表达,尽管只有1%的患者在生物化学上可检测到儿茶酚胺高分泌[48]。苯乙醇胺N-甲基转移酶(PNMT)可将去甲肾上腺素转化为肾上腺素,可以用来区分产生肾上腺素的肿瘤。
S100蛋白表达于支持基质细胞(图12.6),肿瘤细胞可阳性,但通常较弱。转录因子SOX10是一种核染色剂,也能识别支持细胞[49]。虽然支持细胞的存在已被用作副神经节瘤的诊断特征,但应该注意上皮NETs也可以有支持细胞[50,51];因此,这是不可靠的单独,必须结合形态学和其他标记。
目前,SDHB的免疫染色被推荐(图12.6),因为SDHx相关疾病的高发病率,如下文分子发病机制一节所述。
在有这些肿瘤遗传易感性的病人中,他们可能是多灶性的。MEN2患者常伴有肾上腺髓质增生(图12.7),要么是前兆病变,要么与症状明显的瘤变[52]相关,SDHB、MAX和TMEM127胚系突变患者也有报道[53-56]。
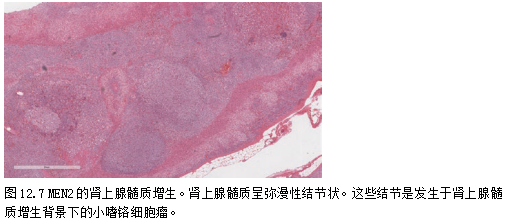
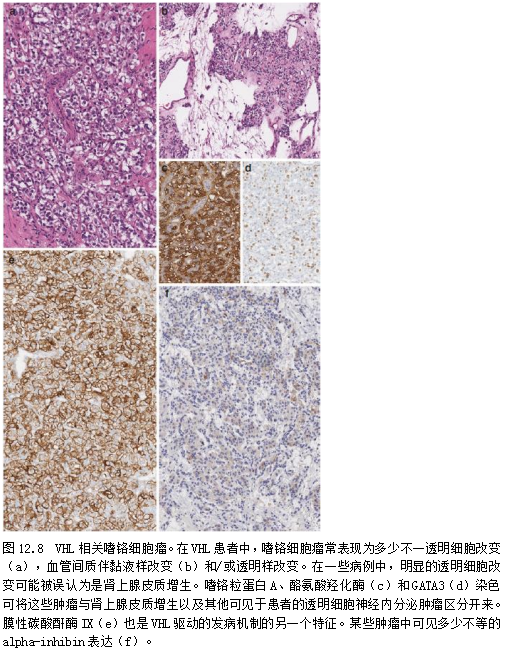
与von Hippel-Lindau(VHL)病相关的肿瘤通常具有明显的形态学特征,包括厚纤维包膜、间质水肿和明显胞质透亮(图12.8)[57];偶见VHL相关嗜铬细胞瘤表现出大量脂质变性,使其类似于皮质病变[37]。它们还表达膜性碳酸酐酶IX[58]。
与SDHx病相关的肿瘤可能有颗粒状嗜酸性胞质(图12.5和12.9),SDHB表达缺失,并表达α-抑制素[59],但一般不表达碳酸酐酶IX。
其他免疫组织化学研究依赖于临床特征,如可能的异位表达其他肽激素,如5 -羟色胺能引起类癌综合征,ACTH、和/或CRH可能导致库兴氏综合征[61],GHRH会导致肢端肥大症[62],和VIP可能导致腹泻[63]。

原发性嗜铬细胞瘤和副神经节瘤的良恶性分类一直是一个有争议的课题。在2017年之前,世卫组织对恶性肿瘤的定义是基于转移的存在。然而,转移行为的预测过去是,现在仍然是一个问题。
肾上腺嗜铬细胞瘤分级(PASS)在新分类之前被用来定义恶性[64]。得分是基于入侵血管的存在(得分=1),肿瘤包膜(得分=1),和/或肾上腺周围脂肪组织(得分=2),大巢或弥漫生长(得分=2),细胞密度高(得分=2),单一细胞学(得分=2),梭形细胞形态(得分=2),明显核多型性(得分=1),细胞核深染(得分=1),肿瘤坏死(得分=2),核分裂象(>3个/10HPF,得分= 2),不典型核分裂(得分=2)。评分≥4则为侵袭性肿瘤。然而,这些特征的主观性导致病理学专家之间缺乏一致性[65]。
肾上腺嗜铬细胞瘤和副神经节瘤的分级系统(GAPP)的设计是为了解决PASS仅为肾上腺肿瘤设计的这一问题,同时也纳入了Ki67增殖指数和儿茶酚胺的产生概况[66]。
该系统得分范围为0到10分;肿瘤分为高分化(0-2分)、中分化(3-6分)、低分化(7-10分)。然而,病理学家之间的一致性还没有得到验证。
对 GAPP系统的批评指出了将生化数据纳入GAPP等级的方式所带来的实际和概念上的困难,并质疑差异化是否真正由GAPP参数来衡量[67]。
2019年,一项对多篇论文进行的meta分析得出结论,PASS或GAPP的低评分是低转移风险的强预测因子,但在没有辅助标记物的情况下,高评分几乎没有预测价值[68]。
两种系统都没有考虑到可能具有预后的分子数据;例如,有MAML3融合的肾上腺肿瘤被认为更具侵袭性[69],而SDHB胚系突变易导致转移[70]。
早期研究表明,GAPP可以为SDHB突变患者提供预后信息[71],第三项建议将SDHB免疫组化加入到PASS和GAPP系统中提出的标准中[72]。
Ki67增殖指数作为GAPP系统的一个组成部分,可能仅具有预测价值[66,73],但这还有待证实,且这些肿瘤不像上皮细胞分化良好的神经内分泌肿瘤那样根据增殖情况进行分级[74]。
新的免疫标记物如ATRX和TERT可能具有独立预后价值[68]。
2017年,考虑到所有嗜铬细胞瘤和副神经节瘤都有转移的可能性,WHO的分类最终放弃了二元分类。这种新模式需要一种基于风险分层的方法,尽管分层风险的参数仍在不断变化。此外,“恶性”一词被“转移性”所取代,消除了相互矛盾的定义。
WHO标准中指出,“转移性肿瘤应仅在不存在正常嗜铬组织的部位被认为是转移性,以避免将多中心原发肿瘤误诊为转移性肿瘤”[75]。然而,甚至诊断副神经节瘤转移是复杂和有争议的。
在一些胚系系易患这些肿瘤的患者中,转移性扩散几乎是不可能的,这些患者即使在不寻常的部位,如肺或肝门,以及在影像学上类似淋巴结的椎旁区域,也可能出现多灶原发病灶。
尽管副神经节和副神经节瘤的典型分布,但必须记住,正常和肿瘤性副神经节确实偶尔发生在离群点。仅有的旁轴部位没有固有副神经节是大脑、骨骼和淋巴结内。缺乏支持细胞或此类细胞数量减少已被报道为转移的一个特征[76]。
罕见的副神经节瘤表达角蛋白[77-80]。这些不寻常病变分为两类。所谓的神经节细胞副神经节瘤是具有角蛋白阳性上皮细胞群、神经成分和间质的三相肿瘤;他们没有确凿的证据表明副神经节分化,因此这个术语很可能是用词不当。它们最常发生在十二指肠,但也有报道见于鼻咽、食道、阑尾和肺[81]。
马尾区发生的肿瘤包括典型的角蛋白阴性副神经节瘤[13]和偶尔表达角蛋白的肿瘤;后者可能是由于异常的室管膜分化或可能代表上皮神经内分泌肿瘤在不寻常的位置的例子。
复合嗜铬细胞瘤和副神经节瘤是少见的副神经节肿瘤(图12.10)[15,75]。
“复合”一词适用于具有嗜铬细胞瘤或副神经节瘤与神经母细胞瘤、节细胞神经母细胞瘤、节细胞神经瘤和恶性周围神经鞘瘤特征的副神经节瘤。复合成分的进一步评估是基于施万基质的数量和肿块内神经母细胞和神经节分化的存在或不存在。因此,充分的采样对这些肿瘤的精确分型至关重要。
分子发病机制
在过去的几十年里,嗜铬细胞瘤和副神经节瘤的发病机制得到了广泛的研究,并且它们具有极高的遗传易感性。过去认为只有10%的嗜铬细胞瘤是家族性的,现发现超过40%的副神经节瘤患者携带胚系突变[69,82-84]。
这些突变包括MEN2中的经典RET突变、VHL综合征中的VHL突变和1型神经纤维瘤病中的NF1突变。
然而,最常见的突变导致了琥珀酸脱氢酶(SDH)酶复合物的不稳定;该多蛋白复合物由四个亚基SDHA、SDHB、SDHC、SDHD和两个组装因子SDHAF1和SDHAF2组成。致病突变发生在任何编码这些成分的基因已被报道,但最常见的是SDHB。
罕见突变发生在TMEM127(跨膜蛋白127)、FH(富马酸水合酶)、MAX(myc相关因子X)、HIF2A(缺氧诱导因子2 α)或EPAS1、PHD1(脯氨酸羟化酶)(也称为EGLN2)、EGLN1(以前称为PHD2)、BAP1(BRCA1相关蛋白1)、KIF1Bβ(激酶样蛋白)、KMT2D(组蛋白赖氨酸N-甲基转移酶2D;又称MLL2)和DNMT3A [84-89]。
遗传易感性的诊断很重要,因为它可以预防受影响家庭成员的并发症[90,91]。这也表明,新病变更可能是明显的原发肿瘤,而不是转移灶,不像散发性疾病更可能发生转移。
各种与临床和生化特征相关的基因改变可被分类为特定的群[15,33,84,92]。1群疾病与包括SDHx、VHL、HIF2a、FH、MDH2、PHD1/EGLN2和PHD2/EGLN1在内的“假性缺氧途径”的改变相关;患者主要有多巴胺能和/或去甲肾上腺素能分泌。
由RET、TMEM127、MAX、NF1或KIF1Bβ突变激活的激酶受体信号转导引起的2群疾病,其特征是肾上腺素能或去甲肾上腺素能和肾上腺素能混合分泌。
少数伴有MAML3融合导致WNT信号激活的散发性嗜银细胞瘤也具有去甲肾上腺素能和肾上腺素能分泌的混合特征,属于第2群疾病[69,93]。
肾上腺髓质增生单独或与嗜铬细胞瘤相关的存在已被认为具有临床意义,因为它可能预测一种致病的胚系突变。在RET突变和MEN2[52]以及SDHB、MAX和TMEM127种系突变的患者中已经报道了这一特征[53-56]。
免疫组化是一种有用的和廉价的工具,以协助诊断遗传易感性的副神经节瘤患者。任何与SDHx相关的疾病都会导致多蛋白SDH复合物的不稳定;因此,免疫组化检测SDHB被接受为标准的筛查工具[94];阴性时,可添加额外的SDHA或SDHD染色,分别指定SDHA或SDHD相关的疾病[95-97]。
其他更罕见的基因改变也可以通过免疫组化鉴定;至少在某些病例中,由于这些基因的突变,FH或MAX的缺失是疾病的特征[83,94,98]。碳酸酐酶IX (CAIX)染色与VHL相关的副神经节瘤[58]有关,最近的数据表明,在这种或其他影响缺氧途径[59]的基因改变的患者中发现了α-抑制素的表达。
预后
嗜铬细胞瘤和副神经节瘤的预后极其多变,取决于肿瘤的位置和大小、涉及的致病基因突变以及是否存在胚系系倾向[70,99]。这些肿瘤不再被划分为良性和恶性[23,100]。多灶性或进展性疾病,即使没有转移,可导致显著的发病率,甚至死亡率。
散发性患者肿瘤比较小,并位于一个手术可达的位置,完全切除通常是治愈的。然而,一些散发性肿瘤具有局部侵袭性,当侵袭性结构不适于切除时,可能需要更积极的治疗。在遗传易感的患者中,多灶性疾病可类似转移,在一些患者中,多灶性原发病灶的范围妨碍了手术切除。双侧肾上腺疾病患者可能需要保留皮质的双侧肾上腺切除术[101]。
对转移性疾病的诊断必须非常谨慎。由于副神经节几乎存在于头部、颈部和躯干的任何部位,即使是在不寻常的位置如肺或肝脏出现多灶性疾病,也必须考虑到已知胚系易感患者的多灶性原发肿瘤[12,75]。
在这种情况下,只有骨、脑和淋巴结肿物才符合骨转移。在一个患者有单独的侵袭性病变,肝和/或肺肿物可能被认为是转移的证据,而没有潜在的胚系突变。
转移行为在伴有MAML3融合的散发性嗜铬细胞瘤、SDHB相关疾病以及伴有ATRX和CSDE1突变的肿瘤中最为常见[13,69,70,84,99]。TNM分期在最新的AJCC指南(第八版)中被引入[102];然而,该算法的临床相关性仍有待验证。
其中一些基因改变也容易发生其他肿瘤。SDHx患者有发生胃肠道间质瘤和肾细胞癌的风险。垂体神经内分泌肿瘤也有报道,但并不总是SDH缺失,可能是巧合[103-106];甲状腺和肾上腺皮质癌也可能出现这种情况[106]。也有人质疑该病例中报道的胰腺神经内分泌肿瘤是否为副神经节瘤[106]。
SDHB的免疫组化在区分偶然的肿瘤关联和SDHx相关疾病的真实表现方面发挥了关键作用,而其他免疫组化研究需要区分副神经节瘤和上皮神经内分泌肿瘤。Hippel-Lindau病患者可发展为视网膜和中枢神经系统血管母细胞瘤、胰腺浆液性囊肿、肾囊肿以及肾细胞癌[107],以及胰腺多灶性内分泌增生和肿瘤[108,109]。
参考资料:






































共0条评论