[导读] 编译整理:强子
与时俱进学病理-NTRK重排软组织肿瘤(一)
软组织肿瘤中NTRK重排检测的诊断方案
从临床实践和研究的角度,已有多项有助于NTRK重排肿瘤检出、和/或有助于该肿瘤治疗的诊断方案提出。这些方案的提出,主要是因为并非所有的参与者都可以很容易的进行前述所有检测方案。因此有些方案是专门针对软组织肿瘤,有些则是专门针对儿童患者或专门针对成人患者,还有些则与肿瘤类型无关。
这些诊断方案很多都是从评估肿瘤组织学开始的,可用于完整切除的标本。其实完整切除并达切缘阴性总是NTRK重排肿瘤的一线治疗方案,因此有组织提出如果可以、或已经完整切除,则无需进行分子检测。有些诊断方案的前提是需要诊断为“肉瘤”;不过,由于该组肿瘤并无标准的预测方案和/或分级方案,因此可能也不是很合适。目前来说,某些组织学特征如核分裂、坏死、肿瘤大小等和生物学行为之间并非绝对相关,仍需进一步研究。
专门针对软组织肿瘤和/或儿童患者的诊断方案,一般是指组织学为婴儿型纤维肉瘤及先天性中胚层肾瘤的情况。如果遇到这样的组织病理学表现和临床表现,相关方案常建议通过FISH检测最常见的ETV6-NTRK融合。除此之外,很少建议FISH用于诊断。即使FISH检测为阴性的情况下,相关诊断方案会建议加做其他融合配体相关的分子检测,尤其是无法切除、手术可能造成损伤、无法完全切除、或进展中的肿瘤。
是否将pan-TRK免疫组化整合入诊断,情况并不一致。有些诊断方案会任由病理医师决定,或仅在无法进行测序检测的时候建议进行。不过,如前所述,pan-TRK免疫组化在软组织肿瘤中尤其有帮助,因为其不同的表达模式会有特殊意义:细胞核阳性的肿瘤倾向于有NTRK3融合,因此这时候如果不能做融合检测、就可以针对该基因进行FISH检测。符合NTRK重排形态谱系表现、但免疫组化pan-TRK阴性的软组织肿瘤具有NTRK重排(尤其NTRK3重排)的几率很小;不过,这种情况下可能更多见为其他激酶改变。因此,应进行广泛的分子检测,如ALK、RET、MET、ABL1、BRAF、RAF1重排及BRAF序列改变。
本文原作者提出了一个整合组织形态学、临床特征、分子检测的诊断方案,详见下图。
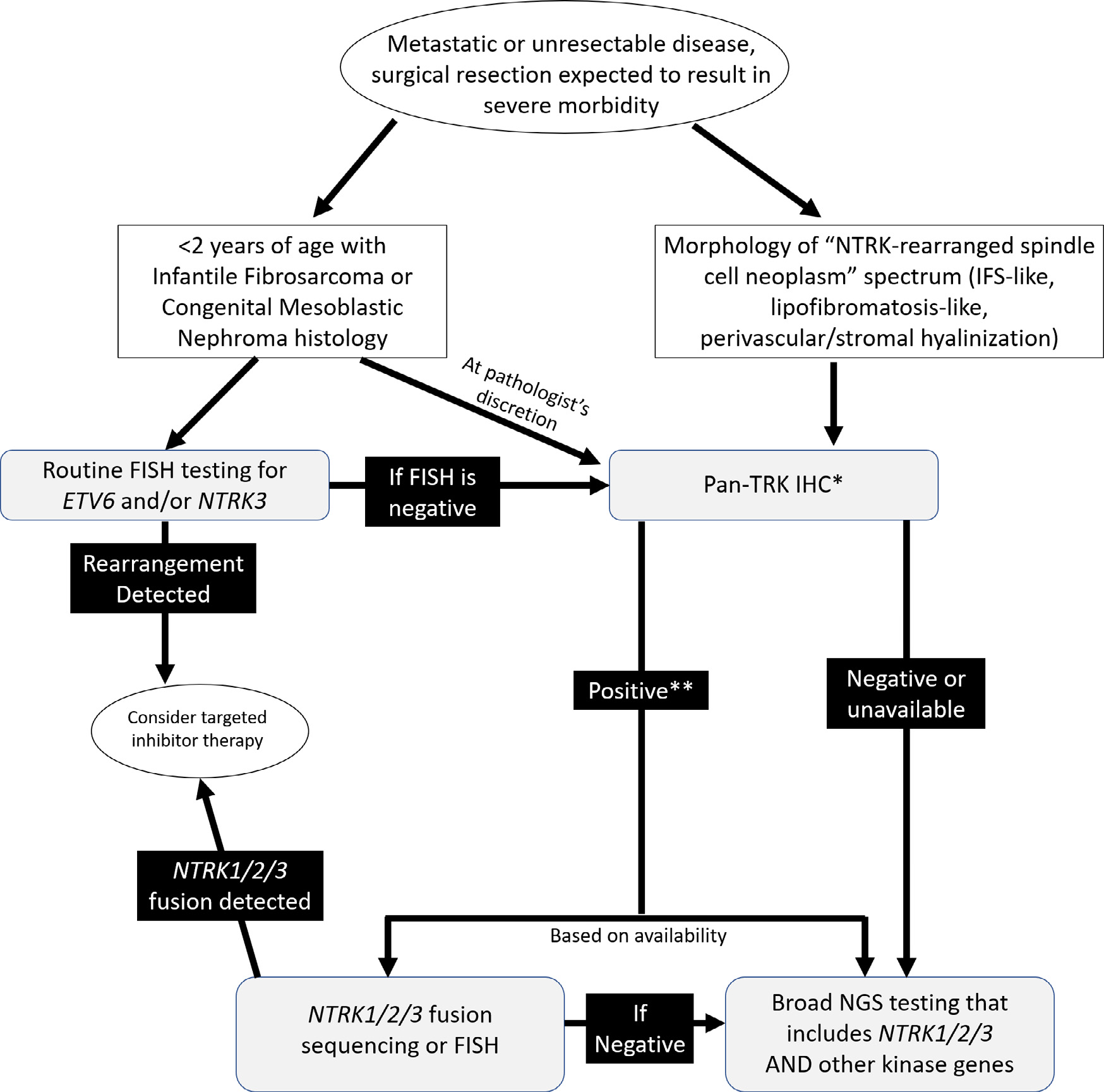
图1. 具有婴儿型纤维肉瘤、先天性中胚层肾瘤、NTRK重排梭形细胞肿瘤形态的软组织肿瘤中,NTRK重排和其他激酶改变检测方案。
图1详解:
1. 该方案针对的是转移性病变、无法切除病变、或手术可能会导致严重并发症的病变;
2. 如果形态学为NTRK重排梭形细胞肿瘤谱系(即前述婴儿型纤维肉瘤样、脂肪纤维瘤病样、血管周/间质玻璃样变),则进行pan-TRK免疫组化检测:(A)如果pan-TRK免疫组化阴性,则进行包括NTRK1/2/3及其他激酶基因在内的全面二代测序;(B)如果pan-TRK免疫组化阳性,则针对NTRK1/2/3融合进行测序或FISH检测:检出NTRK1/2/3融合,则考虑相应抑制剂的靶向治疗;未检出NTRK1/2/3融合,则进行包括NTRK1/2/3及其他激酶基因在内的全面二代测序;
3. 如果患者小于2岁且形态学为婴儿型纤维肉瘤或先天性中胚叶肾瘤,是否直接进行pan-TRK免疫组化,取决于病理医师的个人意见;但应常规进行ETV6和/或NTRK3的FISH检测,如果FISH结果阴性,则进行pan-TRK免疫组化检测;pan-TRK免疫组化检测不同结果的后续处理,参照第2条;
4. 如果患者小于2岁且形态学为婴儿型纤维肉瘤或先天性中胚叶肾瘤,应常规进行ETV6和/或NTRK3的FISH检测,检出重排则考虑相应抑制剂的靶向治疗。
NTRK重排软组织肿瘤的特殊检查要点
有多种已广泛应用的方法可以检出NTRK基因重排,如FISH、RT-PCR、RNA或DNA的二代测序。此外,TRK-A/B/C的蛋白表达已经可以很容易的进行免疫组化检测。本文将对确定软组织肿瘤中NTRK基因重排的方法进行简单介绍。
1. 免疫组化
免疫组化有诸多优点,如快速、大部分病理实验室均可进行,因此非常适用于可疑NTRK重排软组织肿瘤的初筛。尽管很多肿瘤类型中有TRK的融合,但建议通过用在软组织肿瘤中经过特殊验证的抗体及方案来对间叶性肿瘤进行NTRK融合筛查。
目前已有大量商用pan-TRK抗体,据报道其用于软组织TRK重排检测的敏感性和特异性分别达到了75-88%、81-95%。需要注意的是,pan-TRK抗体的着色模式判读非常重要:NTRK3溶解一般为细胞核阳性、伴或不伴胞质着色;而NTRK1/2融合则为弥漫强阳性胞质着色。该抗体对于NTRK3融合的敏感性,要低于对NTRK1/2融合的敏感性,因此用于NTRK3融合判定时会有约10%的假阴性率。
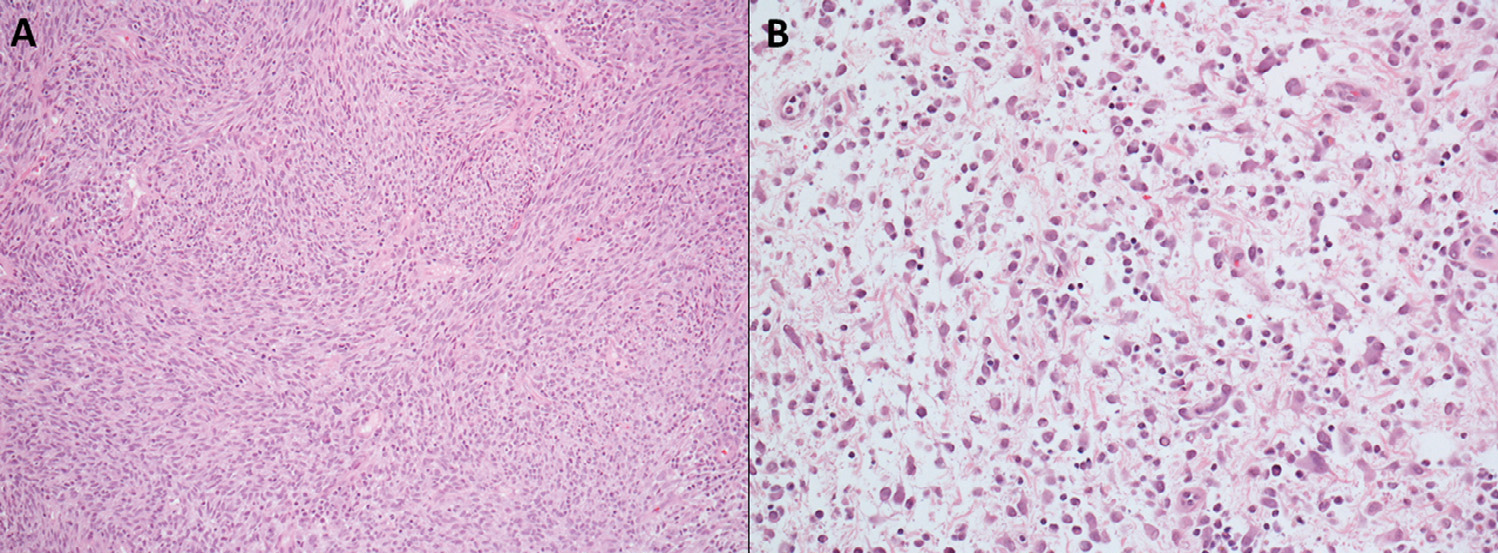
图2. 一例伴ETV6-NTRK3融合的婴儿型纤维肉瘤实例。HE切片中,肿瘤具有异质性。具体来说,部分肿瘤为梭形细胞、呈相互交织的细胞丰富的束状结构,还有部分肿瘤细胞相对稀疏,呈胖梭形、卵圆形或星型,背景为显著黏液样基质,散在炎症细胞。
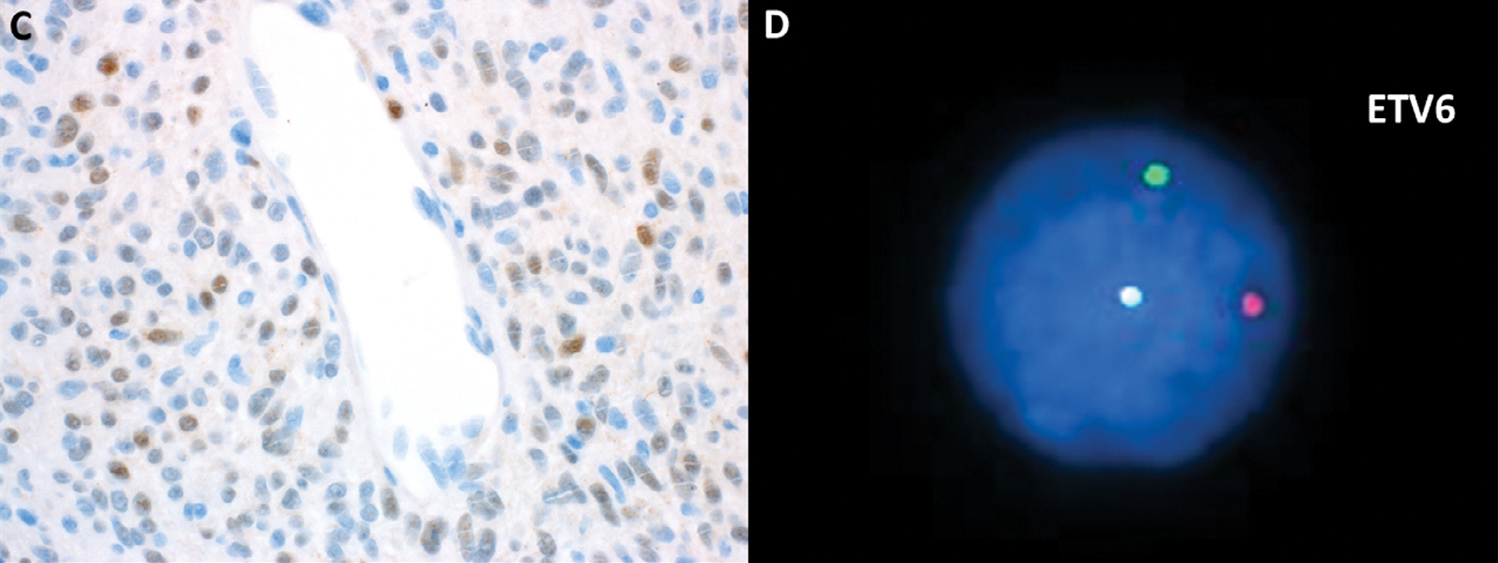
图3. 图2病例免疫组化pan-TRK,瘤细胞的细胞核散在阳性,这符合NTRK3基因融合的表现;背景中的内皮细胞无表达,可作为阴性内对照;针对ETV6区域的断裂探针进行FISH检测,检出了基因融合。
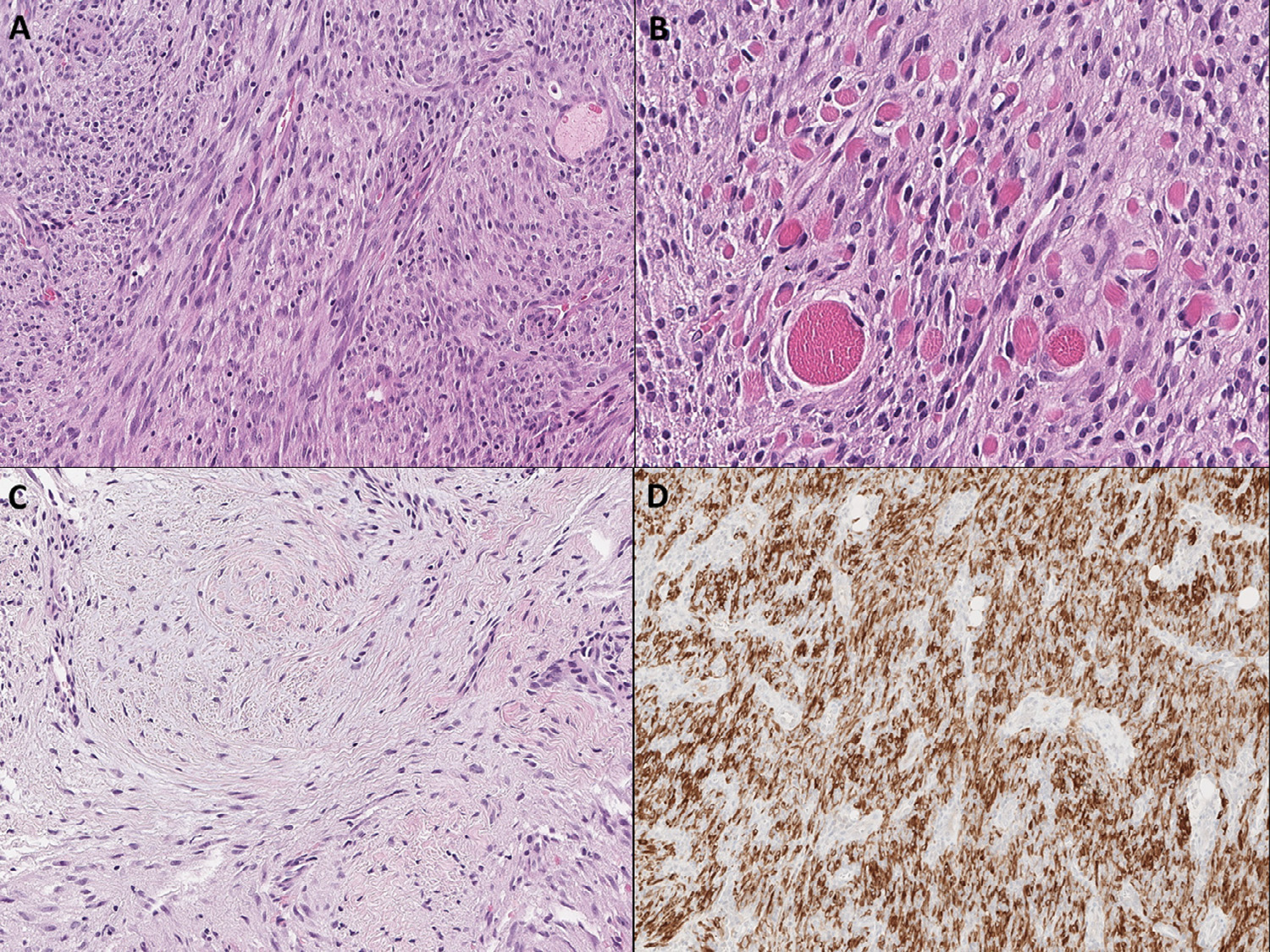
图4. 一例伴TPR-NTRK1融合的婴儿型纤维肉瘤实例。HE切片中为形态相对单一的梭形细胞、呈束状排列(A),部分区域梭形细胞浸润较深,肿瘤周边可见骨骼肌纤维(B)。该肿瘤部分区域细胞相对少,形态呈梭形或星型,背景为显著胶原化至黏液样的间质(C)。免疫组化pan-TRK检测,肿瘤细胞呈胞质阳性的表达模式,更符合NTRK1或NTRK2基因融合的情况(D)。
2. FISH
FISH检测作用非常强大,且也已有广泛应用。针对NTRK融合的检测来说,是通过荧光标记的、针对NTRK1、NTRK2或NTRK3基因中5’端及3’端的DNA探针进行相应检测。鉴于NTRK重排中5’端融合基因的复杂性,因此断裂探针效果最佳、敏感性最好。
与大部分FISH检测探针一样,针对NTRK融合的检测也建议用于福尔马林固定组织、4μm切片,一般阳性结果的判定阈值为大于10%或大于15%。该检测的敏感性及特异性较高,一项研究中称分别为94.4%、96.2%。不过,理论上可以出现假阴性的罕见情况,比如小范围的染色体内重排而未达到断裂探针解读的阳性阈值。
对于三种NTRK基因,要通过三次独立杂交检测才可以,这样就会导致费用高昂、时间较长,但却不会因此得出更多信息,如断裂点相关信息、确定5’端融合配体等。不过,通过ETV6和/或NTRK3探针进行FISH检测,对于确定ETV6-NTRK3融合非常有效,而这一融合又是婴儿型纤维肉瘤、先天性中胚层肾瘤中最为常见的融合。但也有作者报道,在ETV6-NTRK3融合病例中,ETV6探针FISH检测的假阴性率高达36%。
3. RT-PCR
RT-PCR是一种在RNA基础上检测NTRK融合转录的方法。这一检测即可定性化,也可定量化。虽然RT-PCR非常敏感,但却具有显著局限性,也就是必须了解融合配体及断裂点。由于软组织肿瘤中NTRK融合的5’端配体非常复杂,因此这种情况下RT-PCR其实应用并不多。此外,即使确定是ETV6-NTRK3融合,由于断裂点并不一致,也使得RT-PCR较少应用。
4. 二代测序
对于NTRK重排的检测来说,RNA二代测序是最敏感、最特异的技术。目前有多种RNA测序方式,其差别在于如何获取NTRK融合转录本,如全转录本、扩增基础的、锚定多重PCR,其中靶向PCR检测是应用最广泛的。mRNA是最佳检测模板,因为其中并无内含子。对外显子断裂点分析,可确定预计的蛋白产物是否包括在完整的读码框内,确定断裂点是否包括了关键的激酶结构域。检测表达的mRNA融合转录本,也可检出小的染色体内重排,而如前所述,这一点在FISH检测中可能会被漏掉。
也可进行DNA基础上的测序分析,但其敏感性和特异性都要低于RNA基础上的检测,具体取决于测序涵盖NTRK1/2/3内含子区域的数量和测序深度。有研究分析了DNA基础上的二代测序检测,发现相比RNA基础上测序作为金标准来说,前者的总体敏感性为81.1%、特异性为99.99%。
二代测序技术的巨大优势在于可以在少量福尔马林固定、石蜡包埋组织中进行,但其所需时间为2-4周,且价格较高。与免疫组化不同,二代测序技术可以用于任何肿瘤类型,无需专门针对软组织肿瘤的特殊验证。此外,二代测序所得信息更为丰富,比如一次测序可以获取所有三种NTRK基因的信息,且常可以获取其他激酶融合基因的信息,如ALK、RET、RAF1、ABL、BRAF,而具有这些融合的相关肿瘤在形态学上可能和NTRK重排肿瘤有重叠。
小结
伴NTRK重排的软组织肿瘤包括了多种形态谱系具有重叠的病变类型。随着我们对该组肿瘤遗传学改变的认识不断深入,关于这类肿瘤的诊断分类及分级仍在研究中。检出该组肿瘤中的NTRK重排具有重要意义,尤其是转移性、无法切除、进展中的病例更是如此,因为可以考虑进行激酶抑制剂治疗。这方面最有效的检测方案是针对融合靶点的检测,但FISH和pan-TRK免疫组化也很重要,且耗时更短。
全文完
点击下载原文文献
参考文献
Surrey LF, Davis JL. NTRK-Rearranged soft tissue neoplasms: A review of evolving diagnostic entities and algorithmic detection methods. Cancer Genet. 2022;260-261:6-13.
doi:10.1016/j.cancergen.2021.10.007

















共0条评论