[导读] 译者:慧海拾穗
【摘要】
间变性淋巴瘤激酶(ALK)重排相关肾细胞癌是一个新的暂定实体,已被列入2016年世界卫生组织肾细胞癌分类中。本文报道2例ALK重排相关肾细胞癌,1例为VCL-ALK融合,另一例为EML4-ALK融合。VCL-ALK肾细胞癌发生于一名具有镰状细胞特征的14岁女孩,表现出与前面描述的VCL-ALK肾细胞癌相似的特征,包括髓质中心、实性结构、胞质空泡的多角形细胞。EML4-ALK肾细胞癌发生于一名14岁男孩,无镰状细胞特征,有多种不太特异性的生长模式,包括管状、实性和管状乳头状结构,间质增生明显,类似于集合管癌。免疫组化显示两例均为胞质和胞膜ALK阳性表达。荧光原位杂交证实了ALK基因重排。文献综述,与非VCL-ALK肾细胞癌相比,我们发现实性结构和胞质空泡更多见于VCL-ALK肾细胞癌。
【病例报告】
病例1:女孩,14岁。具有镰状细胞特征,表现为右肾肿块和接受了右肾根治性切除。肾切除术标本显示一个长6cm,边界清楚,呈棕褐色,实性被包裹的肿瘤,位于肾髓质中心,并延伸至肾门。镜下显示:肿瘤由圆形、卵圆形或多角形细胞组成,中等异型性,有丰富的嗜酸性细胞质和大小不等的空泡(图1)。细胞核呈空泡状染色质,核仁小。核分裂象低(1/20HPF)。虽然肿瘤被增厚的纤维囊和化生骨边缘包围,但肿瘤细胞浸润到纤维囊内,并向血管间隙和肾门浸润。肾门周围淋巴结转移阳性。实验室检查可见镰状红细胞,符合患者病史。免疫组化结果显示,肿瘤细胞PAX8和vimentin阳性,AE1/AE3、CK7和EMA局灶阳性,CD10、CAIX、CD117、SMA、desmin、MITF、HMB-45和MART1阴性。INI-1表达完整。ALK胞质和胞膜强阳性。FISH证实ALK基因重排,但没有证实TFE3和TFEB的重排。细胞遗传学分析显示t(2;10)(p23;q22.2),从而产生VCL-ALK融合基因。本例患者失访。
病例2:男孩14岁。发现左肾肿块并有双侧肺转移,并接受了左肾根治性切除术。随后进行了辅助化疗,直到手术一年后,发现右腹膜后局部复发。复发肿瘤切除,FISH显示ALK基因重排。然后接受了辅助放化疗及舒尼替尼(一种多靶点酪氨酸激酶抑制剂)治疗。一年后CT显示第二次局部(腹主动脉周围淋巴结)复发,再次切除。两年后,他在左腹部出现了第三次局部复发。肿瘤再次被切除,并提交组织进行下一代测序,结果显示EML4-ALK基因融合。随着局部疾病的进展和新的肝和肺结节出现,患者出院回家进行姑息治疗。肾切除标本显示一个长14厘米,边界不清的囊实性肿瘤。实性区域显示黄褐色切面,囊性区域包含出血和坏死物质。肿瘤未累及肾盂、肾窦或肾静脉。镜下显示:浸润性肿瘤具有多种结构,包括管状、实性和管状乳头状结构,嵌于纤维间质中(图2)。肿瘤细胞胞质嗜酸性,无空泡,细胞核多形性,染色质空泡状,核仁明显。大面积坏死,核分裂活跃(每10个高倍视野至少有25个核分裂象)。肿瘤细胞PAX8、AE1/AE3、CK7和vimentin阳性,CAIX和CD117局灶阳性,AMACR、WT-1、Syn、OCT-3/4和SALL4阴性。INI1表达完整。Ki67增殖指数为80%。在我们回顾该病例之前,该肿瘤已被2名其他医生诊断为集合管癌和无法分类的肾细胞癌。在第一次复发的肿瘤细胞中,FISH显示ALK基因重排,第二次复发的肿瘤细胞检测显示ALK蛋白弥漫胞质和胞膜阳性表达。
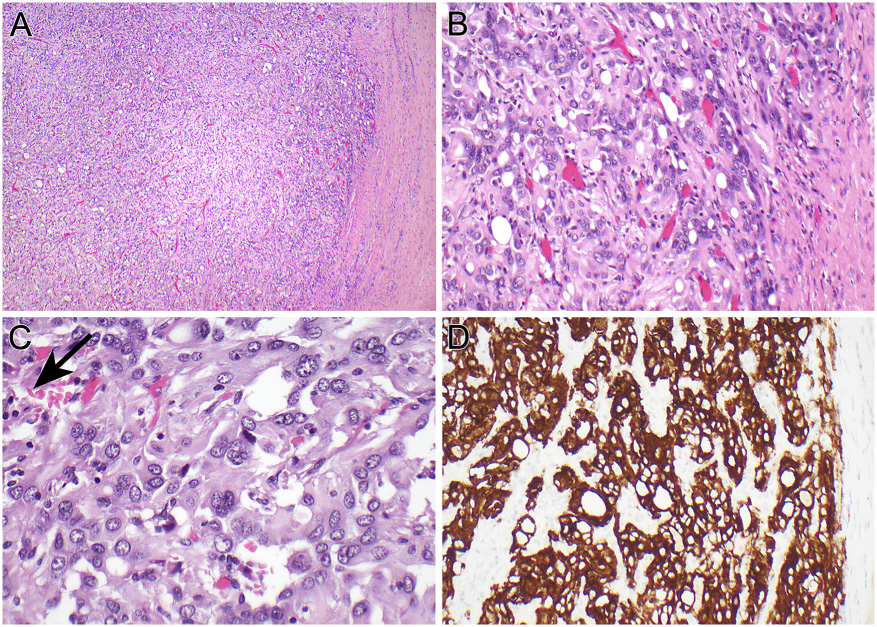
图1为VCL-ALK肾细胞癌:低倍镜下,病变被纤维包膜包裹(A)。中倍镜下,可以看到肿瘤细胞实性结构和胞质空泡化(B)。高倍镜下,肿瘤细胞松散,有吻合的间隙将实性区分开。在这些间隙中偶见镰状细胞(C)。肿瘤细胞ALK弥漫胞质和胞膜阳性(D)。
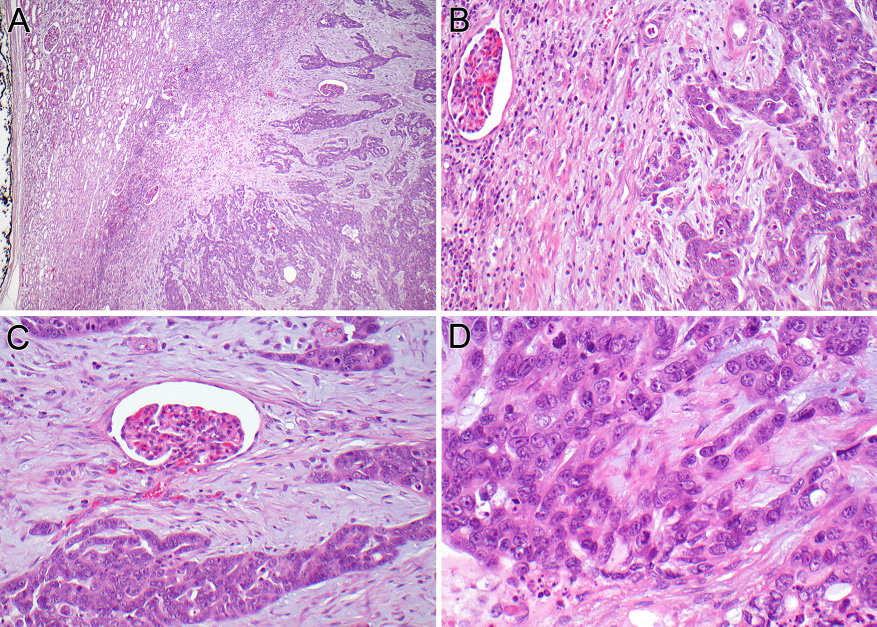
图2为EML4-ALK肾细胞癌:低倍镜下,肿瘤与肾脏呈不规则边界,并与间质黏连有关(A)。高倍镜下,左侧肾脏呈不规则边界(B)。肿瘤细胞在固有肾单位(包括固有肾小球)之间浸润(C)。肿瘤细胞具有难以描述的高级别腺癌形态,有实性区域和局灶腺样形成(D)。
【讨论】
本文补充了已有的ALK重排肾细胞癌的数据,并讨论了ALK重排肾细胞癌与VCL融合伙伴和非VCL融合伙伴之间的区别。我们的VCL-ALK肾细胞癌病例的临床和病理特征与早期报道的年轻患者相似,伴有镰状细胞特征,实性结构,多角形细胞,核空泡状,丰富的细胞质和明显的胞质空泡。相反,伴有EML4-ALK融合肾细胞癌与镰状细胞特征无关,组织学特征也没有特异性。自Debelenko等人和Mariño-Enríquez等人最初描述VCL-ALK肾细胞癌以来,又报告了其他病例;除1例外,其余病例均有明显的VCL-ALK肾细胞癌特征。异常病例是Wang等人描述了一例VCL-ALK基因融合的肾细胞癌,患者为中国中年妇女,临床没有镰状细胞特征的证据。镜下,该肿瘤具有管状至管状乳头状结构,腔内黏液和黏连增生间质--特征更类似于一些非VCL-ALK肾细胞癌,包括我们的病例。免疫组化显示TFE3和TFEB阴性。INI-1和延胡索酸酯酶(fumarate hydratase)表达完整。ALK强而弥漫阳性表达。除VCL-ALK基因融合外,他们还发现了EP300剪接供体突变和TRRAP无义突变;然而,这些基因改变的意义尚不清楚。组织学切片上未见镰状红细胞。然而,需要注意的是,本例中未进行血红蛋白电泳,因此未排除潜在的血红蛋白病(包括镰状特征)。
回顾英文文献,发现42例有足够的临床病理资料。除Kuroda等人的大宗病例报道外,大多数是个案或少数病例的报道。总之,ALK基因重排的肾细胞癌年龄范围广,形态多样。除上述1例外,所有VCL-ALK肾细胞癌均发生于具有镰状细胞特征的儿童和年轻人,其形态特征为多角形细胞呈实性排列,胞质呈明显空泡状。相比之下,非VCL-ALK肾细胞癌年龄范围广,形态多样,有乳头状、实状、管状、管状乳头状、筛状、印戒细胞、后肾腺瘤样、黏液管状和梭形细胞样模式。在非VCL-ALK肾细胞癌中也发现了越来越多的伴侣基因,包括TPM3、EML4、STRN、HOOK1、PLEKHA7、CLIP、KIF5B和KIAA1217。根据文献中的数据,我们发现VCL-ALK肾细胞癌比非VCL-ALK肾细胞癌更常出现实性结构和细胞质空泡状。两组间乳头状结构、间质/胞质内黏蛋白、印戒细胞和砂砾体(psammoma bodies)的存在无显著差异。
ALK肾细胞癌的临床行为仍不确定,因为只有43%(15/35例)的随访时间≥24个月。总的来说,有3例患者死于疾病,10例患者带病生存,而22例患者在有限的随访中(平均20个月)没有显示疾病的证据。
靶向ALK治疗已广泛应用于转移性ALK重排非小细胞肺癌的治疗。自FDA批准以来,已有几份报告显示VCL-ALK肾细胞癌和非VCL-ALK 肾细胞癌在复发和转移情况下的临床和影像学反应。这些数据表明,ALK重排肾细胞癌患者可能受益于ALK抑制剂治疗,并强调了识别这些肿瘤的重要性,以便在未来有临床试验时,患者可以得到转诊登记。
总之,我们报告了另外2例ALK肾细胞癌,并支持VCL-ALK肾细胞癌代表肾脏肿瘤的一个独特亚群,而非VCL-ALK 肾细胞癌在临床和形态学上具有多样性。对于不符合其他定义类别的儿童肾细胞癌,应检测ALK基因状态,以避免错过可治疗的患者。
【参考文献】
[1] ALK-rearranged Renal Cell Carcinoma (RCC): A Report of 2 Cases and Review of the Literature Emphasizing the Distinction Between VCL-ALK and Non-VCL-ALK RCC[J].International Journal of Surgical Pathology,2021.DOI: 10.1177/10668969211003660.















共0条评论