[导读] 编译整理:强子
2020年面世的第五版世界卫生组织女性生殖道肿瘤分类著作中,下生殖道、子宫内膜、卵巢癌的诊断分类方面具有某些重要改变,对我们日常诊断工作也有了重要影响。其中免疫组化在诊断中的意义更加重要了,具体如子宫内膜癌的诊断来说,目前鼓励在传统组织学分类的基础上根据TCGA分子分组方案加做相应免疫组化以提供更多预后信息;某些新病种的诊断(如中肾样腺癌、子宫内膜的胃型黏液腺癌)也需要免疫组化来证实。除用于诊断之外,相关遗传综合征的筛查、预后判断、靶向治疗相关方案的制定等,都对免疫组化检测提出了更多要求。有鉴于此,耶鲁大学医学院病理专家Buza在《Semin Diagn Pathol》杂志发表文章,以2020年第五版世界卫生组织女性生殖道肿瘤分类著作相关内容为基础,详细介绍了相关癌的某些免疫组化指标。为帮助大家更好的了解和掌握相关要点,并用于临床实践,我们将该文要点编译介绍如下。
下生殖道-外阴、阴道和子宫颈
对于下生殖道癌及其前驱病变来说,2020年版世界卫生组织著作中的主要更新是根据相关病变的发生机制分为与HPV相关、与HPV无关两种情况。发生机制的不同,也体现在临床预后的差异,且对治疗决策可能也会有影响。
具体来说,约三分之一的外阴鳞状细胞癌与HPV感染有关,在总生存时间、疾病特异性生存时间方面都要优于HPV无关的外阴鳞状细胞癌。HPV无关的外阴鳞状细胞癌大部分都有TP53的突变,而少部分HPV无关的、TP53野生型肿瘤则发现有PIK3CA、HRAS、NOTCH1的活化型突变。
HPV相关和HPV无关的外阴上皮内瘤变(vulvar intraepithelial neoplasia,VIN)区分开来也很重要:HPV相关的VIN(又称为普通型VIN)进一步分为低级别鳞状上皮内病变(low grade squamous intraepithelial lesion,LSIL)、高级别鳞状上皮内病变(high grade squamous intraepithelial lesion,HSIL),二者分别对应VIN1和VIN2、VIN3;而HPV无关的前驱病变则可进一步分为p53异常的分化型VIN(differentiated VIN,dVIN)和最近描述的p53野生型病变,后者包括了分化型外生性外阴上皮内病变(differentiated exophytic vulvar intraepithelial leison,DEVIL)和伴异常分化的外阴棘层肥厚(vulvar acanthosis with altered differentiation,VAAD)。分化型VIN相比普通型VIN或HSIL来说,前者进展为浸润性鳞状细胞癌的风险显著更高,出现进展的时间间隔更短。
与此类似,子宫颈的癌(不管是浸润性癌、还是原位癌)目前也分为HPV相关、HPV无关两种类型,以反映其在临床病程和治疗方面的重要差异。基本上所有的宫颈HSIL(对应此前的宫颈上皮内瘤变【cervical intraepithelial neoplasia,CIN】2或3)及90%以上的宫颈鳞状细胞癌都与高危型HPV感染有关。而宫颈腺癌中,HPV无关的情况约占15-20%,且形态学为胃型的腺癌中大部分常与TP53突变相关、预后差。
1. 鳞状上皮病变中的免疫组化p16和p53
免疫组化p16可作为包括女性下生殖道在内的多个部位HPV感染的替代性指标。高危型HPV(如16、18、31、33、51等型别)感染,导致病毒致癌蛋白E7水平升高。E7的作用是和Rb蛋白结合并使其失活,导致CDKN2A编码的肿瘤抑制蛋白p16和p14表达上调。对于鳞状上皮内病变来说,p16蛋白过表达是指至少上皮厚度三分之一的细胞出现细胞核、或细胞核和细胞质的片状、弥漫性、强阳性着色。
形态学明确为HSIL的病变中,大部分病例免疫组化p16都是上述表现的强阳性表达;形态学为LSIL的病变、良性的相似病变(如萎缩、不成熟化生、反应性非典型)中,大部分病例免疫组化p16仅为局灶、弱阳性。正是因为上述两点,所以免疫组化p16可以用于辅助诊断。不过,已有报道称有相当一部分LSIL具有p16的过表达,且高达三分之一的HSIL可以是p16阴性。此外,已发现LSIL中p16的过表达在临床实践中是意味着有进展为HSIL风险的不利指标。
美国病理学会(CAP)和美国阴道镜与宫颈病理学会(ASCCP)发布的肛门下生殖道鳞状上皮病变术语(Lower Anogenital Squamous Terminology,LAST)标准方案中,建议鳞状上皮内病变诊断中仅限于下述情况才进行免疫组化p16的检测:(1)从HE形态学来说,需要鉴别癌前病变(HSIL或上皮内瘤变的2级或3级)和良性类似病变;(2)HE形态学诊断无法确定是LSIL、还是上皮内瘤变的2级/HSIL;(3)专家的形态学判读意见不一致、需要鉴别癌前病变(HSIL或上皮内瘤变2/3级)。已有数项研究表明,加做p16免疫组化后,外阴和宫颈活检标本中异型增生分级的观察者间一致性有了提高。
下生殖道HPV相关的鳞状细胞癌免疫组化p16一般都是弥漫强阳性,着色为细胞核或细胞核核细胞质,但有报道称阴道鳞状细胞癌中p16过表达和HPV感染之间的一致性较低。目前建议,对于所有的外阴、阴道、子宫颈鳞状细胞癌均需进行免疫组化p16检测和/或HPV分子检测,以辅助从病理机制方面进行肿瘤的分类。转移性鳞状细胞癌的诊断中,也应纳入免疫组化p16检测,具体如盆腔内淋巴结的转移、远处转移,后者则包括腹股沟淋巴结、盆腔淋巴结、卵巢、肺部等;尤其有下生殖道鳞状细胞癌病史、或相关病史不明确的情况下,更要注意加做免疫组化p16检测。

图1. 宫颈乳头状鳞状上皮不成熟化生,免疫组化p16为局灶、弱阳性。

图2. 宫颈高级别鳞状上皮内病变,本例为CIN2,免疫组化p16为特征性的片状、弥漫、强阳性着色。

图3. 卵巢内的转移性鳞状细胞癌,免疫组化p16为弥漫、强阳性着色。
任何外阴的可以鳞状细胞上皮内增生、外阴鳞状细胞癌,为精确诊断并指导预后,都应免疫组化联合检测p16和p53。外阴的HPV无关鳞状上皮癌前病变(即前述dVIN、DEVIL、VAAD)一般p16为阴性,或仅为局灶、弱阳性着色,这与HPV相关的HSIL和鳞状细胞癌的免疫组化p16是不同的。dVIN的诊断,仅凭形态学一般很困难,因为这一病变和慢性单纯性苔藓、硬化性苔藓、扁平苔藓的形态学之间有显著重叠。dVIN的表皮可以是萎缩的,也可以是棘层肥厚伴表皮突拉长、相互吻合,表皮角化过度和/或角化不全,且基底层和副基底层的细胞核有显著非典型、深染表现。基底层、并累及基底层上细胞的免疫组化p53异常表达(细胞核的弥漫强阳性着色,或较少见情况下表现为染色完全缺失)支持dVIN的诊断。不过,硬化性苔藓和其他反应性病变中也有p53过表达的报道,这是由于非突变型上调导致的,可能会是一个诊断陷阱。罕见情况下,dVIN可呈基底样或疣状形态,类似HPV相关的VIN/HSIL。免疫组化p16阴性、加之p53异常表达,一般可以解决这类病例中诊断不确定的问题。这种情况下其他免疫组化指标的诊断意义也有过研究:有报道称,dVIN中基底层GATA3表达(部分或完全)缺失,这和普通的VIN是不同的;还有研究称dVIN、普通的VIN、反应性病变中的CK17表达是不同的。

图4. 分化型外阴上皮内瘤变(dVIN,图中右侧)和外阴鳞状细胞癌(图中左侧)的免疫组化p53均为异常的细胞核弥漫、强阳性表达。
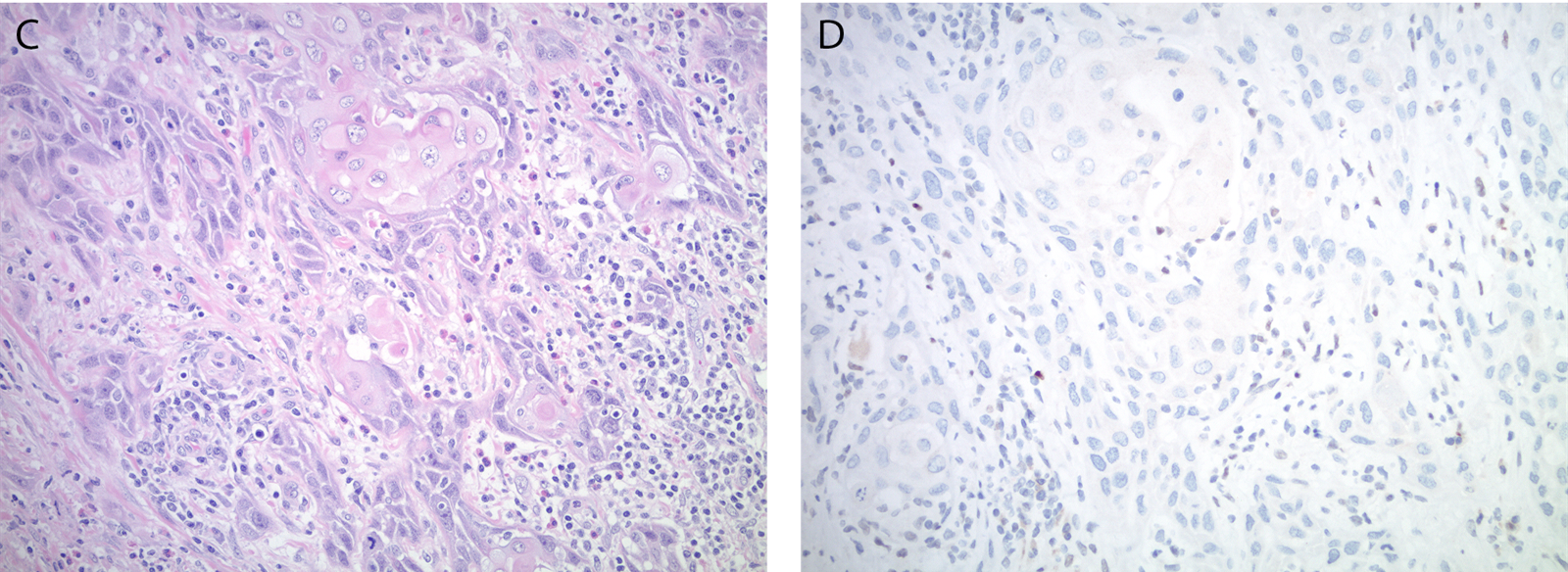
图5. 外阴鳞状细胞癌,伴少见的免疫组化p53异常表达:本例的瘤细胞免疫组化p53完全缺失。注意,间质细胞的细胞核和淋巴细胞都有阳性表达,可以作为内对照。
HPV无关的外阴鳞状细胞癌中,约80%可见TP53突变,且这一特点与免疫组化中p53的异常表达有较强相关性。外阴鳞状细胞癌的免疫组化p53有四种不同的异常表达方式:(1)基底层和上方的细胞呈细胞核的弥漫、强阳性着色;(2)基底层肿瘤细胞的细胞核呈连续的强阳性着色;(3)细胞核着色完全缺失;(4)胞质弥漫着色、伴或不伴细胞核着色。需要注意的是,HPV相关的外阴鳞状细胞癌可能会在中层上皮的细胞核呈中至重度的p53着色而基底层无着色,或表现为p53的着色显著降低、类似前述异常的细胞核着色完全缺失表现。

图6. HPV相关的外阴鳞状细胞癌,免疫组化p16呈弥漫、强阳性,免疫组化p53除基底层外、中层的上皮细胞表现为中至重度细胞核着色。
未完待续
参考文献
Buza N. Immunohistochemistry in gynecologic carcinomas: Practical update with diagnostic and clinical considerations based on the 2020 WHO classification of tumors. Semin Diagn Pathol. 2022;39(1):58-77.
doi:10.1053/j.semdp.2021.10.006



















共0条评论