[导读] 作者:徐伟伟
【临床资料】女性,48岁,不规则阴道流血半年。患者近半年出现不规则阴道流血,间断性,量少,暗红色,与月经无明显相关性;偶伴有下腹痛,劳累后加重,休息后可自行缓解。阴道镜检查见宫颈前唇约2.5×2.1cm的赘生物。
【肉眼所见】送检子宫及双附件切除标本,于宫颈前唇查见一面积2.5×1.1cm的肿物,最厚处厚0.6cm,切面灰白色,质韧。
【镜下所见】肿瘤呈腺样及乳头状结构,部分腺体扩张,微囊形成,部分腺腔内可见嗜酸性红染物。肿瘤细胞体积增大,核染色质粗糙,可见小核仁,胞质透明,细胞异型性明显,核分裂像不易见。部分扩张腺体的肿瘤细胞呈扁平及立方状,细胞质相对稀少。间质散在淋巴细胞及浆细胞浸润(组织学图片见图1)。
【免疫组化】肿瘤细胞HNF1β(+)、NapsinA(+)、AMACR (部分+)、p16(斑驳+)、ER(-)、PR(-)、p53(野生型)。部分免疫组化图片见图1。
【病理诊断】宫颈透明细胞癌。
讨论
1. 临床特征
宫颈透明细胞癌(Clear Cell Adenocarcinoma of the Cervix, CCAC)是一种罕见的妇科肿瘤。CCAC的发生率低,仅占宫颈腺癌的3-4%。根据2020版的WHO分类,CCAC属于非HPV相关性腺癌。目前认为有两个发病年龄高峰,绝经后女性(中位年龄51岁)与年轻女性(平均年龄19岁)。绝经后患者发病原因不甚明确,可能与子宫内膜异位症、口服避孕药、人类免疫缺陷病毒(HIV)感染或者遗传等因素有关,而部分年轻女性患者发病可能与宫内接触己烯雌酚(DES)有关。CCAC的临床表现与普通宫颈腺癌相似,主要为阴道流血(包括同房后阴道流血,绝经后阴道流血和不规则阴道流血),阴道流液,白带异常,月经紊乱,伴或不伴腹痛、腰痛,部分患者没有临床症状而于体检发现。
2. 病理特征
大体上,肿瘤可表现为宫颈弥漫增大的内生型、外生型肿块,或者临床不可见的病变。
CCAC的组织学形态,与发生在卵巢、子宫内膜及阴道这些常见部位透明细胞癌的组织学形态相似。镜下可见肿瘤细胞呈微囊、乳头和/或实性结构,通常几种结构混合存在。肿瘤细胞可以表现为富含糖原的透明胞质,也可以表现为嗜酸性颗粒状胞质,有时肿瘤细胞可呈鞋钉状,单层排列,由单层扁平上皮细胞衬附的小管或囊可能看起来像良性。间质可表现为透明变性胶原化。宫颈内膜腺体伴Arias-Stella反应或滋养细胞疾病,可类似透明细胞癌。
尽管CCAC没有高危HPV感染,但p16在肿瘤细胞中可以表现为弥漫阳性。HNF1β和NapsinA在CCAC中表达敏感性较好但特异性差,因为其除了表达于CCAC也可能在胃型和HPV相关的腺癌中表达。AMACR在大多数透明细胞癌中呈阳性表达。ER和GATA3通常为阴性。
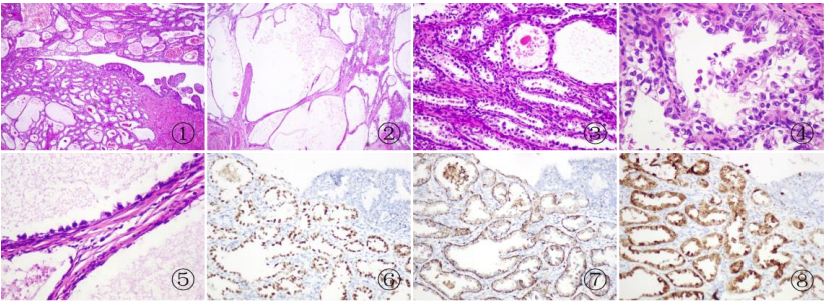
图1. ①~② 肿瘤细胞呈腺样、乳头及微囊结构;③ 个别腺腔内可见嗜酸性物质聚集;④~⑤ 肿瘤细胞富含糖原,胞浆透亮,部分肿瘤细胞可呈鞋钉状,单层排列;⑥ 肿瘤细胞HNF1β阳性表达;⑦ 肿瘤细胞Napsin A阳性表达; 图⑧ p16在肿瘤细胞中斑驳阳性。
3. 鉴别诊断
①非HPV相关性胃型腺癌
胃型腺癌包括原位腺癌及浸润性腺癌。患者发病年龄37-84岁(平均49岁),主要表现为异常阴道排液和出血。组织学表现为胃型分化,肿瘤细胞由粘液细胞组成,胞质丰富,呈泡沫状,细胞边界清晰,核位于基底部,可见核分裂像和凋亡小体但不明显。腺体内结构复杂,可以看到筛状、乳头状或微乳头状生长。肿瘤细胞内的中性黏液PAS呈现深紫色/枚红色。免疫组化表现为胃型黏蛋白标记物HIK1083及MUC6阳性,PAX-8及TTF-2阳性。TTF-2和HIK1083双阳性在胃型腺癌中具高度特异性。此外,HNF1β在90%病例中呈阳性表达,p53异常表达(突变或无义突变)在胃型腺癌中约50%。大多数胃型腺癌中P16呈阴性或者斑片状阳性,而HPV阴性,而Pax-2呈阴性。
②非HPV相关性中肾腺癌
宫颈中肾腺癌是一种非常罕见的肿瘤,起源于胚胎时期的中肾管遗迹。临床缺乏特异性,最常见的临床表现是异常子宫出血,很难通过宫颈脱落细胞学发现,超过半数患者可无任何不适,只是查体或行宫颈锥切和子宫切除术时偶然发现。患者好发于中年女性,19-85岁,30岁以下患者罕见报道。肿瘤通常位于宫颈侧壁深部,常浸润宫颈壁外1/3。组织学典型类型是背靠背的小管,小管内衬立方状细胞,管腔内充满嗜酸性分泌物(PAS阳性和黏液卡红阳性)。导管(假子宫内膜样)模式包括由柱状细胞衬里的成角腺体。其他类型包括乳头状、网状、性索状、鞋钉状、肾小球状、筛状、梭形和实性。免疫组化表现为CK、vimentin、CD10、GATA-3、Calretinin、PAX-8和CA125阳性,TTF-1及HNF-1β部分阳性,p16不表达或者局灶表达,EMA、ER、Napsin A及 WT1阴性。
③HPV相关性粘液腺癌
黏液腺癌为HPV相关性腺癌,HPV阳性,约占宫颈内腺癌的10%。根据杯状细胞、印戒细胞样细胞及其他胞质内有黏液的细胞数量是否≥50%分为肠型黏液腺癌、印戒细胞型黏液腺癌及非特指型黏液腺癌,此外还包括浸润性复层黏液性癌(Invasive Stratified Mucin-producing Carcinoma, ISMC)。黏液腺癌中通常含有少量常见类型的腺癌成分。免疫组化显示p16、CEA及CK7阳性表达,p53通常为野生型,而浸润性复层黏液性癌可能显示p53突变型,CAⅨ、HNF1β、Napsin A及CDX2可以阳性,ER、PR、vimentin、CK20和SATB2为阴性。
④子宫内膜透明细胞癌转移
子宫内膜透明细胞癌患者平均年龄70岁左右。绝经后出血是最常见的症状。子宫内膜透明细胞癌组织学主要表现为管囊状、乳头状和/或实性混合,胞质透明至嗜酸,细胞立方状、多边形、鞋钉状或扁平状。子宫内膜透明细胞癌组织学形态和免疫组化表达与宫颈原发透明细胞癌相似,因此诊断宫颈原发的透明细胞癌,要结合临床及肿瘤部位排除子宫体和子宫下段来源的子宫内膜透明细胞癌。
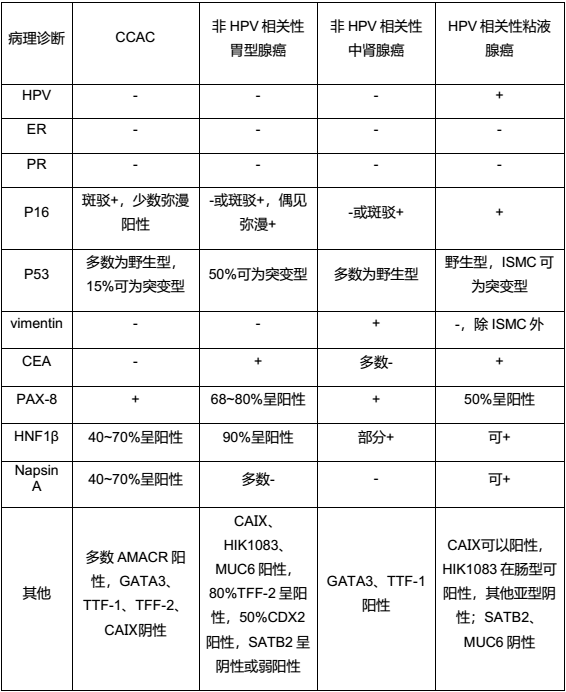
图2. CCAC及其鉴别诊断的免疫组化及HPV表达情况表
4. 治疗及预后
宫颈腺癌影响预后的主要因素包括:临床分期、肿瘤大小、间质浸润、生长模式、核异型性、核分裂像以及淋巴结转移等。透明细胞癌这一类型本身并不是预后不良的因素,除非合并高危因素,如淋巴结阳性、切缘阳性、淋巴管浸润、肿瘤直径>4cm以及>1/3间质浸润。不合并高危因素的早期透明细胞癌患者可仅接受根治性手术治疗,而不需要辅助化疗或者放疗。
宫颈透明细胞癌的临床症状出现较早,约75%的患者得以在早期诊断。目前国际上尚无针对性治疗指南,其治疗主要基于对宫颈鳞癌和普通腺癌的治疗经验。手术是早期透明细胞癌的主要治疗方式,根治性子宫切除+盆腔淋巴结清扫为推荐手术方式。绝大多数进展期子宫颈腺癌都要接受放、化疗联合治疗。此外目前研究比较前沿的治疗方法还包括靶向治疗及免疫治疗。靶向治疗中一类很有治疗前景的靶标是ERBB2(HER2)和ERBB3(HER3),分别编码HER2和HER3蛋白。有研究初步发现,在篮式研究中,部分接受HER2抑制剂的子宫颈癌病人可获得完全/部分治疗反应或者维持病情稳定。此外,PD-L1的表达将来有可能用于免疫治疗的预测性生物标志物。目前两者还未应用于临床,有待于进一步的临床试验来阐明HER2突变及PD-L1表达的预测价值。
参考文献
[1]王遥, 杨佳欣. 非HPV感染相关宫颈腺癌的研究进展[J]. 国际妇产科学杂志, 2018.
[2] WHO Classification of Tumours Editorial Board, et al. Female Genital Tumours [M]. 5thed, lyon: TARC Press, 2020.
[3] Simona Stolnicu, Kay J Park, et al. International journal of gynecological pathology : official journal of the International Society of Gynecological Pathologists 2021 Mar 01;40(Suppl 1):S75-S91 doi:10.1097/PGP.0000000000000751
[4]韩肖燕, 郄明蓉, 曹泽毅,等. 134例原发性宫颈腺癌临床特点及预后分析[J]. 中国医药导刊, 2008, 010(001):2-6.
[5]陈凌, 刘易欣, 赵澄泉. 宫颈胃型腺癌及其谱系病变研究进展[J]. 中华病理学杂志 2020年49卷8期, 861-866页, MEDLINE ISTIC PKU CSCD, 2021.
[6]Tjalling Bosse, Sigurd Lax, et al. International journal of gynecological pathology : official journal of the International Society of Gynecological Pathologists 2021 Mar 01;40(Suppl 1):S102-S110 doi:10.1097/PGP.0000000000000755















共0条评论