胃淋巴上皮瘤样癌( lymphoepithelioma-like gastric carcinoma,LELGC)是胃癌的一类少见组织学亚型。1976年由Watanabe等首次报道并命名,1990年有学者发现LELGC与EBV感染密切相关。WHO(2010)消化系统肿瘤分类将其独立描述,又称伴有淋巴样间质的胃癌(gastric carcinoma with lymphoid stroma)或胃髓样癌。LELGC临床上罕见,目前国内文献多为个案或小宗报道。在临床工作中常被诊断为胃低分化癌,未能单独将其分型。关于其临床病理学特征和淋巴样间质的免疫表型等认识不足,特别是低分化腺癌细胞散在分布于淋巴样间质背景中,容易被误诊为MALT淋巴瘤,故有必要加深对其临床病理形态学特点的认识。笔者曾在临床外检工作碰到1例LELGC,现将临床特征,病理形态学及免疫组化结果,分子检测结果,临床治疗及预后情况,复习相关国内相关文献资料,现汇报如下。
1、病例汇报
患者男,41岁,患者缘于2年前无明显诱因出现胃区疼痛,无反酸及规律性疼痛,自行口服奥美拉唑治疗,于20天前大便呈黑色板油状伴全身乏力,当地医院诊为“上消化道出血”,给予抑酸止血等治疗,于2019年8月5日行胃镜检查示胃体巨大溃疡性病变并取病理检查示:低分化腺癌。为进一步检查及治疗,门诊以胃占位入院。入院完善各项检查,择期在全麻下行剖腹探查及根治性全胃切除术。
送检切除的全胃标本:小弯侧可见一溃疡性肿物,肿物大小6*5*1.5cm,切面灰白色,质中,界尚清。镜下见肿瘤组织多呈推挤式浸润性生长,排列成腺腔或条索状,肿瘤细胞中等大小,多角形或卵圆形,胞质嗜双色性或碱性,核呈空泡状,核膜厚,核仁明显,核分裂象可见;间质见淋巴细胞和浆细胞浸润,可见淋巴滤泡形成(图1-2);周围胃呈慢性萎缩性胃炎;免疫组化结果示肿瘤细胞Cytokeratin(+)(图3),CDX-2、CK20和CK7(-), Her-2 (0),肿瘤细胞增殖指数Ki-67约60%(图7),间质细胞CD138(图6)、CD20(图5)和CD3(图4)(+);分子病理结果示EBER病毒鉴定检测为(+)(图8)。
病理诊断:全胃根治标本-低分化腺癌,溃疡型,间质大量淋巴细胞浸润,符合淋巴上皮瘤样癌(LELGC)。根据病理结果,临床给予静脉化疗,具体方案:奥沙利铂+替吉奥,同时辅以免疫治疗。目前随访至今患者状态尚可。
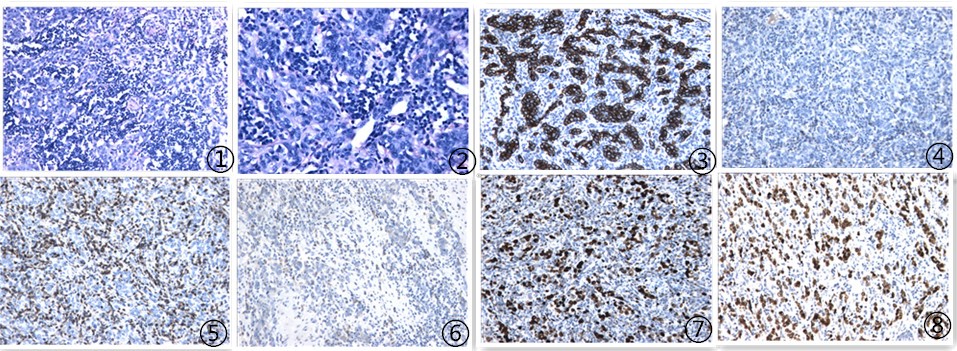
图1 肿瘤组织呈推挤式浸润性生长,排列成腺腔或条索状,间质见淋巴细胞和浆细胞浸润,100倍;图2 肿瘤细胞中等大小,多角形或卵圆形,胞质嗜双色性或嗜碱性,胞核呈空泡状,核膜厚,核仁明显,核分裂象可见,200倍;图3 肿瘤细胞CK弥漫强阳性,EnVision法;图4间质细胞CD3阳性,EnVision法;图5间质细胞CD20阳性,EnVision法;图6 间质细胞CD138阳性,EnVision法;图7肿瘤细胞增殖指数约60%,EnVision法;图8 EBER分子检测阳性
2、讨论
2.1 临床特征
LELGC临床症状与普通型胃腺癌类似,常表现为腹痛伴/不伴呕血、黑便、吞咽不适等,部分病例以呕血伴/不伴黑便为首发症状。好发于中老年人,文献报道发病年龄16-81岁,
平均发病年龄为55-58岁,男性患者多见,其发病率是女性2倍以上,可能与职业或生活习惯有关。LELGC大多数发生在近端胃,部分可见于胃残端,亦可见于胃窦,而传统胃腺癌则好发于胃窦。LELGC占全部胃癌病例1%-4%,且其发病率具有明显地域性差别。
2.2 病理学特征
LELGC大体早期形成境界清楚病灶,后期可呈推挤性浸润生长。肿瘤多为溃疡型,少数为隆起型,也有文献报道为黏膜下肿物。切面灰白或灰红色,质中等,界不清。镜下肿瘤细胞呈条索状或小巢状排列分布,部分排列较为分散性,局部可形成小腺样结构;肿瘤细胞圆形或不规则,胞界不清,胞质少,胞核多呈空泡状,具有明显核仁,核分裂象偶见;背景为显著的淋巴样间质,主要为T淋巴细胞,还有部分B淋巴细胞、浆细胞、NK细胞及树突状细胞,偶可见淋巴滤泡形成;肿瘤间质通常较少有纤维结缔组织反应,常见类似于推挤式的浸润边界。少数LELGC病例可伴有传经典腺癌成分,少数肿瘤内可见出现多量巨细胞反应,甚至伴有肉芽肿结构形成。
免疫组化:LELGC肿瘤细胞同普通型胃癌,淋巴样间质为CD20或CD3阳性的B或T淋巴细胞,CD3阳性T细胞明显多于CD20阳性B细胞,T细胞弥漫性浸润于肿瘤内部和周围,而B细胞主要位于淋巴滤泡内。同时可有数量不等浆细胞和巨噬细胞,浆细胞免疫球蛋白轻链kappa和lambda阳性表达,且无限制性表达证明其为多克隆性。这种混合性淋巴样间质形成特殊的肿瘤微环境是LELGC病理组织形态学特征,与其特殊的临床生物学行为相关,值得我们进一步深入研究探索。
长期以来关于LELGC的认识是模糊不清的,与胃髓样癌、伴有淋巴样间质的胃癌混淆。因此WHO(2019)胃癌最新分类中LELGC并未与胃髓样癌区别,二者均属于富于淋巴样间质的胃癌,但目前认为二者在形态学上是有差异的。LELGC两种组织学形态,一种为肿瘤细胞排列成巢团状;一种为肿瘤细胞单个散在分布。无论哪种组织形态学,肿瘤内部丰富的淋巴样间质是其共同特点,肿瘤细胞边界不规则,呈浸润性生长。而胃髓样癌的病理组织学表现为肿瘤细胞呈片状、巢团状、小梁状合体细胞样排列,大而多角形的肿瘤细胞,胞核呈空泡状,核仁明显,肿瘤边界清楚,呈推挤性浸润生长,淋巴细胞及浆细胞浸润在肿瘤边缘显著。故二者鉴别诊断比较困难。
2.3 鉴别诊断
① 伴普通炎症反应的传统型胃腺癌:肿瘤成分显著多于炎细胞,间质浸润淋巴细胞及浆细胞少,且多为局部性浸润,间质结缔组织增生性明显,不同于LELGC的肿瘤内有弥漫性淋巴细胞浸润。二者肿瘤细胞的分化排列也不同,普通类型胃腺癌细胞排列呈腺管状、乳头状、条索状或弥漫性分布,亦可为黏液性腺癌等成分。根据文献报道LELGC临床预后优于普通型胃腺癌。
② 黏膜相关淋巴组织边缘B细胞淋(mucosa-associated lymphoid tissue,MALT):由于LELGC与MALT淋巴瘤的病理组织学形态类似,故二者鉴别诊断非常必要。后者是胃肠道常见的淋巴瘤,肿瘤细胞位于黏膜固有层,为混合性异型B淋巴细胞,包括边缘区细胞、单核样B细胞、小淋巴细胞和散在的免疫母细胞等,其特征性形态学改变为异型淋巴细胞浸润破坏腺上皮,形成特征性的淋巴上皮样病变。MALT淋巴瘤也常有浆细胞分化,但淋巴细胞有异型性,且常有免疫球蛋白轻链kappa和lambda限制性表达。免疫组化染色可显示局部被肿瘤性淋巴细胞破坏残存的腺体,大部分区域无上皮细胞免疫标记阳性细胞,所以只要在理论上认识这两种肿瘤的病理学特点,细致组织形态学观察和结合免疫组化染色,可准确鉴别这两种形态类似但预后和临床治疗完全不同的肿瘤。最近文献报道了1例皮肤同时发生LELC和MALT,而两种肿瘤细胞混合存在,提示二者存在着某种联系性。
③ 上皮样型恶性黑色素瘤:肿瘤细胞呈巢状或片状分布,细胞黏附性差,细胞卵圆形或梭形,胞核呈空泡状,核仁大而明显,易与LELGC混淆。免疫组化标记物S-100和HMB45 等阳性表达,上皮性标记物CK和CEA阴性,有些胞质中可清晰看到黑色素颗粒沉着。
④ 胃神经内分泌肿瘤:肿瘤细胞呈梁状或巢状排列,可见菊形团等结构,神经内分泌标记物NSE、CgA、Syn等阳性表达。电镜下可见瘤细胞内有神经内分泌颗粒。
⑤ 间变性大细胞淋巴瘤:由一致较大的肿瘤细胞组成,肿瘤细胞可呈上皮样,胞质淡染,核圆形或椭圆,核仁清晰,具有特征性细胞核呈马靴样、分叶状、肾型或胚胎样、“U”字形偏位、核旁胞质红染区,周围伴有反应性淋巴细胞,与LELGC很难鉴别,该肿瘤细胞表达CD30和CD45等标记物,而不表达CK、CEA等上皮标记物,具有诊断意义。
⑥ 肉芽肿性胃炎:因少部分LELGC可见伴巨细胞的肉芽肿结构,肿瘤细胞可类似于上皮样组织细胞,EMA阳性可证实上皮性来源。
⑦ 转移性淋巴上皮瘤样癌:形态学改变与LELGC相似,但转移癌往往从黏膜固有层向黏膜表面生长,肿瘤细胞与胃黏膜上皮无移行关系,表达CK5/6、P40等鳞状细胞癌标记物,在鼻咽部等胃外部位可找到原发病灶。
2.4 病因学
EBV是一种属于疱疹病毒科的嗜淋巴细胞病毒,全球超过90%的成年人可携带此病毒。EBV 与多种淋巴造血系统肿瘤和上皮恶性肿瘤相关,包括传染性单核细胞增多症、Burkitt淋巴瘤、霍奇金淋巴瘤、未分化型鼻咽癌及EBV相关性胃癌。
EBV感染胃黏膜上皮主要有以下几种机制:①EBV直接感染上皮细胞,在上皮细胞内潜伏状态形式存在,随着时间延长或当机体免疫力低下时直接致癌;②与EBV阳性B淋巴细胞融合感染上皮细胞;③经过其他受体介导进入上皮细胞;④通过唾液途径感染。EBV进入宿主细胞后可通过以下机制致瘤:①EBV编码潜伏膜蛋白干扰宿主细胞基因表达,导致癌基因和抑癌基因异常表达。LMP2A通过STAT3磷酸化上调DNA甲基化酶1(DNMT1)表达,导致抑癌基因PTEN启动子甲基化,从而抑制PTEN表达,从而促进肿瘤细胞生长。②EBV编码微小RNA(miRNA),干扰宿主细胞基因表达,促进肿瘤细胞发生。胃黏膜上皮缺乏EBV受体CD21,因此EBV感染胃黏膜的机制目前尚不清楚。近几年分子遗传方面的研究表明LELGC通过EBERs、潜伏膜蛋白2A(latent membrane protein 2A,LMP2A)、BARTs等潜伏基因致瘤,但仍尚待大样本深入研究探索。
大部分文献研究认为LELGC发生与HP感染无关,但也有研究认为EBV更容易感染萎缩或化生的胃上皮细胞而HP感染后的慢性萎缩性胃炎、肠上皮化生则成为EBV感染易感因素。EBV和HP在LELGC发生发展中是否具有协同作用,目前尚有一定的争议性。
此外有研究认为高频微卫星不稳定性(microsatellite instability-high,MSI-H)和LELGC有关,文献报道MSI-H在胃癌中的发生率为7% -39%,且具地域差异性。Chiaravalli 等也证实7例EBV阳性而MSI阴性胃癌主要在近端胃或残胃;组织形态学更类似典型鼻咽部未分化癌,故胃对不同的致癌路径的区域敏感性不同,从而提示EBV和MSI是互不关联因素。
2.5 治疗与预后
目前LELGC尚无特殊治疗方法,治疗同传统型胃腺癌,为内镜下黏膜剥脱术或手术根治切除辅以化疗,尚无抗EBV感染的确切治疗方法。一项研究显示通过诱导受EBV感染上皮细胞自溶可起到间接抗EBV病毒治疗效果,故有望提供治疗一个新选择。化疗及放疗效果有待进一步研究。近年来免疫抑制因子程序性死亡分子-1(programmeddeath-1,PD-1)/程序性死亡分子配体-1(programmed deathligand-1,PD-L1)抑制剂在恶性肿瘤领域已取得显著的进展。新研究发现LELGC存在PD-L1和PD-L2,其与表达PD1的T细胞结合后可启动抑制性通路从而抑制机体抗肿瘤免疫反应。因此PD-1或PD-L1特异性抗体能够阻断PD-1通路从而重新活化T细胞并使其增殖,达到增强抗肿瘤免疫目的。但目前PD-1或PD-L1特异性抗体在患者中的疗效还需进一步的大宗临床试验,而PD-1/PD-L1抑制剂有望成为治疗LELGC一种有效临床手段。
关于LELGC预后文献报道不一。前期研究发现EBV阳性胃癌和EBV阴性胃癌预后无明显差异性。随后有研究认为伴有淋巴间质的进展期胃癌5年生存率较不伴淋巴间质者为高;多中心大样本研究发现,EBV阳性进展期胃癌与临床分期呈负相关,病死率较EBV阴性的胃癌低,提示进展期EBV相关性LELGC临床预后较好。故LELGC具有较传统型胃腺癌较好的预后,低淋巴结转移率是其主要特点,而浸润的CD8阳性T淋巴细胞可能是肿瘤具有低淋巴结转移率的重要原因。
3、EBV相关胃癌
Tokunaga等首次将通过原位杂交技术证实胃癌细胞EBER阳性者定义为EBV相关性胃癌(Epstein Barr virus associated gastric carcinoma,EBVaGC)。EBVaGC组织形态学特点有:①肿瘤以中分化管状腺癌和低分化实体性腺癌为主;②间质大量淋巴细胞浸润;③男性患者高于女性④多见于贲门部、胃底及胃体部等,而少见于胃窦部;⑤早期胃癌中含有特异性花边样图案,这是淋巴细胞在黏膜细胞周围形成的特殊形态。EBVaGC约占胃癌10%,主要有两种组织学亚型:普通型胃癌和LELGC,其中LELGC约占80%。
4、小结
综上所述LELGC是一种罕见的胃癌组织学亚型,具有独特的临床病理组织形态学、分子遗传学、临床预后较传统型腺癌好特点。目前发病机制尚不明确,好发于中老年男性的近端胃。胃LELC镜下多为低分化癌伴有显著的淋巴样间质,EBER原位杂交有助于该病的诊断,其临床预后好于普通型腺癌。正确诊断LELGC有助于对其进一步了解和认识,为病理和临床医师的诊断和治疗提供病理学依据。总之LELGC是一种罕见的具有特殊临床病理学特点的低分化腺癌,可能与EBV感染有关,要正确认识避免误诊。PD-L1高表达等特点,PD-1/PD-L1抑制剂或许是未来治疗LELGC 的一个有效手段。
参考文献
[1]Watanabe H , Enjoji M , Imai T . Gastric carcinoma with lymphoid stroma. Its morphologic characteristics and prognostic correlations[J]. Cancer, 1976, 38.
[2]莫超华, 温宗华, 莫祥兰, et al. 胃原发性淋巴上皮瘤样癌6例临床病理学观察[J]. 临床与实验病理学杂志, 2015(2):154-156.
[3]陈瑚, 蒋逸婷, 陈永钦,等. 胃淋巴上皮瘤样癌27例临床病理分析[J]. 临床与实验病理学杂志, 2017, 033(009):1016-1018.
[4]陈玲, 郭双平, 郭勇,等. 胃淋巴上皮瘤样癌15例临床病理分析[J]. 诊断病理学杂志, 2016(6):406-410.
[5]陈丽蓉, 罗忠光. EB病毒相关的胃淋巴上皮样癌的机制研究和治疗进展[J]. 国际消化病杂志, 2019, 039(001):13-16,35.
[6]缪俊俊, 刘标. 原发性肺淋巴上皮瘤样癌1例报道[J]. 诊断病理学杂志, 2019(7).
[7]陈红, 金木兰, 谢燕,等. 原发性肺淋巴上皮瘤样癌临床病理观察[J]. 诊断病理学杂志, 2015, v.22(11):62-65.
[8] 孙琦, 苏勤军, 王彩莹,等. EB病毒相关性胃腺鳞癌1例[J]. 诊断病理学杂志 2021年28卷1期, 13,18页, ISTIC.
[9]张爽, 王潇飞, 罗丹,等. 胃淋巴上皮瘤样癌5例报道[J]. 诊断病理学杂志, 2020(7).
[10]刘峰, 郭霞, 干文娟. 胃淋巴上皮瘤样癌6例的临床病理特征[J]. 江苏医药, 2018, 44(10):1133-1135.
[11]陈远钦, 林慧, 康锶鹏,等. 胃淋巴上皮瘤样癌12例临床病理分析[J]. 诊断病理学杂志, 2014.
[12] Shinozakiushiku A , Kunita A , Fukayama M . Update on Epstein-Barr virus and gastric cancer (review).[J]. Editions en langues Étrangères, 2015.
[13] Junhun C , Kang M S , Kyoung-Mee K . Epstein-Barr Virus-Associated Gastric Carcinoma and Specific Features of the Accompanying Immune Response[J]. Journal of Gastric Cancer, 2016, 16(1):1-7.














共0条评论