1、概述
肾细胞癌(renal cell carcinoma,RCC)为最常见发生于肾实质的恶性肿瘤,约占肾脏原发性恶性肿瘤的85%-90%,占全身恶性肿瘤3%左右,国内RCC发病率位居泌尿系统肿瘤第2位,仅次于膀胱癌。其典型临床三联征表现为:血尿、腹痛及腹部肿块等,当出现典型症状时,多达30%患者确诊时已为临床中晚期。临床治疗多以手术切除为主,对放化疗均不敏感,患者5年生存率仅为12%。
琥珀酸脱氢酶(succinate dehydrogenase,SDH)又称琥珀酰辅酶Q还原酶,是线粒体复合物Ⅱ中的一种复合酶,是三羧酸循环和有氧电子传递呼吸链的交叉点,其在三羧酸循环中催化琥珀酸盐氧化为延胡索酸盐,并参与电子转运链,从而在细胞代谢中扮演着重要的角色。SDH由黄素酶SDHA(the flavoprotein SDHA)、硫酸化铁酶SDHB(the ironsulfur protein SDHB)、整合膜蛋白SDHC(the integral membrane protein SDHC)和整合膜蛋白SDHD(the integral membrane protein SDHD)4个亚单位构成,可将其合称为SDHx,分别由相应核基因编码,其中SDHA和SDHB是亲水蛋白,形成酶催化域中心,而SDHC和SDHD是疏水蛋白,可将SDH四聚体复合物锚定于线粒体内膜上,同时也是辅酶Q的结合位点。此外SDH也是一种公认肿瘤抑制基因。SDH复合物中任何一个亚单位缺失都会造成该复合物不稳定性,从而影响其生理功能。
SDH基因突变与家族性副神经节瘤(paragan gliomama synddrome types,PGL)综合征相关。PGL综合征是常染色体显性遗传综合征,患者及其家属罹患多种SDH缺陷相关的肿瘤的危险性增高,主要表现为副神经节瘤、嗜铬细胞瘤、胃肠道间质瘤、肾细胞癌和垂体腺瘤等家族性疾病。2017年WHO神经内分泌系统肿瘤分类中PGL分为5种类型,其中PGL1为SDHD基因突变,PGL2和PGL5为SDHA基因突变,PGL3为SDHC基因突变,而PGL4为SDHB基因突变,SDH各亚单位突变都会导致SDHB蛋白表达缺失,故该基因突变最为常见,其次为SDHC,而SDHA和SDHD突变非常罕见。
近15年文献导报发现SDH缺陷型肿瘤主要包括15%副神经节瘤、7%-9%胃肠道间质瘤、不足1%肾细胞癌及垂体腺瘤等。此外研究报道SDHA基因突变与胃肠道间质瘤发生有关;SDHB基因突变与腹部和头颈部副神经节瘤及肾癌密切相关;SDHC基因突变与头颈部副节瘤和肾癌有关;而SDHD突变与头颈部和腹部副节瘤、肾上腺嗜铬细胞瘤及胃肠道间质瘤等肿瘤相关。此外文献研究发现SDHB基因突变罹患肾细胞癌风险率为14%。
2、临床特征
SDH缺陷型肾细胞癌(succinate dehydrogenase deficient renal cell carcinoma,SDH-RCC)由Vanharanta等于2004年首次报道,2012年国际泌尿病理协会(International Society of Urological Pathology,ISPU)肾肿瘤分类中将其列为暂定的肾细胞癌特殊亚型。WHO(2016)肾肿瘤分类将其归入RCC独特亚型。SDH-RCC中以SDHB缺陷型最常见,而SDHC、SDHD、SDHA缺陷型文献报道较少。
SDH-RCC占所有肾细胞癌的0.05%-0.2%,患者发病年龄通常低于普通型RCC,以年轻人多见。Williamson等研究发现10例患者的年龄为22-72岁,平均40岁,Gill等归纳分析15个研究中心27例患者的临床病理学资料,其中7例患者出现双侧肾癌,而4例患者在同一肾脏多发肿瘤病灶,患者平均发病年龄37岁。男性略多于女性,男女比为1.8:1,以单侧肾脏多见,30%患者可为多灶性或双侧。该肿瘤呈高度遗传相关性,可有其它SDH缺陷型肿瘤的个人史或家族史。
3、病理特征
Williamson等报道该肿瘤无肾周脂肪或肾窦侵犯。肉眼观肿瘤界限较清,切面灰红或灰褐色;多呈实性,可伴有出血及囊性变,30%病例双侧肾脏发生。肿瘤界限较清,呈小叶状推挤性边缘,偶可见假包膜;组织形态学结构多样性,可呈巢状、小管状、腺泡状或实性结构等排列,亦可伴囊性变,呈微囊或巨囊状;形态学特征性表现为肿瘤细胞呈立方状或卵圆形,胞质丰富,轻度嗜酸性且不均匀,典型胞质空泡或包涵体,嗜酸性液体或絮状物呈空泡状或羽毛状改变(电镜超微结构包涵体为巨大线粒体);胞核较为一致,呈圆形,核膜光滑,染色质细腻,核仁不明显;胞核多为低核级(WHO/ISPU分级1-2级),少部分为高核级甚至肉瘤样变,表现为细胞核增大且深染、胞核异型性明显,核仁粗大,病理性核分裂象易见,常见凝固性坏死;当肿瘤去分化时可表现为实性生长的肿瘤细胞巢,胞质内空泡大小不一和呈高级别胞核,当出现肉瘤样分化和坏死时则提示该肿瘤预后较差;肿瘤间质内常见肥大细胞;间质可出现纤维化、透明样变、出血及骨化等,而凝固性坏死罕见。
文献报道SDHC、SDHD缺陷型RCC多同时伴发其它肿瘤。肿瘤虽可表现为多种RCC组织学表现,但经常显示透明细胞肾细胞癌的形态学表现,常为低核级肿瘤,个别可表现为乳头状肾细胞癌。肿瘤特征性表现为出现含有嗜酸性液体或絮状物的嗜酸性胞质包涵体。SDHA缺陷型RCC报道更少,患者多无SDH相关肿瘤家族史,患者年龄较大,肿瘤细胞呈乳头状、小管状、筛状或实性片状在硬化性间质中呈浸润性生长,具有明显淋巴浆细胞浸润形态学特征;肿瘤细胞含有高级别核及大量嗜酸性胞质;该肿瘤侵袭性较高,肿瘤性坏死及淋巴脉管浸润多见。
大多数肿瘤细胞特征性SDHB抗体表达缺失,少数为SDHC缺失,罕见为SDHA或SDHD缺失,判断SDH表达时需与周围正常肾组织作阳性内对照。其它免疫组化染色标记物诊断价值有限,超过50%病例肿瘤细胞CK阴性,极少数CK7呈阳性,PAX8等可弥漫阳性表达;大部分病例CD117、RCC、CAIX及Vimentin均为阴性;而ksp-cadherin阳性表明肿瘤可能起源于远端肾单位。
4 、鉴别诊断
SDH-RCC需与以下肾癌类型进行鉴别诊断,如透明细胞肾细胞癌、嫌色性肾细胞癌、肾嗜酸细胞腺瘤、肾嗜酸细胞腺瘤病、嗜酸性细胞癌/嫌色细胞癌混合型、获得性囊性病相关的肾细胞癌、Birt-Hogg-Dubé综合征相关肾细胞癌、遗传性平滑肌瘤病肾细胞癌综合征和PTEN错构瘤综合征等。
①肾嗜酸细胞瘤:一类少见良性肿瘤,由嗜酸性圆形或多角形细胞排列呈各种形态学结构。SDH缺陷型RCC通常不出现大的圆形肿瘤细胞巢分散于透明样或水肿样间质背景中,退变异形性肿瘤细胞较为少见。典型胞质空泡及嗜酸性絮状包涵体有助于二者鉴别诊断,明显肿瘤内肥大细胞是诊断线索。免疫组化标记物CDll7阳性和SDHB阴性支持该肿瘤诊断。
②嫌色细胞癌嗜酸亚型:肿瘤通常由淡染及嗜酸性植物样细胞呈实性巢状排列分布,肿瘤细胞边界清楚,被纤细血管分隔,细胞核不规则,具有核周空晕,有时可见双核,特征性的葡萄干样皱缩胞核具有诊断意义,免疫组化标记物及胶质铁特殊染色有助于两者的鉴别。
③透明细胞肾细胞癌:该肿瘤最为常见,通常由透明肿瘤细胞组成,组织形态学结构多样性。当肿瘤细胞胞质明显呈嗜酸性,并呈巢状生长方式,可与SDH-RCC混淆,免疫组化标记物CAIX、CD10及Vimentin等通常呈弥漫阳性表达,而SDHB为阴性。
④XP11.2易位相关RCC:在WHO(2016)新增肾细胞癌类型中与t(6;11)肾癌归入MiT家族易位性肾细胞癌。该肿瘤见于儿童和年轻人,主要由透明细胞构成乳头样结构,常伴有嗜酸性颗粒胞质的肿瘤细胞组成的巢状结构,伴有沙砾体形成,但一致的嗜酸性胞质的肿瘤细胞不是其典型特点,肿瘤通常弥漫强表达TFE3,基因学检测有助于鉴别诊断。但有文献报道SDH-RCC病例可同时伴有TFE3过表达和TFE3基因易位,由于病例数较少,SDHB表达缺失和TFE3过表达是否存在一定的相关性,TFE3过表达是否与SDH-RCC去分化和转移有关,还有待更多病例的深入研究。
5 、遗传学分析
Gill等对17例SDH-RCC患者进行种系SDH测序,均发现SDH种系突变,其中16例为SDHB突变,1例为SDHC突变。Williamson等研究11例SDH-RCC患者也均有SDHB基因突变。2015年Yakirevich等对1例SDHA-RCC进行基因测序,发现染色体5p15上17kbp的SDHA同型缺失,同年OZLUK等也有相似文献报道。总之SDH基因任何亚基突变都会导致SDHB表达丢失,而SDHA突变导致SDHB及SDHA表达均丢失,SDHB、SDHC、SDHD突变仅显示SDHB染色丢失,而SDHA染色阳性。该现象目前尚未十分清楚。
目前关于SDH基因突变与肿瘤形成的具体分子机制尚不甚明确,主要有两种学说:其一凋亡学说认为SDH突变可能通过抑制线粒体参与凋亡过程导致肿瘤形成;其二氧传感学说认为肿瘤发生根本原因是传感环境中氧水平的功能缺陷:一方面SDH基因突变使SDH复合体发生功能障碍时氧化磷酸化过程不能正常进行,从而产生大量活性氧而导致肿瘤发生;另一方面由于SDH催化底物琥珀酸在线粒体基质中积聚并抑制脯氨酸羟化酶的活性,进而活化缺氧诱导因子使HIF1α羟化减少,进而激活细胞缺氧信号通路,该通路通过调节血管生成方式、葡萄糖代谢途径、细胞增殖或凋亡过程,从而促进了肿瘤发生与发展。
6、治疗及预后
75%SDH-RCC常为低级别肿瘤,患者临床预后较好。对于SDH-RCC的治疗方式,目前尚无循证医学指南参考。如肿瘤处于早期或体积较小可选择保留肾单位手术,包括肾部分切除术或肿瘤消融治疗。对于高级别肿瘤由于转移风险较高,所以行根治性肾切除术+术后化疗。PAIK等报道一例SDHB-RCC对舒尼替尼有效,为未来靶向治疗提供潜在可能性。虽然目前尚无化疗对于播散或转移性病例有效的证据,Gill等对转移性病例分析发现转移性病例肿瘤细胞有明显异型性、高级别核、出现肉瘤样变及凝固性坏死等。由于患者后期可能发生转移,因此有必要对患者进行长期随访。
此外因某些SDH-RCC可能是一种系统性疾病,因此建议对其它综合症候表现患者进行定期随访,应注意针对嗜铬细胞瘤、副神经节瘤、胃肠道间质瘤、垂体腺瘤等进行必要筛查。在临床诊疗中针对年轻患者,应详细询问患者有无肿瘤家族史,必要时行基因检测明确诊断,有利于指导临床治疗决策。Gill等曾报道27例SDH-RCC中有4例患有SDH缺陷型胃肠间质瘤,有4例有副神经节瘤。该研究中5例一级亲属患有肾癌病史,5例一级亲属和2例二级亲属有嗜铬细胞瘤/副神经节瘤病史,1例一级亲属与SDH缺陷型胃肠间质瘤相关。因此在SDH-RCC患者的亲属在必要时也应纳入监测。
综上由于RCC中SDHx缺陷型患者所占比例极低,目前报道病例较少,尚无大宗随访队列研究文献报道,因此仍需要更多的研究资料来分析其临床病理学特征。
7 、SDH缺陷型 GIST
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是胃肠道最常见的间叶源性肿瘤。大部分病例具有CKIT或血小板源性生长因子受体α(PDGFRA)基因突变,而约85%儿童GIST和15%成人GIST未发现CKIT或PDGFRA基因突变,从而被称作KIT/PDGFRA野生型GIST。野生型GIST又被分为SDH缺陷型和非SDH缺陷型两个亚型。SDH缺陷型GIST主要包括Carney三联征、Carney-Stratakis 综合征、儿童型GIST、神经纤维瘤病Ⅰ型相关GIST及少数散发性GIST。其中Carney三联征包括副神经节瘤、GIST及肺软骨瘤,好发于女性及青年人的非遗传性疾病,目前研究认为Carney三联征发生与SDH基因突变无关,主要与SDHC基因启动子甲基化有关。研究发现SDHC基因启动子甲基化导致其 mRNA表达水平降低,蛋白印迹检测示SDHB及SDHC蛋白均不表达。因此SDHB及SDHC免疫组化标记物染色阴性可考虑Carney三联征可能性,应建议进一步进行分子基因学检测。Carney-Stratakis 综合征是一种常染色体显性遗传疾病,表现为家族性胃GIST和副神经节瘤,男女发病比例相当,好发于青少年,其发生主要与SDHB、SDHC及SDHD基因突变有关,而SDHA基因突变极少见,均表现为SDHB免疫组化标记物染色阴性。
SDH缺陷型GIST是野生型GIST中最常见一种类型,约占GIST的7.5%。文献报道SDH 缺陷型GIST好发于儿童和年轻人,平均发病年龄23岁,多发生于胃部,但倾向于胃窦和幽门,尚无发生于肠道病例报道。临床表现无特征性,多数患者表现为胃肠道出血及上腹部不适,少数情况下以腹腔或肝脏转移灶就诊。肿瘤呈由条索状或实性片巢状排列,边界不规则,呈丛状或多结节状穿插于平滑肌间生长,肿瘤细胞类型以上皮样细胞型为主,混合细胞型和梭形细胞型少见,肿瘤细胞呈轻至中度异型,核分裂象易见,个别病例甚至可伴有出血坏死等形态,早期易发生淋巴结及肝脏转移。
免疫组织化学标志物CD117和DOG-1常为中强阳性表达常表达CD34,极少表达SMA等。SDHA标记缺失时提示SDHA亚单位突变。此外SDH缺陷型GIST常高表达胰岛素样生长因子受体1R(IGF1R)。SDH缺陷型GIST约半数病例涉及SDH亚单位突变,其中SDHA突变者约占30%,其他突变各约占20%。国外学者从基因水平对SDHx缺陷型肿瘤SDHx亚单位进行检测发现任何一个亚单位发生基因突变,均会导致SDHB蛋白缺失,从而表现为SDHB免疫组化标记物染色阴性,但当SDHB、SDHC及SDHD 发生基因突变时,SDHA免疫组化标记物染色仍为阳性,其发生机制尚不甚清楚。
治疗上GIST主要以手术切除和区域淋巴结清扫为主,对不能耐受手术及中高危险度患者预防术后复发则采用酪氨酸激酶抑制剂甲磺酸伊马替尼和苏尼替尼,但SDH缺陷型GIST对甲磺酸伊马替尼治疗不敏感,PDGFRA抑制剂(如帕唑帕尼及瑞格非尼)、针对IGF1R抑制剂、热休克蛋白抑制剂和免疫治疗已处于临床试验阶段。筛选出SDH缺陷型GIST临床意义主要在于对Carney三联征及Carney-Stratakis综合征中其他肿瘤的预测以及行基因检测,评估其是否具有家族遗传性,从而指导临床更有针对性地进行治疗方案。
值得注意的是经典GIST风险评估指标(包括肿瘤体积、核分裂象计数及肿瘤细胞增殖指数)并不适用于该肿瘤,核分裂象多少与肿瘤发生转移的风险无明确关系,即使发生转移也可生存较长时间。此外由于SDH缺陷型肿瘤常为异时性发生,SDH缺陷型GIST多呈惰性发展,故需对患者应进行长期随访。
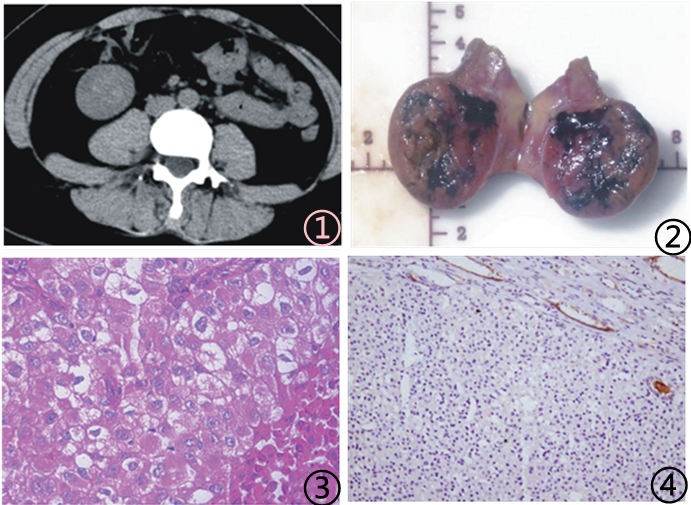
图1 CT影像学平扫呈等密度影,密度欠均匀;图2 大体类圆形,包膜完整,切面呈灰白间灰红色,实性质中,局部见出血;图3高倍镜下肿瘤细胞异型明显,核仁粗大,核分裂象易见,细胞界限不清,胞质丰富红染,见空泡含絮状嗜酸性分泌物;图4免疫组化标记物SDH(-),周边正常组织阳性对照;图片来自于参考文献6,8,9,如有侵权,请联系删除。
参考文献:[1] Vanharanta S , Buchta M , Mcwhinney S R , et al. Early-onset renal cell carcinoma as a novel extraparaganglial component of SDHB-associated heritable paraganglioma.[J]. American Journal of Human Genetics, 2004, 74(1):153-159.
[2] Williamson S R , Eble J N , Amin M B , et al. Succinate dehydrogenase-deficient renal cell carcinoma: detailed characterization of 11 tumors defining a unique subtype of renal cell carcinoma[J]. Mod Pathol, 2015, 28(1):80-94.
[3] Gill A J , Hes O , Papathomas T , et al. Succinate dehydrogenase (SDH)-deficient renal carcinoma: a morphologically distinct entity: a clinicopathologic series of 36 tumors from 27 patients.[J]. American Journal of Surgical Pathology, 2014, 38(12).
[4]张冬梅, 魏建国. 琥珀酸脱氢酶缺陷型肾细胞癌的临床病理及研究进展[J]. 临床与实验病理学杂志, 2017, 06(v.33):77-79.
[5]田佳, 莫文法, 陆文恺,等. 琥珀酸脱氢酶B缺陷相关的肾细胞癌转移至颈部一例[J]. 中华病理学杂志, 2018, 047(008):641-642.
[6]武静, 成元华, 张亚娟,等. 琥珀酸脱氢酶缺陷型肾细胞癌的临床病理特征[J]. 实用医学杂志, 2019, 035(014):2304-2307.
[7]张亚娟, 成元华, 郭立新,等. 琥珀酸脱氢酶缺陷型胃肠道间质瘤中琥珀酸脱氢酶各亚单位蛋白的表达情况[J]. 中华病理学杂志, 2018(4):252-257.
[8]赵媛, 陈红, 金木兰. 琥珀酸脱氢酶缺陷型肾癌1例并文献复习[J]. 临床与实验病理学杂志, 2019(12).
[9]林昊, 李浩然, 谭万龙. 琥珀酸脱氢酶缺陷型肾癌1例[J]. 解放军医学院学报 2020年41卷1期, 81-83页, ISTIC CA, 2020.
[10] Gill A J , Hes O , Papathomas T , et al. Succinate dehydrogenase (SDH)-deficient renal carcinoma: a morphologically distinct entity: a clinicopathologic series of 36 tumors from 27 patients.[J]. American Journal of Surgical Pathology, 2014, 38(12).
[11]罗维洁, 成元华, 刘辉. 肾细胞癌中琥珀酸脱氢酶亚单位A和B蛋白的表达缺失[J]. 实用医学杂志, 2017, 33(015):2545-2549.
[12]A Calió, Grignon D J , Stohr B A , et al. Renal cell carcinoma with TFE3 translocation and succinate dehydrogenase B mutation[J]. Mod Pathol, 2017.
[13]刘绮颖, 陈彤箴, 王坚. 琥珀酸脱氢酶缺陷型胃肠道间质瘤一例[J]. 中华病理学杂志, 2015, 44(009):675-676.














共0条评论