1、病例展示
病例1:患者,女,77岁,主诉诊断淋巴瘤6年4月,白血病2月半。
患者腰痛及左下腹痛,PET-CT示左侧锁骨上区、腹膜后、肠系膜淋巴结肿大,考虑为淋巴瘤;颈部肿大淋巴结穿刺活检病理检查结果:弥漫大B细胞淋巴瘤,非生发中心。予2疗程R-CHOP化疗方案,因间质性肺炎暂停化疗。复查胸部CT提示右肺下叶外基底段胸膜下可见一不规则软组织影,边缘分叶,密度均匀,在超声引导下行右肺病灶穿刺活检术。
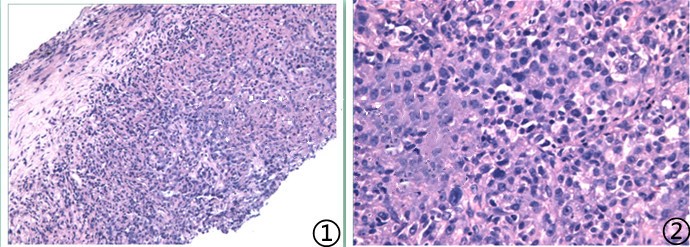
图1低倍镜下可见异型性淋巴细胞,图2高倍镜下肿瘤细胞体积大,异型性明显,胞浆少,胞核卵圆形,部分可见大核仁。
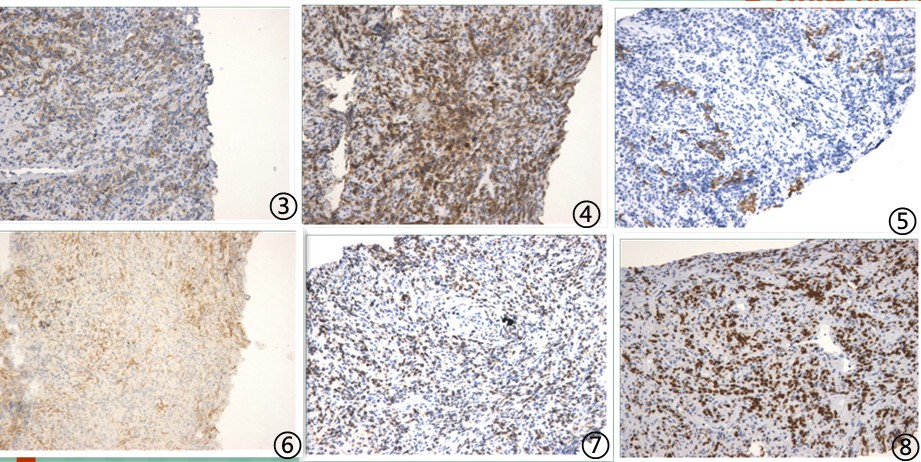
图3肿瘤细胞CD20阳性,图4肿瘤细胞CD79a阳性,图5肿瘤细胞CK阴性,图6肿瘤细胞CD10阴性,图7肿瘤细胞CD3阴性,图8肿瘤细胞增殖指数高,Ki67约40%,
免疫组化结果示肿瘤细胞CD20、CD68、LCA、PAX-5、Bc1-6、Bcl-2、CD79a、MUM-1、CD21、CD23呈阳性表达;肿瘤细胞CD3、CD34、CD4、CD8、Cytokeratin、TdT、CD10、CD15、CD30、CD5、CD45RO为阴性;肿瘤细胞增殖指数Ki-67约40%。
最终诊断:肺组织内见大量中等偏大的淋巴样细胞浸润性生长,细胞异型性明显,胞核卵圆形,部分胞核内可见大核仁,胞浆较少,免疫组化示符合弥漫大B细胞淋巴瘤,非生发中心来源。
患者全身转移,后因化疗后感染,全身系统衰竭,抢救无效死亡。
病例2:男,75岁,反复高热,查CT示肺结节,送检(肺)灰白色条索状组织2条,长分别为0.5cm和1cm,直径0.1cm。
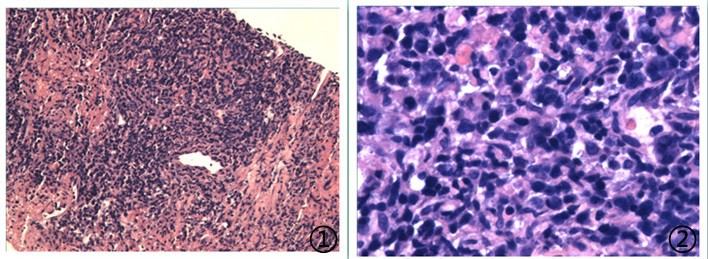
图1低倍镜下可见异型性淋巴细胞,图2高倍镜下肿瘤细胞异型性大,核分裂象可见。
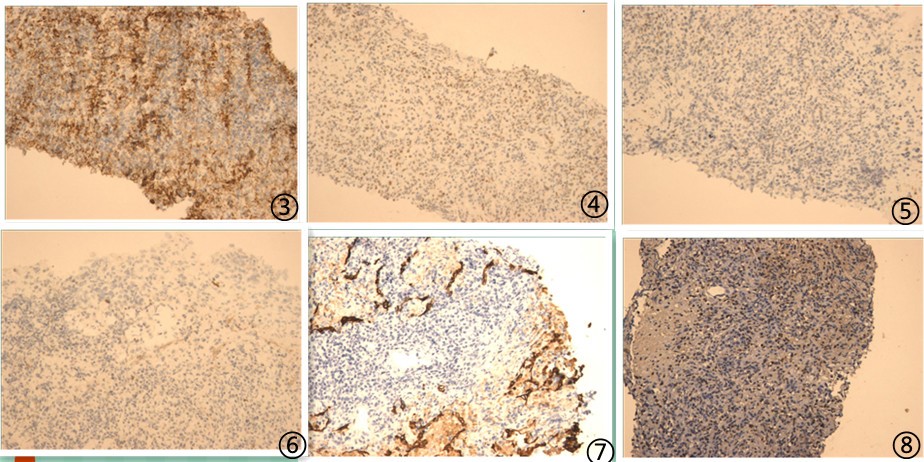
图3肿瘤细胞CD20阳性,图4肿瘤细胞PAX5核阳性,图5肿瘤细胞CD3阴性,图6肿瘤细胞CD10阴性,图7肿瘤细胞CK阴性,图8肿瘤细胞EBER检测散在阳性。
免疫组化结果示肿瘤细胞CD20、CD21、CD23、CD38、CD68、LCA、MUM-1、PAX-5、TIA-1、Vimentin呈阳性表达;肿瘤细胞Bc1-6、Bcl-2、CD10、CD15、CD3、CD30、CD56、CXCL-13、MPO、TTF-1、Cyclin D1、Cytokeratin、granzymeB呈阴性;肿瘤细胞增殖指数Ki-67约50%;分子病理结果显示EBER散在阳性。
最终诊断:肺组织内见淋巴样组织浸润伴显著坏死,淋巴样组织以中等大小淋巴样细胞为主,细胞异型性显著,核分裂象可见,免疫组化符合EBV阳性弥漫大B细胞淋巴瘤,非生发中心来源。
病例3:患者,女,26岁,门诊病人,送检(肺)灰白色条索状组织1堆,大小共为0.4*0.2*0.1cm。
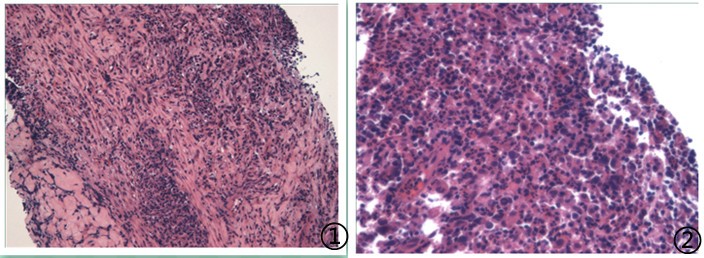
图1低倍镜下可见淋巴细胞浸润,图2高倍镜下在小淋巴细胞及嗜酸性粒细胞背景下散在较多中等大小淋巴样细胞,细胞呈卵圆形,核深染。
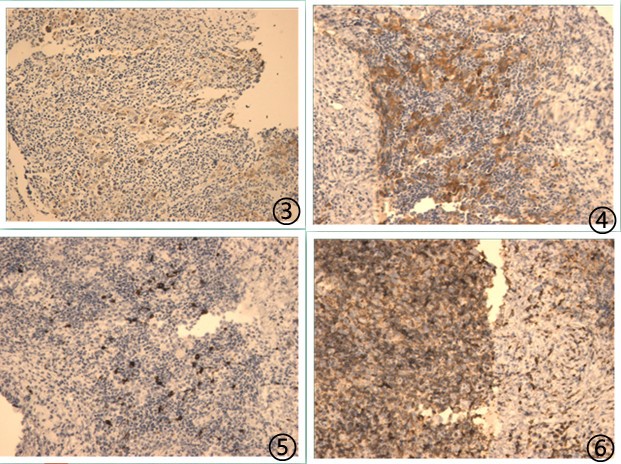
图3大肿瘤细胞CD15阳性,图4大肿瘤细胞CD30阳性,图5大肿瘤细胞CD20阴性,图6大肿瘤细胞CD3阴性。
免疫组化结果示:CD15、CD30、CD68、MUM-1、PAX-5呈阳性表达;肿瘤细胞ALK、CD20、CD3、CD1a、Cytokeratin、S-100呈阴性;肿瘤细胞增殖指数Ki-67约10%;
最终诊断:纤维组织中见淋巴样组织灶性浸润,高倍镜下可见在小淋巴细胞及嗜酸性粒细胞背景下散在较多中等大小淋巴样细胞,细胞呈卵圆形,核深染,免疫组化支持为经典霍奇金淋巴瘤,结节硬化型。
病例4:患者,男,79岁,发热,肺部阴影,送检(左肺)灰白条索状组织2条,长1.3cm,直径0.1cm。
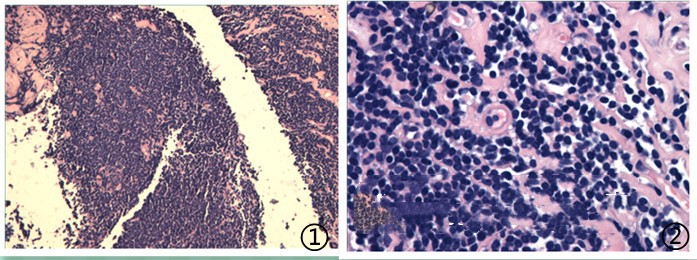
图1低倍镜下可见小淋巴细胞样肿瘤细胞,图2高倍镜下肿瘤细胞大小较一致,圆形,胞核染色质细腻。
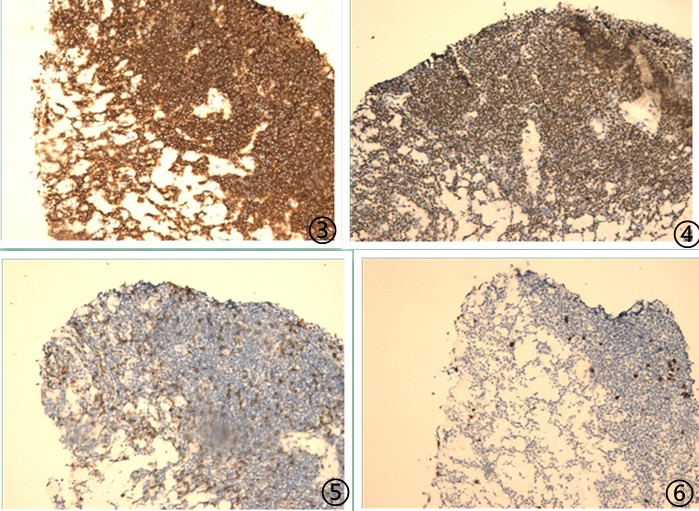
图3肿瘤细胞CD20阳性,图4肿瘤细胞PAX5核阳性,图5肿瘤细胞CD3阴性,图6肿瘤细胞增殖指数Ki67约5%。
免疫组化结果示肿瘤细胞Bcl-2、CD20、CD21、CD23、PAX-5呈阳性表达;肿瘤细胞Bc1-6、CD117、CD10、CD3、CD30、CD43、CD57、Cyclin D1、MPO、MUM-1、TIA-1、TdT、granzymeB、pan-CK呈阴性;肿瘤细胞增殖指数Ki-67约5%;分子病理结果示EBER病毒检测阴性。
最终诊断:大量小淋巴样细胞弥漫浸润性生长,肿瘤细胞大小较一致,圆形,胞核染色质细腻,结合免疫组化表型考虑为结外边缘区B细胞淋巴瘤。
病例5 :患者,女,65岁,送检(?侧肺)灰白条索状碎组织1堆,大小0.5*0.5*0.2cm。
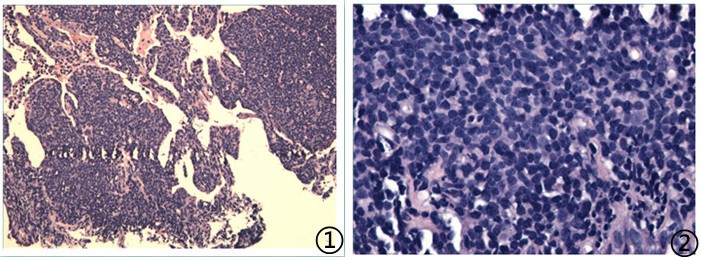
图1低倍镜下小淋巴样细胞弥漫浸润性生长,局部间质胶原纤维增生伴玻璃样变性,图2高倍镜下细胞核卵圆形,染色质丰富,核仁不明显,未见明确核分裂象。
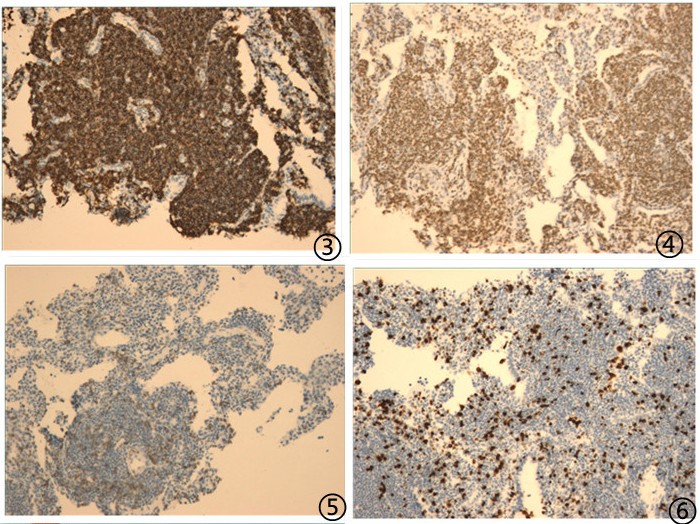
图3肿瘤细胞CD20阳性,图4肿瘤细胞PAX5核阳性,图5肿瘤细胞CD3阴性,图6肿瘤细胞增殖指数Ki67约5%。
免疫组化结果示肿瘤细胞Bcl-2、CD20、CD21、CD23、CD43、CD5、Pax-5、TIA-1、Vimentin呈阳性表达;肿瘤细胞Bc1-6、CD10、CD15、CD3、CD30、CD38、CD56、CD68、Cyclin D1、Cytokeratin、MPO、NSE、TTF-1、TdT、granzymeB呈阴性;肿瘤细胞增殖指数Ki-67约5%。
最终诊断:大量小淋巴样细胞弥漫浸润性生长,胞核卵圆形,染色质丰富,核仁不明显,未见明确核分裂象,局部间质胶原纤维增生伴玻璃样变性,结合免疫组化表型倾向结外边缘区B细胞淋巴瘤。
2、讨论
2.1 概述
原发性肺淋巴瘤(primary pulmonary lymphoma,PPL)少见,定义为来源于肺实质或支气管的淋巴瘤,伴或不伴肺门淋巴结浸润,仅占全部淋巴瘤的0. 4%,占结外淋巴瘤的3. 6%,Sugarbaker和Craver于1940年首次报道。多数为黏膜相关淋巴组织 ( mucosa-associated lymphoid tissue,MALT) 淋巴瘤,约占70%-90%;其次为弥漫性大B细胞淋巴瘤( diffuse large B cell lymphoma,DLBCL),约占5% -20%。由于该肿瘤常无特异性临床及影像学改变,临床易被诊断为肺淋巴组织增生性病变或其他肿瘤。PPL临床诊断标准为无肺外病变,即单侧或双侧肺叶受累,伴或不伴肺门或纵隔淋巴结受累,伴或不伴胸壁受累。根据WHO(2015)肺肿瘤分类将PPL分为6类:MALT、DLBCL、淋巴样肉芽肿、血管内大细胞淋巴瘤、肺朗格罕组织细胞增生症及Erdheim-Chester病等。
2.2 肺MALT
MALT由Isaacson P和Wright DH于1983年提出,定义为一种起源于结外黏膜相关淋巴组织的淋巴瘤,其恶性程度较低,对多种治疗手段有效,临床预后好,患者5年生存率多90%以上。肺MALT起源于支气管黏膜的边缘带B细胞,为一种罕见性惰性淋巴瘤,发病率约占原发肺恶性肿瘤的0.5%,有独特的病因学、发病机制、病理形态学特征和临床预后特征。发病机制尚不清楚,致病危险因素如吸烟、吸入石棉、有机溶剂,慢性感染、自身免疫性疾病、间质性肺炎、视网膜血管炎性疾病、免疫抑制剂及器官移植。目前认为其发病原因可能与长期持续性感染或自身免疫性疾病有关,初始淋巴细胞增生往往是由于生理性抗原刺激所产生,但随着疾病的发展,特定致病因素最终导致不依赖抗原的淋巴细胞单克隆性增殖。
肺MALT淋巴瘤罕见,女性多见,主要见于成年人,中位发病年龄60岁,也可见于免疫抑制及HIV感染的年轻人。原发性肺MALT淋巴瘤的临床表现不典型,文献报道37%患者无症状或偶然发现,63%的患者有呼吸道症状,常表现为咳嗽、轻度呼吸困难、胸痛、乏力和消瘦等非特异性症状。实验室检查β2球蛋白往往较高,目前认为β2球蛋白升高是影响预后的重要因素之一。乳酸脱氢酶及丙氨酸氨基转移酶较少表现异常,肿瘤标志物CA125、CA19-9、CA15-3等有升高的可能,但无特异性。
目前诊断肺MALT淋巴瘤仍需组织病理学检查,免疫组化是诊断的关键。肺MALT淋巴瘤的病理组织学标准如下: ①淋巴细胞在上皮内浸润形成淋巴上皮病变,出现反应性淋巴滤泡,肿瘤性滤泡可与之同时存在,而形成滤泡克隆化。具有边缘区细胞、单核细胞样B细胞、小淋巴样细胞等,核分裂象少见。②免疫表型表达B 细胞相关抗原,而CD5、CD10、CD23、Cyclin-D1、BCL2阴性;Ki-67增殖指数介于5%-25%。③IgH或IgK基因重排聚合酶链反应法检测提示B细胞克隆性增生,但只有约60%的敏感性,遗传学检查最常发现 t(11;18)(q21 ;q21)和3号染色体三倍体(+3)。肺MALT 淋巴瘤病理形态及免疫组化表达均缺乏特异性,诊断时需与以下疾病鉴别:①肺炎症性病变;②肺小细胞癌;③其他小B细胞性淋巴瘤:如套细胞性淋巴瘤,滤泡性淋巴瘤和小淋巴细胞性淋巴瘤等。
肺MALT淋巴瘤具有惰性生长特征,有的可自行消退,无需任何治疗;亦有主张进行积极治疗。肺MALT淋巴瘤单发病灶可以手术治疗,如果无手术指征,化疗也可取得较好的治疗效果。化疗方案大多采用CHOP或R-CHOP方案。肺MALT淋巴瘤病程长,进展缓慢,短期内不会发生肺外侵犯,临床预后较好。
2.3 肺DLBCL
DLBCL是淋巴瘤最常见的类型,肺原发性或继发性DLBCL均不常见,尤其继发性肺DLBCL在临床表现及影像学方面与肺癌极为相似。原发肺DLBCL(primary pulmona-ry diffuse large B-cell lymphoma,PPDLBCL)是一种极为罕见的恶性淋巴组织增殖性疾病,该病占所有PPL的20%,仅占非霍奇金淋巴瘤的1%,约占所有原发性肺部肿瘤的0.5%-1. 0%。具体诊断标准包括: 具有DLBCL的病理形态学和免疫组织化学特征,发生在肺间质或支气管的原发性病变,伴或不伴肺门淋巴结受累,且临床影像和病理学排除远处转移。PPDLBCL发病机制仍不明确,研究示可以原发,也可由低度恶性程度淋巴瘤转化而来,文献报道该演进可能与染色体结构的改变有关,如MALT淋巴瘤转化为DLBCL由于t ( 11;18 ) ( q21;q21) 染色体易位。
PPDLBCL常见于老年人或免疫抑制患者,多数患者无症状,常见的临床表现包括全身症状和呼吸道症状,并无特异性,因此常被误诊为炎症性疾病等。影像学可表现出不同影像学特征,典型表现为单发或多发结节、团块或实变影。单侧或双侧肺均可受累,肺不张和胸腔积液罕见。大体检查结节通常呈实性,切面为新鲜鱼肉状,可坏死出血。镜下特点与其他部位的DLBCL 相似。鉴别诊断包括:①肺MALT淋巴瘤;②纵隔大B细胞淋巴瘤;③肺血管内大B细胞淋巴瘤;④肺淋巴瘤样肉芽肿;⑤肺炎性假瘤;⑥IgG4相关性肺疾病等。
PPDLBCL治疗方案的选择应以生物学特征、疾病发展阶段和患者身体情况为基础,包括单纯监测、手术切除、化疗和放化疗。Seeram等报道大多数PPDLBCL为低度恶性,完全切除后可能治愈,而R-CHOP方案是PPDLBCL的最佳治疗方案。文献认为PPDLBCL并不预示着其预后像其他结外部位DLBCL那样差,90%以上患者在经传统化疗后可以达到完全缓解。因此早诊断及早治疗对患者的预后有至关重要的意义。
2.4 肺HL
霍奇金淋巴瘤(Hodgkin Lymphoma,HL)大多原发于淋巴结,原发性结外HL少见,而肺原发性霍奇金淋巴瘤 ( Primary pulmonary Hodgkin lymphoma,PPHL) 则更为罕见,PPHL指肺内淋巴组织及支气管黏膜相关淋巴结内发生的HL,临床罕见且临床表现及影像学缺乏特异性,易被误诊为其他肺部肿瘤。WHO将其分为2个亚型:经典型和结节性淋巴细胞为主型,其中经典型又分为4个亚型:结节硬化型、混合细胞型、富于淋巴细胞型及淋巴细胞衰减型。肺HL大多为继发性,从纵隔、肺门或其他部位淋巴结病变直接浸润或播散至肺实质。PPHL女性稍多见,男女比例约为1:1.4,有两个发病高峰,分别为21-30岁及60-80岁。而继发性HL常见于年青女性,常有HL病史,最常见的亚型是结节硬化型。患者无特异性临床表现,可表现持续性干咳、痰中带血、呼吸困难等症状,可也出现B症状,如不明原因发热、盗汗和体重减轻等。
HL的组织学特征是在多种反应性炎细胞背景中见到数量不等形态不一的肿瘤细胞。肿瘤细胞包括及其变异型细胞,典型的RS细胞,胞质丰富,嗜双染性,核圆形或椭圆形,双核或多核,大而红染的包涵体样核仁。RS细胞变异型有陷窝细胞、爆米花细胞、干尸细胞、单核瘤巨细胞等。反应性炎细胞背景包括大小不等的淋巴细胞、嗜酸性粒细胞、浆细胞、中性粒细胞及组织细胞等,也可见肉芽肿样形态。免疫表型几乎所有肿瘤细胞CD30为阳性,75-85%病例CD15阳性,90%病例有PAX5阳性,PAX5在肿瘤细胞中的表达比反应性的B细胞要弱,约40%病例CD20可呈阳性。PPHL确诊先排除继发性PHL,诊断标准为:①既往无HL病史;②排除纵隔、肺门病变侵及肺实质;③病变只局限于肺;④经病理确诊后3个月内未出现其他部位的HL。鉴别诊断还包括:①纵隔大B细胞性淋巴瘤;②间变性大细胞淋巴瘤;③肺大细胞癌;④朗格汉斯组织细胞增生症等。
大多数学者认为对于局限性的PPHL,首选手术治疗,对于双侧肺病变、肺内多发病灶、肺外浸润或复发病例常用手术联合化疗。Vanden Eynden等人统计病灶局限的患者10年生存率为87.5%。目前公认的影响预后因素有双侧肺发病、肺内多发病灶、胸膜侵犯伴或不伴胸腔积液、空洞形成等。
2.5 罕见类型
2.5.1 结外鼻型 NK/ T细胞淋巴瘤
结外鼻型 NK/ T细胞淋巴瘤(extranodal NK/ T‐cell lymphoma,nasal type;ENKTL‐NT)以肺部病变首发确诊者少见,起源于肺实质、支气管或其区域淋巴结,占原发性肺部恶性肿瘤不足1.0%。可发生于任何年龄,但多在19-80岁,中位年龄为39岁,男女之比约1:1。临床表现以发热、咳嗽伴呼吸困难就诊,影像学无特异性表现,早期容易被误诊为肺炎,可伴胸腔积液。实验室检查白细胞及血小板可减少,部分患者示嗜血细胞综合征。
病理形态与其他部位基本相似,肿瘤细胞在肺组织内弥漫浸润性生长,肿瘤细胞形态学谱系包括小、中、大3型淋巴细胞按不同比例和数量存在,可见多少不等的反应性炎细胞;肿瘤细胞胞质中等,胞核长而不规则,染色质呈细颗粒状,大胞核可呈空泡状,核仁不明显,病理性核分裂象易见;特征性表现为以血管为中心浸润并破坏血管,伴显著的凝固性坏死。肿瘤细胞表达T细胞抗原,多表达NK细胞抗原CD56和细胞毒颗粒相关抗原TIA1、颗粒酶B和穿孔素等;不表达B细胞和组织细胞抗原。EBER原位杂交检测是确诊重要依据之一,对于CD3e阳性而CD56阴性者,细胞毒性抗原和EBER同时阳性也可确诊。肺ENKTL‐NT初诊时易与一些疾病混淆,需要注意鉴别:①肺非特异性炎性病变;②肺结核;③肺肉芽肿病性多血管炎;④肺淋巴瘤样肉芽肿;⑤EBV阳性的大B细胞淋巴瘤;⑥低分化鳞形细胞癌或神经内分泌癌;⑦其他肺原发或继发性淋巴瘤。对于肺穿刺活检标本以坏死为主的病例,更需要高度警惕,研究认为常规加做EBER原位杂交对提高诊断率有极大帮助。
2.5.2 血管内大B细胞淋巴瘤
血管内大B细胞淋巴瘤(intravascular large B cell lymphoma,IVLBCL)是大B细胞淋巴瘤一种少见类型,其特点为淋巴细胞选择性生长在血管腔内,特别是毛细血管,一般不累及大动脉及大静脉。IVLBCL是一种全身性疾病,发病机制尚不清楚,可能与被累及器官的高内皮小静脉水平选择性降低或缺失有关。根据临床表现和地域分布的不同,可分为西方型和亚洲型。西方型主要表现以神经系统或皮肤病变多见。亚洲型主要表现为发热、肝脾肿大、噬血综合征等。IVLBCL多发生在成人,主要累及中枢神经系统、皮肤、肺等。特别患者常表现为弥漫性的肺部阴影而常被误诊,需要与间质性肺疾病(interstitial lung disease,ILD)中的间质性肺炎鉴别。累及肺部的IVLBCL以呼吸系统症状为首发表现,临床症状及体征、实验室检查无明显特异性,影像学表现类似间质性肺炎。文献已报道肺IVLBCL的影像学表现包括磨玻璃影、小结节影、实变影、小叶间隔增厚等,其中磨玻璃影表现最多见。实验室检查亦无特异性,可出现乳酸脱氢酶升高及贫血等。肺IVLBCL的确诊需要病理活检。
大体IVLBCL一般不形成肿块。组织学特征是肿瘤细胞位于血管内,肿瘤细胞的生长模式包括3种:①肿瘤细胞位于血管腔内失黏附性生长;②肿瘤细胞充满整个血管腔内呈黏附性生长;③肿瘤细胞沿着窦状隙播散。肿瘤细胞表现中心母细胞和免疫母细胞特征,胞质少,胞核呈泡状,核仁明显,核分裂象常见;肿瘤细胞可侵犯血管壁,部分病例出现纤维素性出血坏死;IVLBCL表达B淋巴细胞抗原,某些病例CD5阳性。鉴别诊断主要是转移癌和血管源性肿瘤。IVLBCL预后极差,文献提示早期系统性化疗可以明显延长患者的生存期。目前主要化疗方案为CHOP或类似CHOP的方案。
参考文献略。























共0条评论