[导读] 编译整理:强子
新型冠状病毒SARS-CoV-2导致了目前的COVID-19大流行。研究表明,该病毒主要感染呼吸道细胞,导致弥漫性肺泡损伤、肺部血管受损及血栓形成。不过,目前认为该病毒对于全身各系统都会有不同程度的影响。近日,纽约大学医学院病理专家Flaifel等人在美国病理学家协会(College of American Pathologists,CAP)官方期刊《Archives of Pathology & Laboratory Medicine》以读者来信(《Letters to the Editor》)的方式介绍了新冠患者尸检标本中睾丸形态学改变。为帮助大家更好的了解相关问题,我们将该文要点编译介绍如下。
该文分析了10例已证实有SARS-COVID-2感染患者尸检标本中的睾丸及附睾形态学表现,其中有6例睾丸标本进行了COVID-19病毒基因相关RT-PCR检测。患者年龄22-83岁不等,中位数49.5岁。所有病例入院时均经咽拭子和检测证实SARS-COVID-2阳性。入院至死亡的时间间隔7-27天不等,中位数15天。患者合并症的情况0-6种不等,中位数为3种;其中最常见合并症为2型糖尿病及高血压。所有病例尸检标本中,呼吸道均可检出COVID-19;但所有睾丸标本均为COVID-19阴性。
形态学分析表明,有7例的睾丸组织学改变为氧化应激(oxidative stress)所致,涉及精母细胞分化周期的不同阶段,具体表现为染色质凝集、胞质嗜酸性表现、细胞核碎片化。可见精母细胞脱落至管腔,并在附睾头部聚集。也可见精子变得细长、Sertoli细胞变得肿胀、空泡化。上述改变与1例健在的睾丸癌患者睾丸切除标本中所见类似。病史较长者,可见生精小管内细胞成分完全缺失,小管基底膜增厚。
值得注意的是,有2例可见多灶性微小栓塞。免疫组化CD61染色证实睾丸静脉内血小板数量增多,同时有簇状分布、偶见血栓形成。1例细胞间可见单个核的炎症细胞数量增加,主要为CD8阳性细胞,符合睾丸炎表现。

图1. (左)曲细精管损伤相关改变,具体表现为精母细胞染色质凝集、胞质嗜酸性改变,Sertoli细胞肿胀并空泡样变;(右)附睾处可见精子及不成熟精母细胞聚集。

图2. (左)多灶性血小板聚集及微血栓;(右)免疫组化CD61可显示睾丸静脉内簇状聚集的血小板。
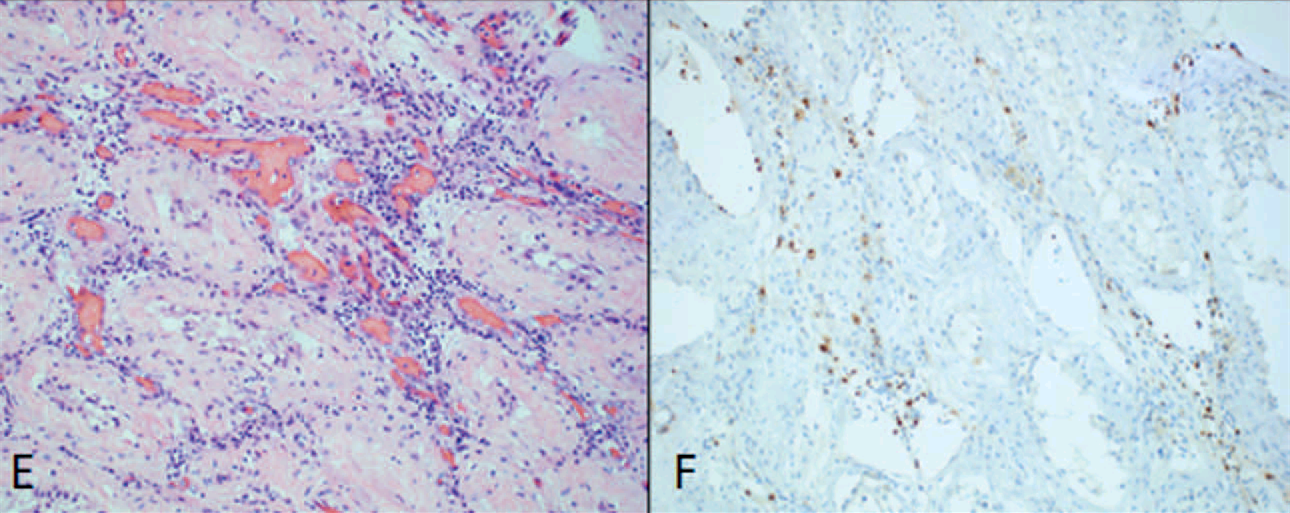
图3. (左)睾丸的间质内可见单个核炎性细胞浸润,曲细精管萎缩,符合睾丸炎表现;(右)免疫组化检查证实炎症细胞主要为CD8阳性细胞。
小结
该组病例中,可见急性睾丸损伤的证据,且主要与氧化应激有关,这一点此前曾报道于2型糖尿病相关动物模型。本文作者将该组病例中的所见与对照组、即合并症与年龄分布相近但COVID-19阴性的7例尸检睾丸所见进行对比,结果发现对照组的睾丸改变主要为慢性表现(如精子生成减少、Leydig细胞数量减少、曲细精管透明样变),而COVID-19阳性患者的睾丸改变主要为急性表现(如精母细胞脱落至管腔,精子变得细长,Sertoli细胞肿胀)。
此前文献中,COVID-19患者睾丸活检也曾有相似报道,但本文综合分析睾丸及相邻附睾组织学所见,对微环境及血管改变的特征进一步明确,这可能都是氧化应激所致的证据。本文同时提供了睾丸血管系统有微血栓的强有力证据,这与此前肺组织中所见类似。此外,本文在睾丸中未能检出病毒,提示SARS-COVID-2感染可能并不会直接导致睾丸损伤。睾丸中所见形态学改变可能是凝血导致微血栓、缺氧所致的继发性表现。长期并发症所致的毒性代谢效应、重症COVID-19中特征性的细胞因子风暴等,可能也可以解释上述改变;但本文中所见睾丸损伤的类型及范围,提示睾丸可能可以自COVID-19所致损伤中恢复过来。
点击下载原文文献
参考文献
Flaifel A, Guzzetta M, Occidental M, et al. Testicular Changes Associated With Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2). Arch Pathol Lab Med. 2021;145(1):8-9.
doi:10.5858/arpa.2020-0487-LE
















共0条评论