[导读] 作者:王学利
病例赏析
①患者,女,59岁,肾癌术后,肺部阴影,
送检(右肺穿刺)灰褐色条索状组织1条,长1cm,直径0.1cm。
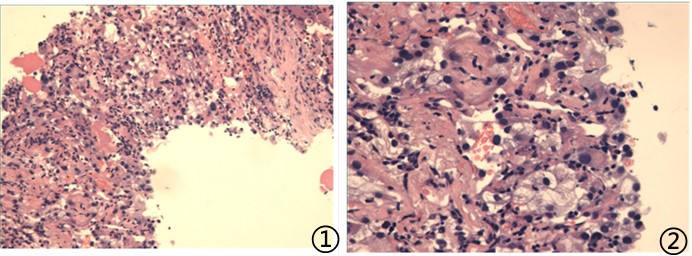
图1低倍可见胞浆透亮的肿瘤细胞;图2高倍下肿瘤细胞异型性明显,核仁可见;
免疫组化:
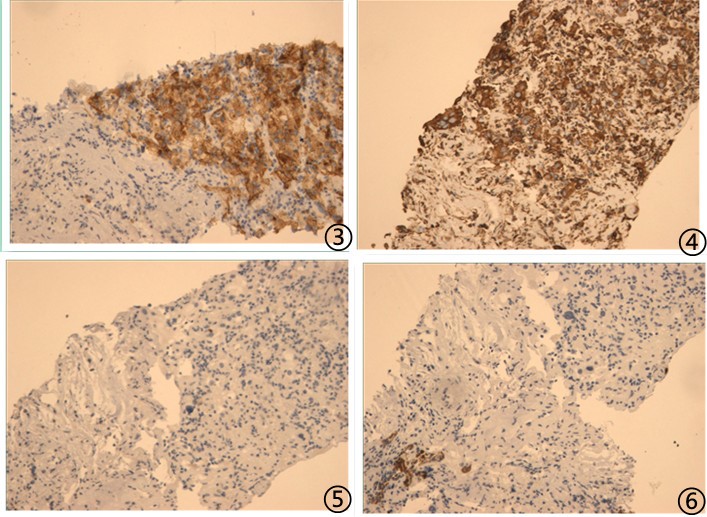
图3肿瘤细胞CD10弥漫强阳性;图4肿瘤细胞Vimentin阳性;图5肿瘤细胞P40阴性;图6肿瘤细胞NapsinA阴性;
免疫组化阳性指标:CD10、CD56、CK18、EMA、Vimentin;
免疫组化阴性指标:Actin、CD20、CD3、CD30、CD34、CD68、CEA、CK20、CK5/6、CK7、CgA、LCA、MelanA、NSE、S-100、Syn、TTF1、p63、p40、RCC、Desmin、Myo D1;
肿瘤细胞增殖指数Ki-67约20%;
最终诊断:(右肺)穿刺组织见肺组织及纤维组织中胞浆透亮的大细胞,考虑为上皮来源恶性肿瘤,结合临床病史,转移性肾透明细胞癌可能性大。
②患者,男,49岁,腹腔镜下右肾癌根治术病史,肺部阴影,
送检右肺中叶可见一大小为1.5*1*1cm的灰黄色结节,与周围组织界限较清。
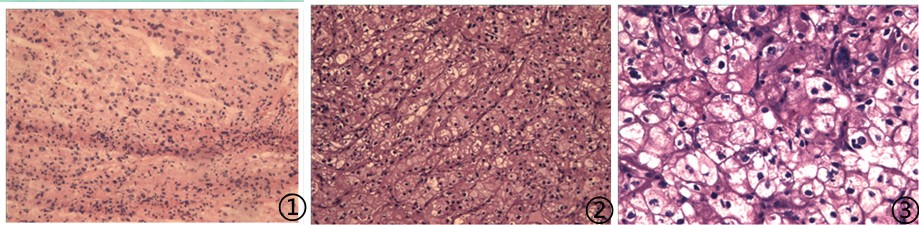
图1冰冻;图2低倍镜下;图3高倍镜下;
免疫组化:
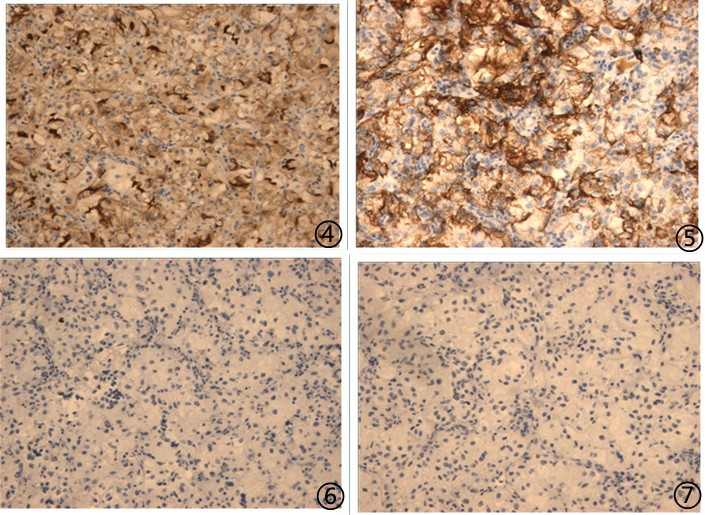
图4肿瘤细胞CD10阳性;图5肿瘤细胞CK8/18阳性;图6肿瘤细胞P63阴性;图7肿瘤细胞TTF1阴性;
免疫组化阳性指标:CD10、CK8/18、EMA、NSE;
免疫组化阴性指标:CD34、CD56、CD57、CEA、CK20、CK34βe12、CK7、CgA、GFAP、HMB45、LCA、S-100、P63、TTF1、Syn;
肿瘤细胞增殖指数:Ki-67约20%;
最终诊断:结合免疫组化结果及临床病史,符合透明细胞肾细胞癌转移。
③患者,男,65岁,贲门癌根治术病史,肺部阴影。
术中送检灰红色肺组织1块,距切缘1cm可见一灰红色肿物,大小3.5*2.5*2cm,切面灰白色质中。
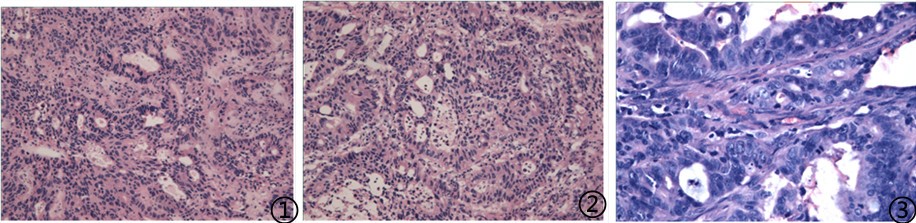
图1冰冻;图2低倍镜下;图3高倍镜下;
免疫组化:
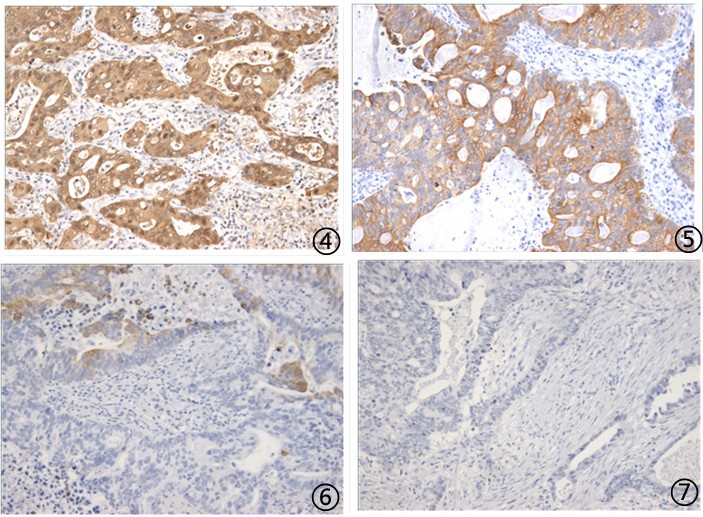
图4肿瘤细胞CK阳性;图5肿瘤细胞CK7阳性;图6肿瘤细胞CK20灶阳;图7肿瘤细胞TTF1阴性;
免疫组化阳性指标:CK、CK7、CK20、CDX-2;
免疫组化阴性指标:CD34、Napsin A、TTF1;
肿瘤细胞增殖指数Ki-67约60%;
最终诊断:(左上肺)肺组织可见中分化管状腺癌浸润,结合组织形态、临床病史及免疫组化结果,考虑胃癌转移。
④患者,男,56岁,主诉直肠癌术后6年5月,发现肺部阴影;
送检灰白色条索状软组织2条,长1.5cm,直径0.1cm。
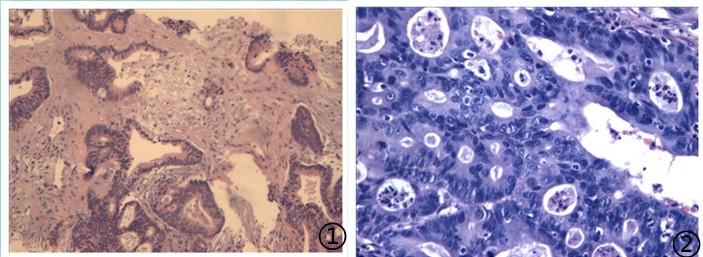
图1低倍镜下可见异形腺体伴坏死;图2高倍镜下腺体异型性明显,核分裂象可见;
免疫组化:
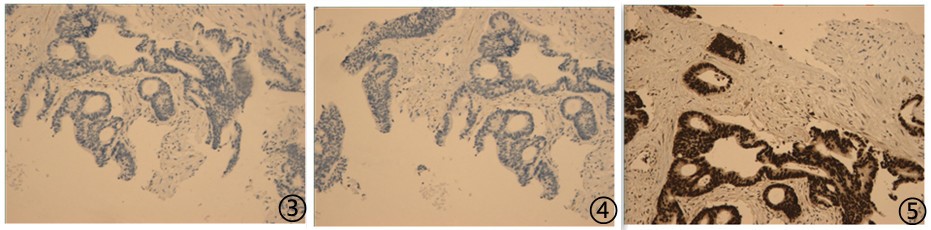
图3肿瘤细胞TTF1阴性;图4肿瘤细胞CK7阴性;图5肿瘤细胞CDX2阳性;
肿瘤细胞增殖指数Ki-67约25%,
最终诊断:(左肺穿刺)纤维组织内见浸润性生长的异形腺体伴坏死,结合病史,符合肺的结肠癌转移。
⑤患者,男,29岁,左侧肾上腺区可见8.2x10.8cm不规则低回声肿物,边界尚清,内回声欠均匀,内可见粗大血流束,肺部阴影,
送检(肺穿刺)灰黄色不整形软组织1堆,大小共0.3*0.2*0.1cm。
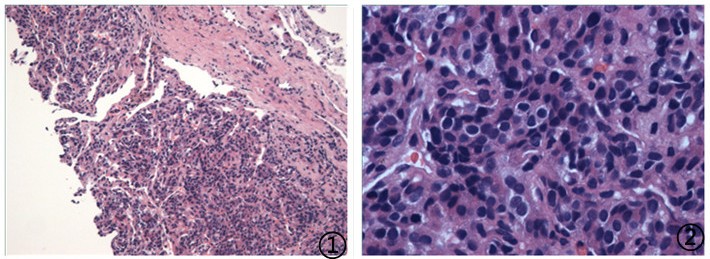
图1低倍镜下可见肿瘤细胞巢团状分布;间质内可见血窦样结构;图2高倍镜下肿瘤细胞异型性明显,细胞核卵圆形,染色质细腻,核分裂象罕见;
免疫组化:
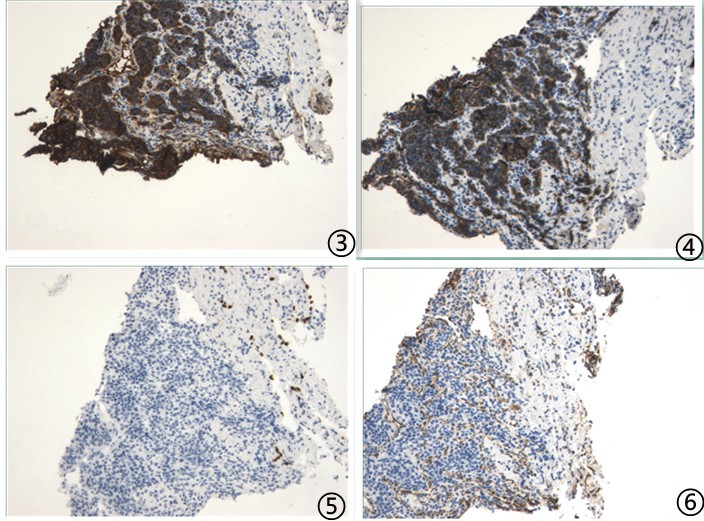
图5肿瘤细胞CgA强阳性;图6肿瘤细胞CD56阳阳性;图7肿瘤细胞TTF1阴性;图8肿瘤细胞Vimentin阴性,血管阳性;
最终诊断:穿刺肺组织内局灶见小圆形细胞呈巢团状生长,细胞具有一定异型性,结合免疫组化表型,符合副神经节瘤转移。
肾上腺穿刺
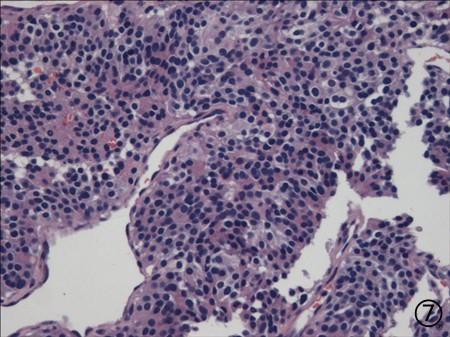
图7肿瘤细胞形态学类似于肺穿刺,
⑥患者,男,73岁,肝癌,肝硬化,肝移植术后8年,肺部阴影,
送检(肺穿刺)灰白色软组织2条,长分别为1.5cm、1.7cm,直径0.1cm,
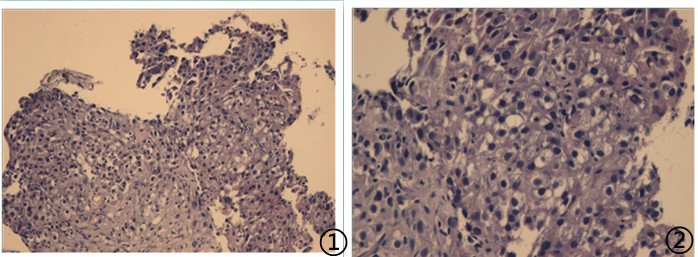
图1低倍镜下可见肿瘤细胞;图2高倍镜下肿瘤细胞异型性明显,胞浆透亮;
免疫组化:
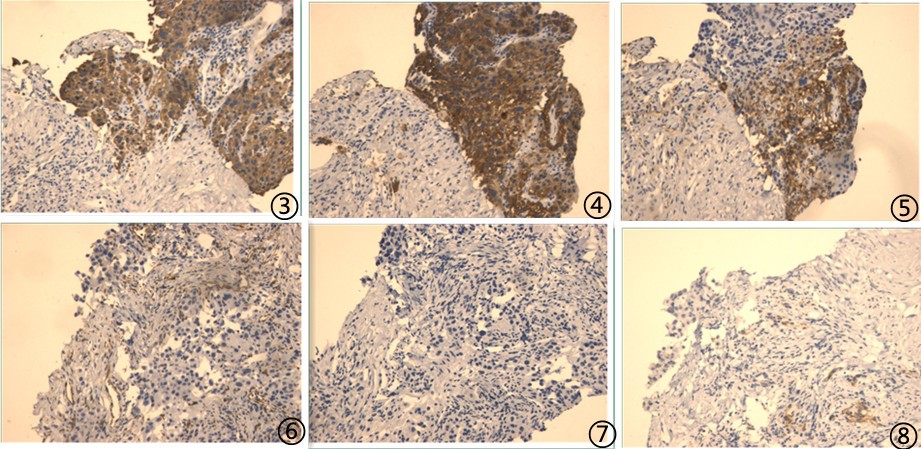
图3肿瘤细胞CK阳性;图4肿瘤细胞CD10阳性;图5肿瘤细胞CK18阳性;图6肿瘤细胞Arginine弱阳性;图7肿瘤细胞P40阴性;图8肿瘤细胞TTF1阴性;
其他免疫组化阴性指标:CK5/6、CK7、Napsin A、P63、AFP、CD34、CK19、Glypican-3、Hepatocyte;
最终诊断:穿刺组织可见低分化癌伴坏死,结合病史及免疫组化表型,考虑为转移性肝细胞癌。
⑦患者,男,73岁,肾盂下极可见0.8x2.3cm不规则无回声区,肺部阴影。
送检(肺穿)灰白色条索状组织1堆,大小共0.5*0.4*0.1cm。
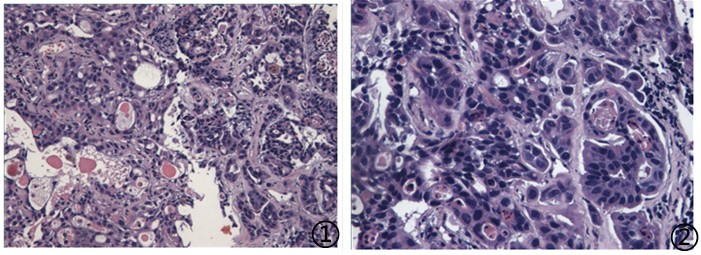
图1低倍镜下可见恶性肿瘤细胞;图2高倍镜下肿瘤细胞异型性明显,核分裂象可见;
免疫组化:
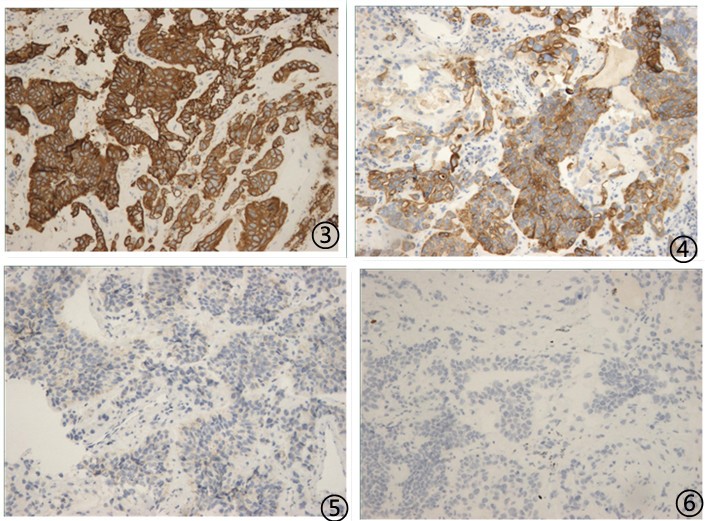
图3肿瘤细胞CK7阳性;图4肿瘤细胞CK20阳性;图5肿瘤细胞AMACR阴性;图6肿瘤细胞TTF1阴性
免疫组化阳性指标:CK7、CK14、CK18、CK19、CK20、CK34βe12、CK5/6、EMA;
免疫组化阴性指标:AMACR、CD34、LCA、NSE、P504、NapsinA、TTF1;
肿瘤细胞增殖指数Ki-67约40%;
最终诊断(肺)纤维组织内见异型的细胞巢呈浸润性生长伴坏死,脉管内见癌栓,免疫组化提示为上皮来源恶性肿瘤,结合病史,肾盂癌转移可能性大。
⑧患者,女,62岁,主诉左乳腺癌术后14年8月余,发现左肺占位9月余,
送检灰褐色软组织2粒,大小均为0.3*0.2*0.1cm,
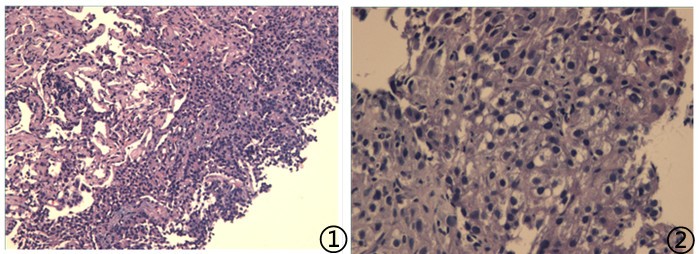
图1低倍镜下可见低分化肿瘤细胞;图2高倍镜下肿瘤细胞胞浆透亮,核分裂可见;
免疫组化:
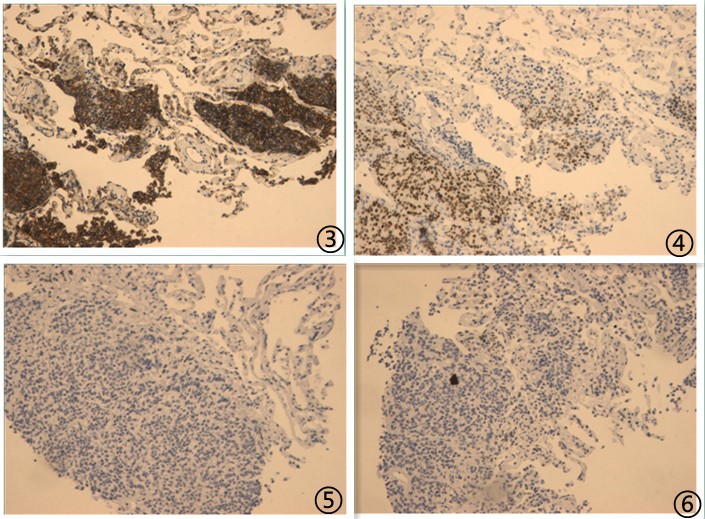
图3肿瘤细胞P120阳性,图4肿瘤细胞ER核阳性,图5肿瘤细胞P40阳性,图6肿瘤细胞TTF1阴性,
免疫组化阳性指标: CK7、CA15-3、E-Cadherin、ER、Her-2、P120、PR;
免疫组化阴性指标:CK5、CK5/6、CgA、Napsin A、P40、Syn、TTF-1、p63;
肿瘤细胞增殖指数 Ki-67约20%;
最终诊断:见小巢低分化癌浸润,结合免疫表型考虑为低分化腺癌,加做乳癌标记免疫组化后支持乳腺导管癌转移。
⑨患者,女,49岁,主诉腹膜后恶性肿瘤术后1年2月余,于当地医院查胸部CT双肺多发转移;
送检(右肺穿刺)灰白间灰黄色条索状组织1堆,大小0.5*0.2*0.1cm。
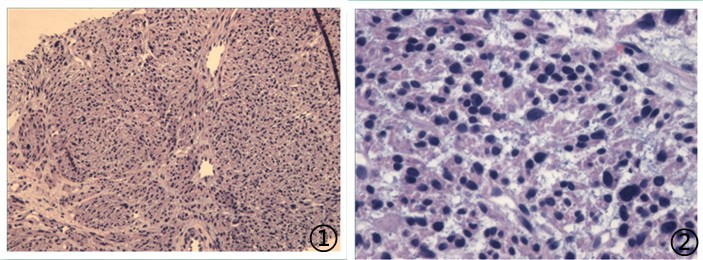
图1低倍镜下可见短梭形肿瘤细胞;图2肿瘤细胞异型性明显,核分裂可见;
免疫组化:
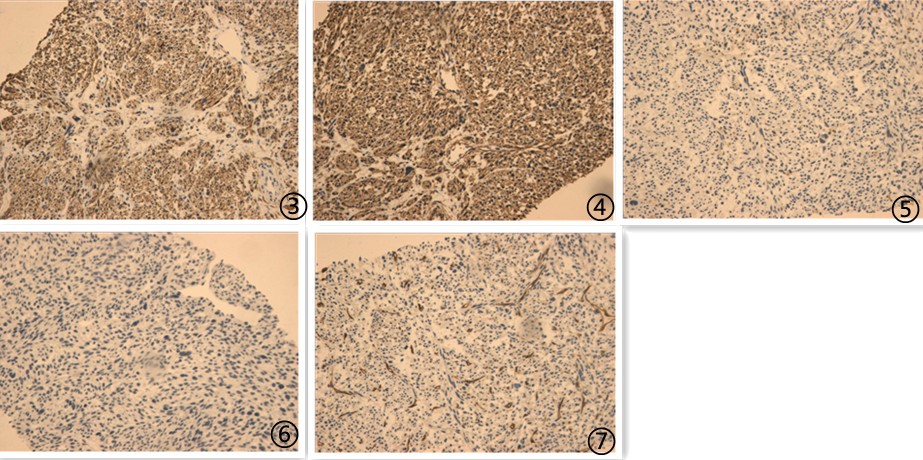
图3肿瘤细胞Demsin阳性;图4肿瘤细胞SMA阳性;图5肿瘤细胞S100阴性;图6肿瘤细胞CD117阴性;图7肿瘤细胞CD34阴性;
免疫组化阳性指标:Desmin、SMA;
免疫组化阴性指标:CD117、CD34、DOG-1、NF、S-100、ER、PR、TFE3、HMB45、Melan A;
肿瘤细胞增殖指数Ki-67约70%;
最终诊断:梭形细胞肉瘤,免疫组化表型符合平滑肌肉瘤转移。
小结
肺是转移性肿瘤的最常见的转移部位之一,因为肺是接收血液和淋巴液的唯一器官,故肺可发生任何器官大多数肿瘤的继发性转移,有文献报道25%-30%恶性肿瘤最终可发生肺转移。原发性肿瘤转移到肺部的方式,取决于病理学类型及所在的部位。以血道转移为主的肿瘤有绒癌、甲状腺癌和前列腺癌等。消化系统肿瘤易发生淋巴道转移,常见有胃癌等。由于肺转移性肿瘤与原发性肿瘤在病理形态学上具有一定的相似性,但其临床治疗方式和预后评估具有很大的不同,因此准确诊断肺转移性肿瘤的类型和原发部位对于指导临床治疗及预后非常重要,而国内外对肺转移性肿瘤病理类型综合分析的文献报道较少。肺转移性肿瘤的病理学类型呈复杂多样性,因此其诊断与鉴别诊断相对困难。
大多数转移灶影像学表现为多发性或双侧性,边缘清楚,生长迅速,常见于肺下叶。而一些病例呈孤立性结节,与肺的原发肿瘤相似,转移瘤可形成中央型空洞,与肺原发肿瘤可能混淆的是肿瘤从肺实质内侵及大支气管壁,形成息肉样支气管内肿物。CT检查发现肺内单发或多发结节是良性还是恶性,是肺内原发还是肺外疾病的肺内转移,需要病理学检查协助进行诊断和鉴别诊断。
文献研究肺转移性肿瘤中最多见的是转移性乳腺癌,病理形态多样性,排列呈巢团状、小梁状、条索状或实性弥漫分布,少数可形成腺腔,偶可见片状坏死区;肿瘤细胞大小形状各异,多形性明显,胞核深染,核仁明显,核分裂象易见。而肺腺癌多呈腺泡状或乳头状及贴壁状生长,癌组织与肺交界处多能找到贴壁生长的腺癌区域及肺泡上皮非典型增生区域,腺癌的逐渐变化方式是诊断肺原发性腺癌最好的依据。免疫组化在鉴别转移性乳腺癌及肺原发性腺癌中有很大作用,常用疫组化标记物有ER、PR、GCDFP-15、GATA3、mammaglobin、TTF-1、NapasinA等。
文献报道结直肠癌肺转移患者接受肺转移病灶切除术后的5年生存率为24%-68% ,而接受全身化疗患者的生存时间仅约24个月,因此明确诊断结直肠癌肺转移与原发肺腺癌具有重要意义,尤其肠型腺癌。诊断需结合病史和影像学,如果有结直肠癌病史,且肺占位边界清楚并且多发时,首先考虑转移。
透明细胞性肾细胞癌有独特的组织学特点,多呈实性巣状和腺泡状结构,部分呈管状或乳头状及腺泡状,中心腔隙大小不一,间质可见丰富的薄壁血管,有时可有多少不等的炎细胞浸润。肿瘤细胞胞膜清楚,呈立方形或柱状,胞质内含大量脂类或糖原,使之呈透明状。需与肺透明细胞瘤 (又称糖瘤)鉴别。后者呈实片状,细胞圆形或多边形,界限清楚,胞质丰富呈透明或嗜酸性,细胞巢被纤细的薄壁血管和血窦分隔,胞核大小较一致, 偶可见核仁,核分裂象罕见,无肿瘤性坏死。文献报道HMB-45、melan-A和SMA阳性, 有助于两者鉴别。还需要与其他具有透明细胞形态的非小细胞肺癌鉴别,如具有透明细胞形态的肺腺癌、透明细胞性鳞状细胞癌和原发性肺透明细胞癌。具有透明细胞形态的肺腺癌,可见胞质内黏液,胞核偏位,可出现细胞外黏液,甚至黏液湖的形成。具有透明细胞形态的非角化性鳞状细胞癌有较大的癌巢,细胞异型性明显,胞核较大,核分裂象多见;而缺乏薄壁血管间隔,免疫组化标记物CK5/6、P40和P63等阳性有助于鉴别。原发性肺透明细胞癌是肺大细胞癌的一种特殊亚型,肿瘤细胞分化差,异型性明显,核分裂象易见,甚至可出现奇异型核。此外少数肺转移性透明细胞性肾细胞癌组织形态以分化差的肉瘤样成分为主,组织形态学与肺梭形细胞癌和分化差的肺腺癌难以鉴别,且均可表达Vimentin,亦需鉴别诊断。
总之,肺转移性肿瘤类型较多,形态学复杂多样性,以转移性乳腺癌、结直肠癌、透明细胞性肾细胞癌最为常见,正确和及时的诊断对于临床治疗方案的选择及预后评估均有重要意义。对于恶性肿瘤病史的患者出现肺结节均应考虑肺转移的可能,诊断需结合临床病史,影像学特征,肿瘤病理形态学和免疫组织化学进行综合分析,特别是免疫组化是鉴别和诊断的重要方法。
参考文献略。
































共0条评论