[导读] 编译整理:强子
读文献,学病理-乳腺癌部分免疫组化详解(一)
读文献,学病理-乳腺癌部分免疫组化详解(二)
读文献,学病理-乳腺癌部分免疫组化详解(三)
读文献,学病理-乳腺癌部分免疫组化详解(四)
PD-L1中的免疫组化问题
免疫组化PD-L1是乳腺癌中应用免疫检查点抑制剂治疗的一种新兴预测标记物,但并不完美。目前为止,美国食品和药物管理局(Food and Drug Administration,FDA)批准了三种PD-L1检测方案作为确定相关适应症患者是否适于应用特异性检查点抑制剂的“伴随诊断”(complementary diagnostic),当然这其中也包括了三阴型乳腺癌中罗氏公司的Ventana PD-L1(SP142)检测,详见表4。
表4. PD-L1免疫组化作为伴随诊断的具体情况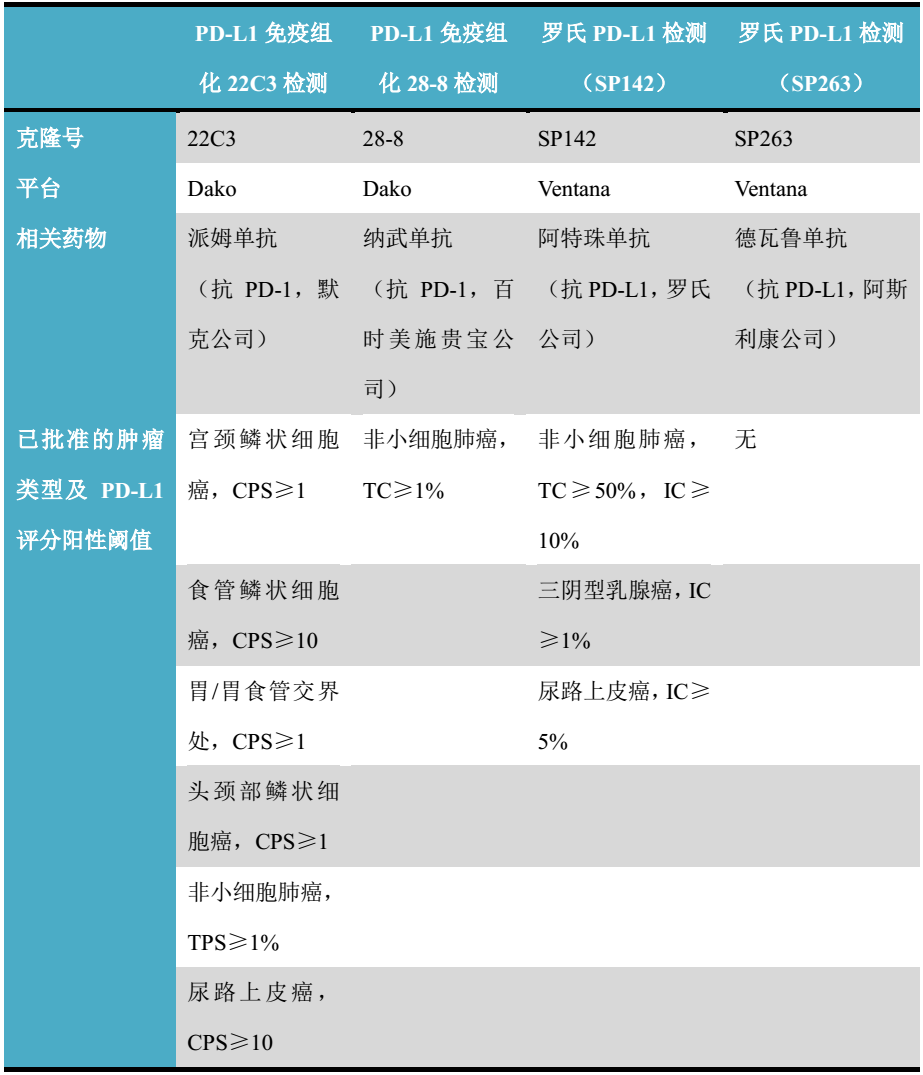
备注:
CPS:combined positive score,联合阳性分数,结合了肿瘤细胞的PD-L1阳性结果和免疫细胞PD-L1阳性结果而得出的评分;
TPS:tumor proportion score,肿瘤阳性评分,是指阳性的肿瘤细胞所占比例
TC:tumor cell labeling,肿瘤细胞阳性比例
IC:immune cell labeling,免疫细胞评分,限定于伴PD-L1阳性免疫细胞的肿瘤区域
由表4也可以看出,PD-L1免疫组化的应用范围及解读非常麻烦,在不同肿瘤类型、不同免疫检查点抑制剂方面均有所差异。此外,癌症的免疫治疗、伴随诊断、预测性标记物等,均在飞速发展中;毫无疑问,乳腺癌中的相关适应症及检测方案也会随着相关研究进展而出现改变。
1、进展期乳腺癌中的免疫检查点抑制剂
2019年3月,美国FDA批准了PD-L1抑制剂阿特珠单抗(atezolizumab)联合白蛋白结合型紫杉醇(nab-paclitaxel)用于PD-L1阳性的进展期三阴性乳腺癌。这对于乳腺癌治疗来说是个里程碑事件,因为这不仅是第一项免疫检查点抑制剂获批用于乳腺癌,同时也是第一项用于三阴性乳腺癌的靶向治疗方案。多项其他PD-1检查点抑制剂或PD-L1检查点抑制剂的相关研究也在进行中。
2、乳腺癌诊断中的PD-L1伴随诊断
根据前文所述,阿特珠单抗用于进展期三阴性乳腺癌的时候,需要PD-L1免疫组化的伴随诊断。FDA批准的乳腺癌PD-L1检测,是FDA批准的任何相关检测均可;但目前为止,该机构批准用于乳腺癌PD-L1检测的仅为罗氏公司Ventana PD-L1(SP142)检测,具体所用PD-L1抗体克隆号为SP142。该检测方案与PD-L1免疫组化22C3检测、PD-L1免疫组化28-8检测均不同,后两者所用抗体克隆号分别为22C3/28-8,检测平台为Dako,FDA批准其作为其他癌症类型的伴随诊断。罗氏公司Ventana PD-L1(SP263)检测则是作为补充诊断的(complementary diagnostic),但目前FDA尚未批准其作为伴随诊断。罗氏公司Ventana PD-L1(SP142)检测在三阴性乳腺癌中是将免疫细胞(immune cell,IC)评分作为PD-L1状态判断指标的,具体是PD-L1阳性免疫细胞在肿瘤区域的比例,如三阴性乳腺癌中该比例≥1%则视为PD-L1阳性。不过,此时的免疫细胞是指所有的免疫细胞,并非仅指肿瘤内浸润的淋巴细胞,还包括浆细胞、中性粒细胞、巨噬细胞。具体PD-L1评估的不同方案,本文不再赘述,这是一个非常复杂的问题,值得另文探讨。
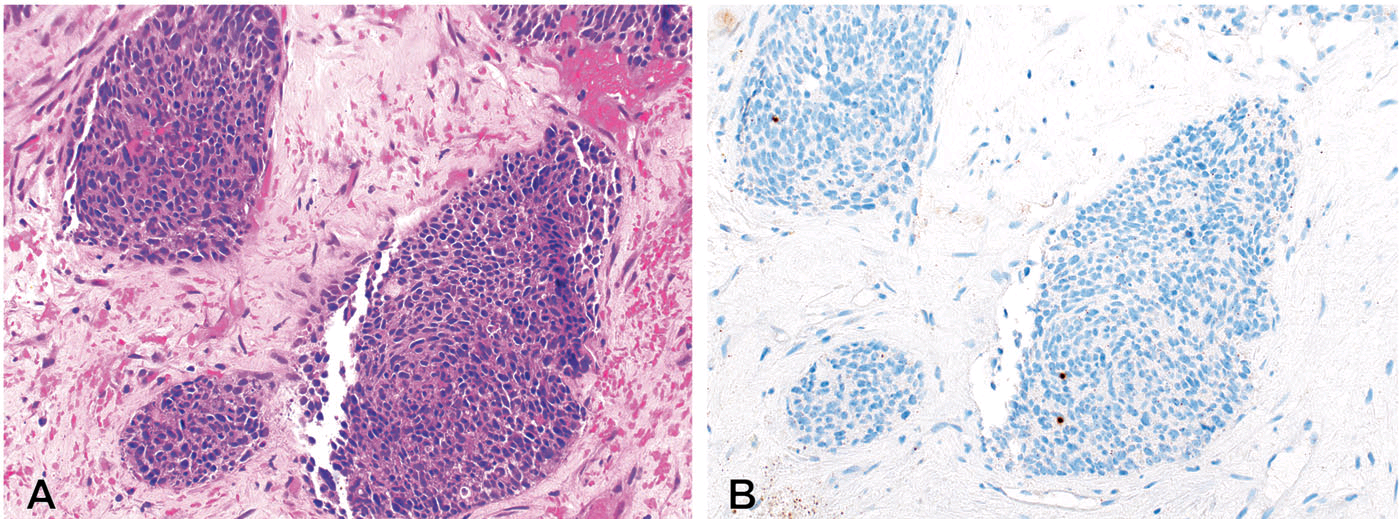 图1. 三阴性乳腺癌中,罗氏公司Ventana PD-L1(SP142)检测,本例组织表现,浸润的炎症细胞数量极少,PD-L1免疫细胞评分为0%,因此综合判定为PD-L1阴性;其中肿瘤细胞有少量非特异性、点状胞质着色。
图1. 三阴性乳腺癌中,罗氏公司Ventana PD-L1(SP142)检测,本例组织表现,浸润的炎症细胞数量极少,PD-L1免疫细胞评分为0%,因此综合判定为PD-L1阴性;其中肿瘤细胞有少量非特异性、点状胞质着色。
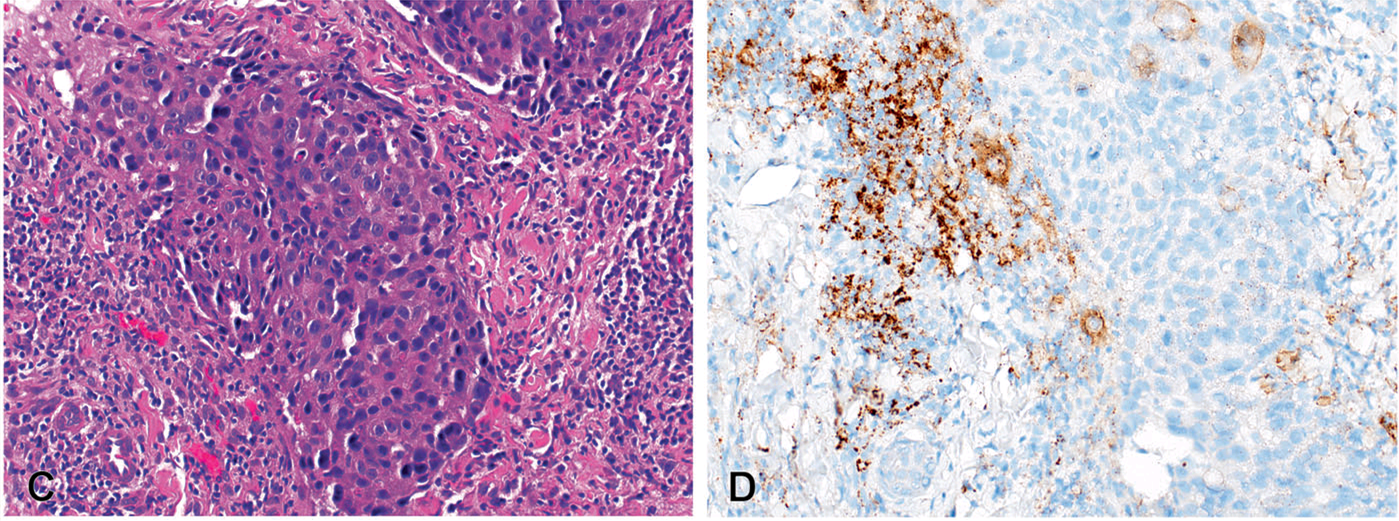 图2. 三阴性乳腺癌中,罗氏公司Ventana PD-L1(SP142)检测,本例组织学可见显著炎症细胞浸润,免疫组化PD-L1免疫细胞评分为20-25%,因此综合判定为PD-L1阳性。
图2. 三阴性乳腺癌中,罗氏公司Ventana PD-L1(SP142)检测,本例组织学可见显著炎症细胞浸润,免疫组化PD-L1免疫细胞评分为20-25%,因此综合判定为PD-L1阳性。
3、PD-L1免疫组化检测中的标本制备
罗氏公司Ventana PD-L1(SP142)检测不能用于细胞块标本或涂片标本,也不能用于脱钙标本。PD-L1作为伴随诊断,原发或转移性肿瘤中均可检测。目前还不完全清楚的是:原发肿瘤的微环境如何预测转移性肿瘤的免疫治疗效果;原发或转移治疗为阳性,但一定时间间隔后、和/或其他系统化疗后,患者是否还适合进行相关治疗?不过,标本类型和部位,的确可以影响PD-L1的检测结果:转移性肿瘤和原发肿瘤之间的PD-L1表达可以不同,且转移性肿瘤炎症程度相比原发肿瘤来说一般更弱。某些特殊的转移部位如肝脏,其炎症程度比肺等处的转移要更轻一些,因此应避免对肝脏等处的转移性肿瘤进行PD-L1检测。
4、PD-L1免疫组化解读中的陷阱
PD-L1免疫组化评分的可重复性,在多种肿瘤类型中均值得关注,乳腺癌更是如此。TC(tumor cell labeling,肿瘤细胞阳性比例)评分可重复性好,但前述IC(immune cell,免疫细胞)评分还是有一定争议的,尤其对<1%和1%的区分时。病理医师规范化培训、图片化的判读指南、图像分析软件等,可能都有助于改善PD-L1中IC评分的可重复性,但需要进一步全面研究。此外,乳腺癌中的PD-L1评估只能用IC这一指标,而不能用TC这一指标,且此时的IC评估为浸润性癌细胞边缘中的免疫细胞。淋巴结转移灶中的IC评分可能尤其值得探讨,因为此时必须区分开“肿瘤相关”免疫细胞和正常残余的淋巴细胞。这种情况下,癌巢周边存在相关的促纤维结缔组织增生,有助于确定肿瘤范围。坏死区也可出现PD-L1的非特异性着色,评分时要将其排除在外。
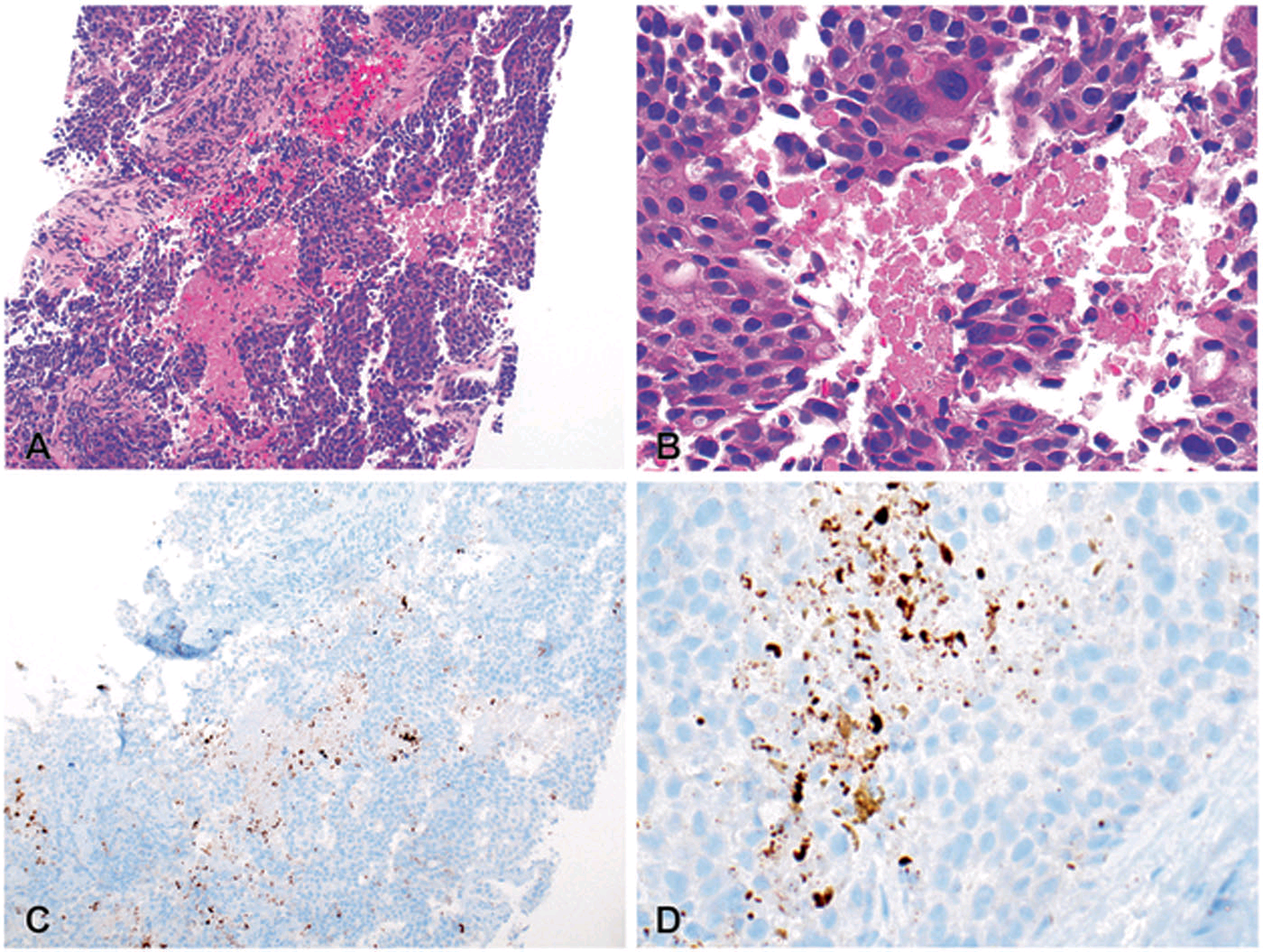 图3. 免疫组化PD-L1的非特异性着色。原发的三阴性乳腺癌,组织学可见大量细胞坏死,在Ventana PD-L1(SP142)检测的时候可见有非特异性着色。仔细观察,肿瘤细胞为PD-L1阴性,所有肿瘤区域内的PD-L1阳性免疫细胞数量<1%。
图3. 免疫组化PD-L1的非特异性着色。原发的三阴性乳腺癌,组织学可见大量细胞坏死,在Ventana PD-L1(SP142)检测的时候可见有非特异性着色。仔细观察,肿瘤细胞为PD-L1阴性,所有肿瘤区域内的PD-L1阳性免疫细胞数量<1%。
全文完
点击下载原文文献
参考文献
Cimino-Mathews A. Novel uses of immunohistochemistry in breast pathology: interpretation and pitfalls. Mod Pathol. 2020;10.1038/s41379-020-00697-3.
doi:10.1038/s41379-020-00697-3

















共0条评论