1、概述
透明细胞乳头状肾细胞癌(clear cell papillary renal cell carcinoma,CCPRCC)是一种新近被描述的肾脏低度恶性肾细胞癌类型。文献中CCPRCC曾用名包括,如出现大量血管及平滑肌组织,被命名为肾血管平滑肌腺瘤性肿瘤( renal angiomyoadenomatous tumor,RAT);如生长方式以小管和乳头状为主则被称为透明细胞小管乳头状肾细胞癌(clear cell tubulopapillary renal cell carcinoma,CCTPRCC);与肾衰竭有关则为终末期肾病CCPRCC(clear cell papillary renal cell carcinoma of the end stage kidneys);肿瘤细胞免疫表型CK7阳性表达称为透明细胞肾细胞癌伴弥漫CK7免疫反应(clear cell renal cell carcinoma with diffuse CK7 immunoreactivity)。目前国际泌尿病理协会(ISUP)推荐使用CCTPRCC,而CCPRCC是英文文献中最多见。
目前由于CCPRCC发病率较低,对其认识仍不足,目前国内该病变文献报道较少。CCPRCC在病理形态学、免疫组织化学及生物学等方面具有独特性表现。2006年Tickoo等人研究终末期肾病(end stage renal disease,ESRD)合并的肾脏肿瘤时,发现一种由乳头状结构伴透明细胞构成的肾细胞癌,并将此命名为CCPRCC,随后发现CCPRCC也可发生于普通人群。2012年ISUP将CCPRCC归为一类新的肾细胞癌亚型,新版WHO(2016版)泌尿肿瘤分类正式将CCPRCC在内6种新的肾细胞癌亚型纳入并描述。
2 、临床特征
至今为止CCPRCC已成为发病率第4位的肾细胞癌,仅次于透明细胞肾细胞癌(clear cell renal cell carcinoma,CCRCC)、乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)和嫌色性肾细胞癌(chromophobe renal cell carcinoma,CRCC)。起初CCPRCC是在ESED患者中报道,但后续研究认为并非一定要在ESRD基础上。目前研究表明大多数CCPRCC 患者并没有初始症状。
目前英文文献报道CCPRCC占肾恶性肿瘤的3%-4%,发病年龄18-88岁,平均年龄58岁,以老年人多见。男性稍多见,男女比例约为1.3∶1。肿瘤直径为0.2 -7.5cm,临床分期基本均为T1 期,目前报道偶有肿瘤直径>7 cm者。在普通人群中CCPRCC多为单发病灶,如合并ESRD时肿瘤多发病灶较多见。CCPRCC可伴随着其他肾肿瘤,包括CCRCC、PRCC、CRCC、多房性囊性肾细胞癌 (multilocular cystic renal cell carcinoma,MCRCC)、获得性囊性肾病相关性肾细胞癌(acquired cystic disease associated renal cell carcinoma,ACD RCC)及肾嗜酸性细胞腺瘤(renal oncocytoma,RO)等。目前文献已有合并Von Hippel Lindau disease(VHL)的报道。
临床上多无明显症状,因体检时发现肾脏占位而就诊,偶有腹部疼痛、腰部疼痛、间断血尿等症状,合并ESRD患者常伴有透析,合并VHL患者常伴有中枢神经血管母细胞瘤、胰腺囊肿或肾上腺嗜铬细胞瘤等。检验学中尚无特异性肿瘤标志物。影像学上有报道肿瘤多见于肾脏中极,CT平扫时肿瘤大多密度均匀,偶可及囊性低密度灶,增强CT显示类似CCRCC,动脉期肿瘤显著强化。MR检查提示肿瘤T1 加权时呈等密度,T2加权时呈低密度。
3、 病理形态学特点
CCPRCC为局限在肾实质内的肿块,多为单发,最大径多小于5cm,但发生于ESED者常呈多灶性。肿瘤境界清楚,可见薄层的纤维性假包膜,与周围肾组织境界清楚,呈类圆形单结节,累及邻近肾组织,体积大者可累及肾盂肾盏及肾被膜,未见肾周脂肪组织侵犯,切面呈囊实性或实性,呈黄褐色或红褐色,出血坏死及钙化少见。
CCPRCC镜下具有囊性、小管/腺泡、乳头以及巢状等4种典型生长方式。既可表现为某一种生长方式,也可同时存在多种生长方式。乳头状生长方式具有特征性,如乳头局部分支、乳头纤细或乳头呈小的厚钝状。目前认为显著的分支管状结构及突出于囊内的小乳头状结构是其特征性组织形。肿瘤细胞温和、胞质透明和胞核远离基底膜是其细胞学特征表现,类似于分泌早期的子宫内膜核下空泡,腔内或囊内常见粉红色液体。肿瘤细胞小至中等大小,呈立方形或柱状,具有丰富的透明样或黏液样胞浆;细胞核为圆形或卵圆形,核仁不明显,细胞核分级低,几乎均在1-2级,仅有3级(WHO/ISUP分级)。
肿瘤间质的特征是平滑肌分化,该特征可能是该肿瘤的突出表现。间质具有丰富的毛细血管网,发育不全的血管是指间质血管缺乏弹力层,也称为“流产型”血管,是CCPRCC的另一重要表现,但并非所有病例都出现。偶有发生骨化的报道。间质内无泡沫状巨噬细胞聚集,无含铁血黄素沉积及砂砾体样结构,也无肿瘤坏死性,无肉瘤样改变和侵犯脉管的报道。目前多数学者认为这也是CCPRCC的特点。由此可见,诊断CCPRCC不能单纯依赖某一种特点,而是生长方式、细胞形态学以及间质表现三者的综合分析。
电镜:上皮细胞含有透明细胞质,细胞器较少,具有丰富的中间丝和糖原,无脂类沉积物;细胞核内有假包含体,核仁不明显;细胞膜出现短微绒毛样结构;细胞间可及发育良好的桥粒,而肿瘤细胞通过半桥粒附着于薄而宽的基底层上。
免疫组化:肿瘤细胞特征性表现为CK7阳性和CD10阴性。CK7弥漫性强阳性,几乎100%肿瘤细胞中表达。而CD10多为阴性,少数为局灶性阳性。CAIX多为弥漫性阳性,与CCRCC不同,其腺体腔面无表达,所谓“杯口状”。CAⅨ的表达与缺氧有关,在缺氧条件下调节细胞增殖,参与肿瘤的发生和发展,正常肾组织不表达。Vimentin及EMA多为阳性。AMACR、RCC大部分为阴性。PAX2和PAX8有助于证实肾细胞来源。
Leroy等人发现细胞周期蛋白D1(cyclin D1)在CCPRCC中广泛表达。此外Mantilla JG等人研究发现25例CCPRCC中19例显示GATA3核强阳性,在CCPRCC诊断中GATA3敏感性和特异性分别是76%和100%,阳性和阴性预测值分别是100%和74%,故可作为一种新的标记物用于鉴别诊断。HMWCKs阳性也是重要的免疫组化特征,但还有待于更多病例进一步研究。免疫组化染色在CCPRCC诊断中有重要价值,在选择抗体时要兼顾诊断与鉴别诊断,以提高诊断准确性。
分子遗传学:CCPRCC目前研究中既未发现 3p染色体缺失,也未能发现该肿瘤与CCRCC无关。该肿瘤虽然没有VHL基因突变,但仍出现组织缺氧诱导因子(HIF)途径活化产物的过表达。目前研究还未能在CCPRCC中发现一致的遗传学改变,故尚待进一步研究。
4、 鉴别诊断
CCPRCC需与具有透明细胞改变和乳头状结构的肾肿瘤鉴别。
①CCRCC:常与之混淆,光镜下表现非常类似,肿瘤位于肾实质内,大者可浸润和破坏肾盂肾盏,向肾被膜外侵犯,甚至转移。镜下CCRCC具有特征性窦状血管网,缺少CCPRCC的分支管状结构,肿瘤常出血坏死、囊性变和钙化。胞核分级高(WHO/ISUP分级3-4级)。免疫组化显示CK7和AMACR为阴性,CD10和RCC为阳性,CAⅨ呈“盒子状”阳性。基因检测VHL基因突变、启动子甲基化及3号染色体短臂缺失。
②PRCC:CCPRCC肿瘤细胞缺乏PRCC的肿瘤性坏死、泡沫样组织细胞、砂粒体钙化及含铁血黄素沉积。PRCC根据肿瘤细胞形态可分为两种类型:Ⅰ型肿瘤细胞较小,胞质稀少呈嗜碱性,乳头结构被覆单层立方状细胞,乳头中心常见泡沫细胞和砂砾体,胞核级别较低。Ⅱ型肿瘤细胞嗜酸性,乳头被覆多层细胞,乳头中心常见丰富嗜伊红大细胞及砂砾体和巨噬细胞,胞核级别较高。免疫组化AMACR弥漫阳性是其特征性表现,且 CD10、CK7、RCC等阳性可以鉴别。分子遗传学显示CCPRCC通常没有PRCC的第7和17号染色体的三倍体和Y染色体的缺失。
③多房囊性肾细胞癌(MCRCC):目前更名为低度恶性潜能的多房性囊性肾肿瘤, 肿瘤由纤维性假包膜围绕,切面见大小不等的囊腔,内含浆液性或血性液体。镜下肿瘤完全由多个囊腔组成,囊壁分隔内含有透明细胞,其形态与1级CCRCC类似,但无腺泡、乳头及实性结构,以囊性生长为主,肿瘤细胞具有透明胞质,免疫组化、分子遗传学均与CCRCC类似,可以与CCPRCC相鉴别。
④XP11.2易位/TFE3融合基因相关性肾细胞癌(renal cell carcinoma associated with XP11.2 translocation/TFE3 gene fusions,XP11.2RCC)XP11.2RCC是一种少见的肾癌类型,主要见于儿童和青少年。巨检肿瘤常见坏死,镜下肿瘤细胞排列成乳头状和腺泡状结构,呈单层或假复层排列,异型性显著,部分呈丰富嗜酸性胞质,核仁明显,间质内可见砂砾体或灶性出血坏死。免疫组化TFE3强阳性是其特征,此外CD10和RCC阳性,CK7、CAⅨ和AMACR为阴性。基因检测Xp11.2染色体的易位和TFE3基因融合。
5、 临床治疗及预后
CCPRCC具有惰性生物学行为,治疗方式主要为手术切除(肾脏部分切除术或者根治性切除术),并可在术后及时告知患者,该肿瘤复发及转移可能性较低,减少患者及家属的心理负担。目前为止尚无肿瘤复发转移的报道,也无因肿瘤死亡的报道。其预后良好,5年总生存率>94%。鉴于良好预后,建议对于早期肿瘤或不能耐受手术的患者行肾脏穿刺活检,通过组织病理特征性表现、免疫组化以明确诊断,在此基础上严密随访或行肿瘤微波消融等治疗。目前对于CCPRCC的发病机制尚不明确,由于其发病率较低,尚缺少大样本量长期随访资料。只有通过对大量CCPRCC的患者进行生存分析,明确其预后,才能为临床制定治疗方案提供可靠的循证医学依据。
总之,CCPRCC在病理学形态、免疫组织化学及生物学特点等方面具有独特表现,准确诊断对指导临床治疗和判断预后具有十分重要的意义。总体说CCPRCC 为一种惰性肿瘤,有文献建议命名为“低度恶性潜能的CCPRCC”,以反映其生物学行为。鉴于CCPRCC较少见所以国内的大宗随访资料还有待积累。
6 、特殊类型
2000年 Michal 等人首次报道1例RAT,肿瘤由透明的上皮样细胞和显著的平滑肌瘤性间质组成。上皮样细胞形成腺瘤样管状结构,被毛细血管网包绕。2009年Michal等人再次报道5例RAT,并对其进行免疫组化检查及基因检测,结果发现肿瘤细胞CK7、CK20和vimentin阳性,CD10阴性,而平滑肌瘤性间质HMB45阴性;无VHL基因突变以及3p基因缺失,均类似于CCPRCC,此后多名学者对此进行研究。Deml等人选择25例CCPRCC及9例RAT,通过病理形态学特征、免疫组化检查及VHL基因突变和等位基因缺失检测进行比较研究,结果发现除RAT缺少分泌细胞以及无合并ESRD,其余结果极为相似。因此目前认为RAT是CCPRCC的一种特殊类型。
1964年Melmon和Rosen总结了多篇临床报告,将中枢神经系统血管母细胞瘤合并肾脏或胰腺囊肿、嗜铬细胞瘤、肾细胞癌及外皮囊腺瘤等疾病正式命名为“Von Hippel Lindau综合征”。目前认为该病是由位于染色体3p25区的VHL基因突变引起,为常染色体显性遗传,通过负性调节血管内皮生长因子(vascular endothelial growth factor VEGF)mRNA表达而引起临床症状。目前已有数例 CCPRCC合并VHL综合征的报道,研究结果发现与普通人群CCPRCC无差异,均无3p染色体缺失。
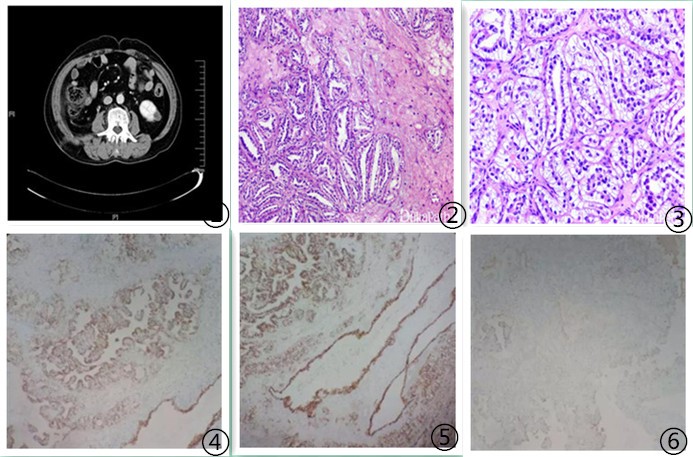
图1 CT 平扫时肿瘤大多密度均匀,偶可及囊性低密度灶 图2低倍肿瘤细胞呈乳头状生长方式,间质的特征是平滑肌分化及流产血管 图3 高倍肿瘤细胞中等大小,呈立方形;细胞核为圆形或卵圆形,核仁不明显,细胞核分级1-2级,细胞核远离基底膜类似于分泌早期的子宫内膜核下空泡 图4肿瘤细胞CK7弥漫强阳性 图5肿瘤细胞CAIX弥漫阳性 图6肿瘤细胞CD10阴性
参考文献略。图片来源于网络,如有侵权,联系删除。














共0条评论