[导读] 编译整理:强子
病理诊断原发VS.转移之皮肤篇(一)概述
病理诊断原发VS.转移之皮肤篇(二)肺、胃肠道、肝
病理避坑指南-原发VS.转移之皮肤篇-(四)乳腺及妇科
病理避坑指南-原发VS.转移之皮肤篇-(五)其他
具体癌种详解
泌尿道
泌尿道肿瘤转移至皮肤的发生率高度不一,文献中数据自0.22%至10.4%者均有。有人提出,肾细胞癌转移至皮肤的发生率约为3%。临床上,转移性肾细胞癌一般富于血管,与前述肝脏转移性肿瘤相似,具体类似Kaposi肉瘤或分叶状毛细血管瘤。膀胱、尿路上皮、前列腺肿瘤转移者,则常描述为草莓样斑块或结节,且与前述肺部肿瘤转移类似,可呈病毒感染样或带状疱疹样表现,也可具有前述玛丽约瑟夫结节表现。文献中还有前列腺癌转移至皮肤时呈“脂肪瘤”、较大炎性斑块、硬斑病样表现的报道。
肾脏透明细胞癌转移,是肾脏肿瘤转移至皮肤的最多见病理类型,这也是肾细胞癌中最常见的亚型;组织学上可表现为乳头状、巢状、梁状、囊性等。此时的关键形态学特征是显著毛细血管结构,细胞呈透明、富于糖原状,并有显著程度不一的核仁。尿路上皮癌转移至皮肤的时候可以表现为宽大条索状及片状,细胞为移行样表现的上皮。细胞核大小显著不一,具有多形性,胞质丰富、嗜酸性,有些也可见鳞状上皮样的巢状结构。前列腺癌转移至皮肤则细胞学形态相对温和,表现为程度不一的腺样结构形成。
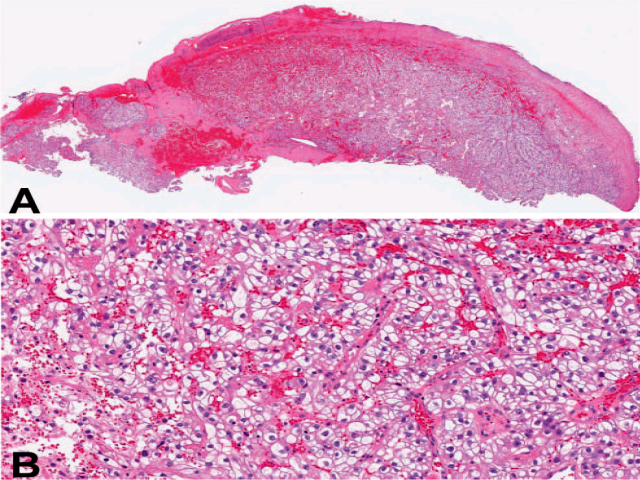
图1. 透明细胞型肾细胞癌转移至皮肤。低倍镜下,瘤细胞在真皮表浅部位呈小梁状、结节状浸润性生长,表皮有溃疡,且可见显著红细胞外渗。高倍镜下瘤细胞有大量透明胞质,细胞核稍有成角表现,有显著核仁;且有显著毛细血管网。
免疫组化方面,肾细胞癌一般不表达CK7、CK20,但表达AE1/AE3、EMA、CD31、RCC(转移性肿瘤中阳性率67%)、CD10。PAX8细胞核着色的特异性欠佳,因为该指标也可在甲状腺肿瘤、胸腺肿瘤、Mullerian来源肿瘤中表达。EMA和CD10的应用中可能会有陷阱:虽然转移性肾细胞癌中CD10的阳性率在89%至100%之间,但伴透明细胞特征的皮肤原发肿瘤也会有CD10的阳性,具体如具有皮脂腺分化的皮脂腺腺瘤、皮脂腺瘤、皮脂腺癌。皮肤原发的透明细胞汗腺瘤中CD10和EMA均可有阳性表达,也应注意这一陷阱。考虑为嫌色细胞型肾细胞癌时,肿瘤细胞一般表达PAX8、CD117,但不表达CD10。
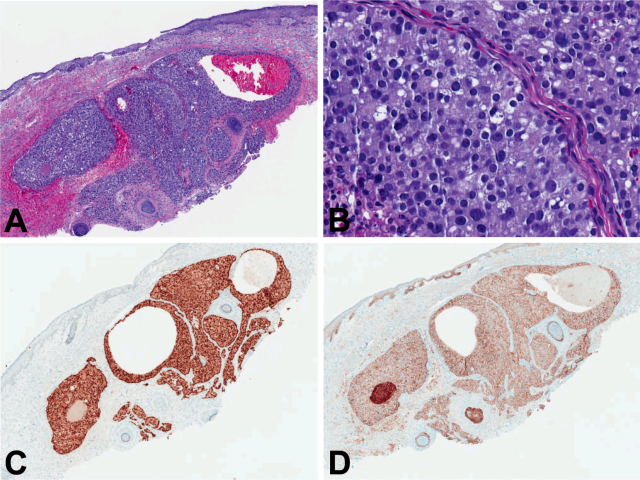
图2. 前列腺癌转移至皮肤。低倍镜下,肿瘤成分在真皮表浅及中层处浸润性生长,呈实性结节状、较大腺样结构,同时可见个别固有的皮肤附属器结构。高倍镜下,瘤细胞呈高分化表现,胞质嗜双色性,细胞核有显著核仁。免疫组化NKX3.1细胞核阳性(图C),Ber-EP4细胞膜阳性(图D)。
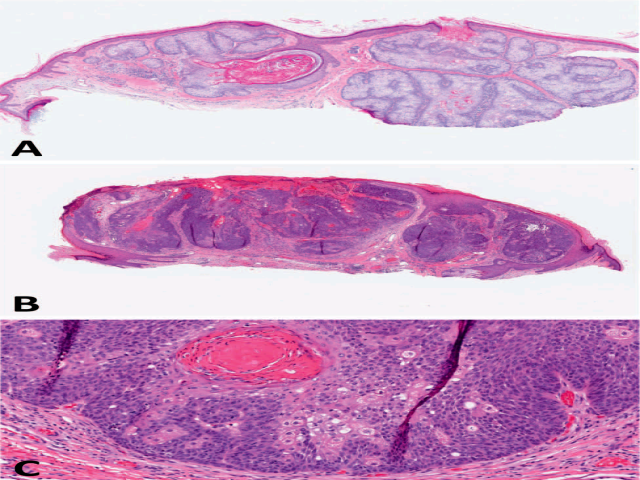
图3. 具有皮脂腺分化的皮肤附件肿瘤。(A)皮脂腺腺瘤低倍镜下境界特别清楚,呈多分叶状表现,且与表皮相连。(B)皮脂腺癌一般呈较大的结节状结构,具体为非典型基底样细胞显著增生且有坏死灶;(C)高倍观证实细胞具有基底样及透明样特征,胞质空泡状,细胞核具有非典型及显著核分裂。
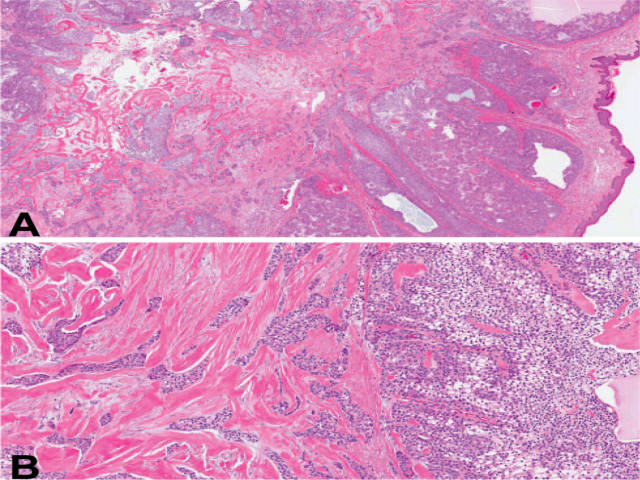
图4. 透明细胞汗腺瘤,低倍镜下表现为真皮为主的结节状,结构上为实性及囊性表现,周围有透明间质成分。虽然病变总体境界清楚,但透明细胞及基底样细胞呈岛状排列且伴有导管样、或腺样分化,可能会误判为浸润。高倍镜下,透明细胞成分并无核分裂或非典型。
总体而言,对于考虑泌尿道转移而来的病变,可以选择包括高分子量CK、CK7、CK20、p63在内的免疫组化指标,并根据具体情况再加做PAX8、GATA3、NKX3.1等;但转移性肾细胞癌与皮脂腺肿瘤的鉴别中,要注意相关标记的陷阱。尿路上皮的病变一般表达高分子量CK、CK7、p63、S100P。CK20、GATA3的阳性程度不一(前者阳性率约55%,后者阳性率约50%)。需要注意的是,尿路上皮肿瘤免疫组化与多种皮肤肿瘤会有重叠,如高分子量CK、CK7、p63。目前尚没有哪些免疫组化指标可以明确的区分出中至低分化转移性尿路上皮和与皮肤原发肿瘤。Uroplakin阳性则支持尿路上皮癌转移的诊断。前列腺癌不表达CK7、CK20,但NKX3.1、CD57、PSA阳性;而尿路上皮癌后三项为阴性。不过需要注意的是,前列腺癌也可表达Ber-EP4,而该指标一般用于证实皮肤基底细胞癌。
点击下载英文文献
参考文献
Habermehl G, Ko J. Cutaneous Metastases: A Review and Diagnostic Approach to Tumors of Unknown Origin. Arch Pathol Lab Med. 2019;143(8):943-957.
doi:10.5858/arpa.2018-0051-RA

















共0条评论